-
随着社会发展,每年有成百上千吨的废弃塑料进入环境,造成全球变暖和塑料污染等严重的环境问题[1-2],因此,开发生物基塑料是减少塑料污染的有效方法之一。聚乙醇酸(poly glycolic acid,PGA)是一种生物可降解聚合物,在自然环境中降解速度快,在堆肥、海水环境中可以降解为无毒无害的二氧化碳和水,且具有优异的生物相容性,在人体内可降解为对人体无害的乙醇酸[3-4]。此外,PGA还具有较高的热变形温度、良好的机械性能和气体阻隔性能,广泛应用于生物医学方面,如用于骨修复的螺钉和针、组织工程的支架、血管支架或手术缝合线等[4-6]。PGA在食品接触材料方面也得到应用,但目前法规尚未明确PGA材料及其制品是否可用于食品接触材料。
目前,关于PGA安全性的报道较少,仅有少量文献报道了PGA材料的单体乙醇酸是天然代谢产物[7],尚未对其低聚物开展深入研究。低聚物是包含少量低质量分子重复单元的聚合反应中间体,一般由加成或缩合反应产生,是聚合反应中很容易出现的副产物[8]。关于PGA低聚物的研究大多聚焦于其他塑料通过引入PGA低聚物形成改性材料,从而提高塑料的降解率或物理性能[9-10]。Casalini等[11]利用原子角色塑造方法研究了含有3个单元PGA的低聚物结构,但未见3个以上单元PGA低聚物结构的报道。这些低聚物属于材料中的非有意添加物(non intentionally added substances, NIAS),可能存在安全隐患,需引起关注。
超高效液相色谱-串联四极杆飞行时间质谱(UHPLC-QTOF MS)具有分辨率高、灵敏度高的特点,可以提供精确的母离子信息和丰富的碎片离子结构信息,是分析未知物的有力手段,已成功应用于材料领域未知物的非靶向筛查[12-13]。Brenz等[14]采用UHPLC-QTOF MS技术鉴定了聚对苯二甲酸乙二醇酯(PET)中的线性与环状低聚物,并研究了不同低聚物在模拟物中的迁移量。Ubeda等[15]使用相同的方法研究原生与再生PET中的低聚物,发现2种材料的低聚物种类一致。对于聚合塑料,该方法可快速、准确地鉴别出其所含有的低聚物类型。
为研究PGA样品中可能存在的低聚物,本文采用UHPLC-QTOF MS法对PGA样品在不同应用场景下(低温食品的包装容器或器具、短期储存的热罐装一次性容器以及热饮餐具及容器)低聚物在不同食品模拟物中的迁移量进行分析,以期为食品接触用PGA材料及其制品的应用和安全风险评估提供技术支持。
-
1290-6546超高效液相色谱-串联四极杆飞行时间质谱仪:美国Agilent公司产品,配有电喷雾电离(ESI)源;电子天平(感量
0.0001 g):瑞士梅特勒-托利多公司产品;Milli-Q50 超纯水仪:德国密理博公司产品;精密鼓风干燥箱:上海三腾仪器有限公司产品;AS 7240BT超声波发生器:天津奥特赛恩斯公司产品。PGA样品(PGA含量100%):由某公司提供;邻苯二甲酸丁基苄基酯-d4(BBP-d4,≥97%):北京曼哈格生物科技有限公司产品;双酚S(BPS≥95%):中国上海安谱实验科技股份有限公司产品;乙醇:分析纯,上海阿拉丁生化科技股份有限公司产品;甲醇、甲酸:均为色谱纯,美国Fisher Chemical公司产品。
-
分别称取各10 mg BBP-d4和BPS标准品,用甲醇定容至 10 mL容量瓶中,得到1 000 mg/L单标储备溶液。分别移取100 μL 2种标准储备溶液,用甲醇定容至 10 mL容量瓶中,得到10 mg/L混合标准中间溶液。
-
准确称量
0.2000 g样品于150 mL锥形瓶中,加入10 mL六氟异丙醇,同时加入半定量标准物质,密封,置于室温24 h,以确保低聚物完全溶解。将溶解后的液体逐滴加入10 mL甲醇溶液中沉淀,不断晃动锥形瓶,于室温下静置1 h。随后将混合液超声10 min并转入50 mL离心管中,以9 000 r/min离心5 min,取上清液于试管中,用5 mL甲醇润洗离心管3次,离心后合并,加入同一试管,氮吹至干,用1 mL甲醇复溶,转移至离心管,以13 000 r/min离心5 min,取上清液,过0.45 μm尼龙滤膜,即得待测液。以上实验重复3次。 -
PGA样品预期可能接触酸性食品、非酸性食品、含酒精饮料,并预期作为低温食品(冰淇淋、酸奶、冻肉等)的包装容器或器具、短期储存的热罐装一次性容器以及热饮餐具及容器。根据GB 31604.1−2023[16]要求和样品预期使用条件,选择4%乙酸、10%乙醇与50%乙醇作为相应的食品模拟物,并模拟3个应用场景:1)不在容器进行热处理;2)T≤70 ℃、t≤2 h或T≤100 ℃、t≤15 min热罐装及巴氏消毒后,不再在室温或低于室温条件下长期贮存;3)T≤100 ℃、t≥15 min条件下使用,如蒸煮或沸水消毒。因此,迁移实验条件分别是:1)20 ℃, 10 d;2)70 ℃, 2 h;3)100 ℃, 1 h。根据GB 5009.156−2016标准[17]及样品形状,以接触面积-体积之比为6,全浸泡方式开展迁移实验。迁移实验结束,待浸泡液温度降至室温,混匀,过0.45 μm尼龙滤膜,即得待测液。向0.9 mL待测液中加入100 μL 10 mg/L混合标准中间溶液,混匀,待上机。以上实验重复3次。
-
Poroshell EC-C18色谱柱(150 mm×3.0 mm, 2.7 μm);流动相:A为0.1%甲酸水溶液,B为甲醇;梯度洗脱条件:0~1.50 min(5%B),1.50~25.00 min(5%~98%B),25.00~32.00 min(98%B),32.00~32.10 min(98%~5%B),32.10~35.00 min(5%B);流速0.30 mL/min;进样量3 μL。
-
ESI源;质量扫描范围m/z 100~1 700 ,扫描速率4 spectra/s;干燥气流速8 L/min;鞘气温度350 ℃;鞘气流速12 L/min;毛细管电压分别为4 000、3 500 V;喷嘴电压1 000 V;毛细管出口电压150 V;锥孔电压65 V;碰撞能量梯度为10、20、40 eV。
-
分别用BBP-d4、BPS对环状低聚物和线性低聚物进行半定量分析,将试样溶液中检出的低聚物峰面积与内标物峰面积进行计算,得到试样溶液中低聚物的浓度。
-
使用MassHunter qualitative analysis 10.0(美国安捷伦科技公司产品)分析数据。通过自动提取MS/MS生成质量数符合低聚物分子式的候选物质化学式,筛选出得分≥80、峰面积高于空白10倍且响应超过104且在2个平行样品中均出现的物质,经空白减法、化合物裂解规律、保留时间、二级质谱碎片离子峰分布规律等方式鉴定低聚物。采用SPSS 23.0 进行单因素方差分析(analysis of variance,ANOVA),邓肯法(Duncan’s)进行组间显著性差异分析,显著性水平为P<0.05。
-
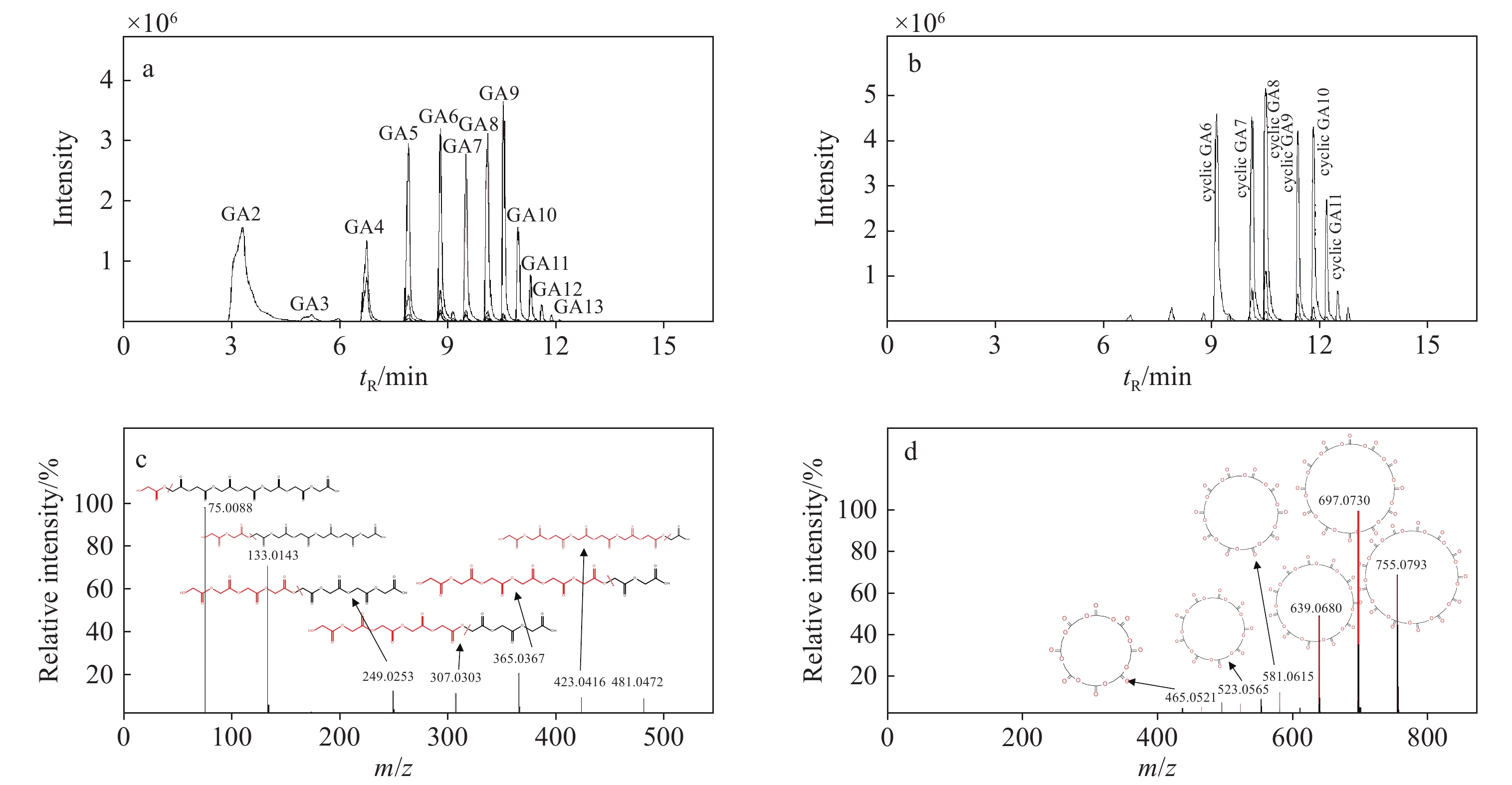
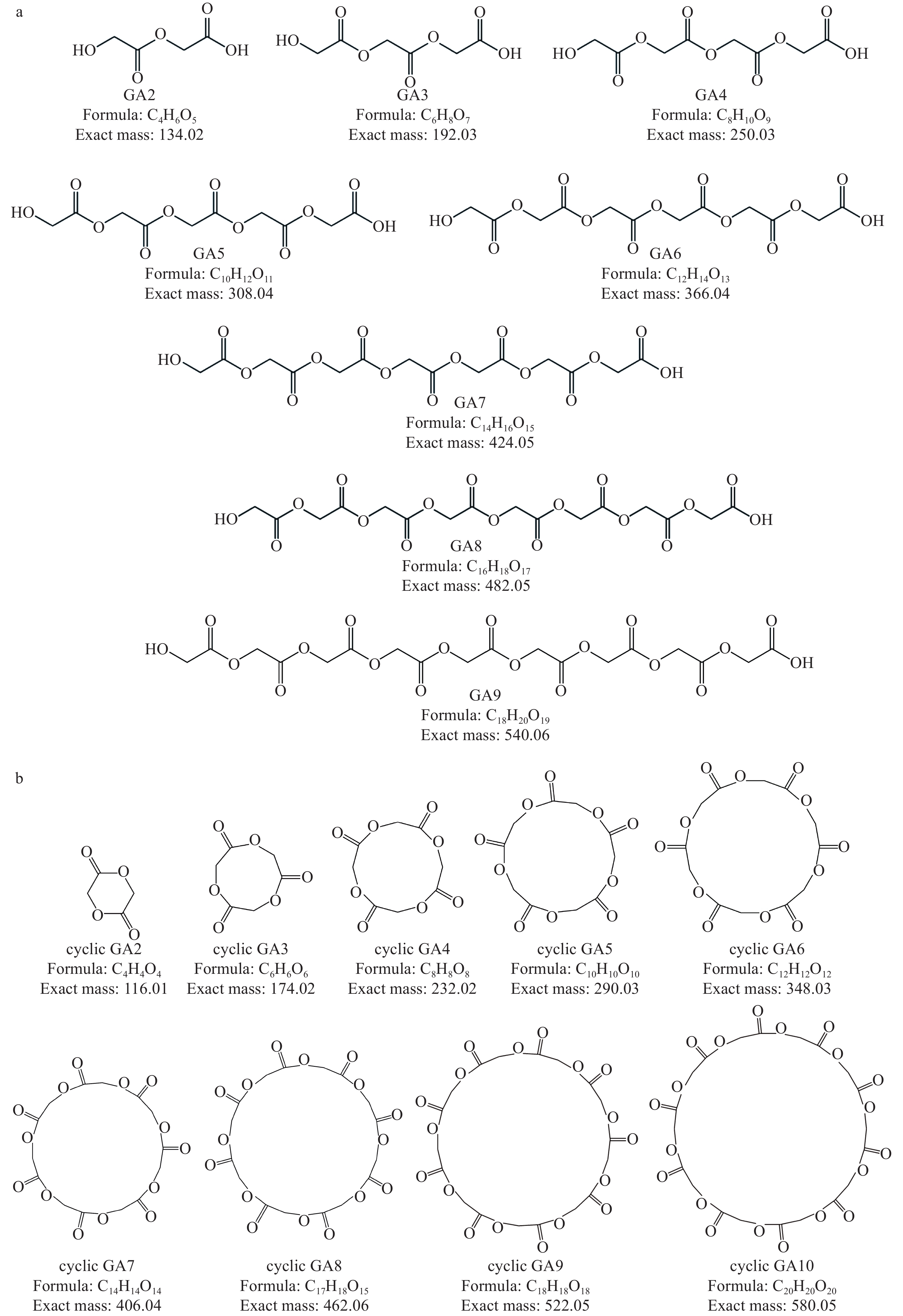
PGA低聚物是由不同环状和线性结构组成的复杂混合物,一般没有商业标准品。因此,通过PGA的合成工艺(乙醇酸缩聚和乙交酯开环聚合)[3],推测出PGA低聚物的可能结构,部分线性和环状低聚物的结构示于图1。研究表明[18],分子质量大于1 000的物质被胃肠道吸收的可能性较小。因此,本研究仅推导分子质量小于1 000的PGA低聚物的可能结构,并以此作为筛查依据。PGA样品中低聚物的检测色谱图示于图2a和2b,共检测到12个线状低聚物和9个环状低聚物。通过对比低聚物的色谱图发现,低聚物出峰时间随着聚合单元数增加而延后,线性低聚物中,各低聚物按分子质量大小依次出峰,GA2出峰时间最早,GA13最晚;环状低聚物亦如此,cyclic GA6出峰最早,cyclic GA11出峰最晚。
同时,各低聚物的二级质谱图显示出结构上的相似性。线性低聚物为多个乙醇酸脱水聚合而成,在裂解时,高聚合的低聚物逐个脱去−CH2COO−,如GA8(m/z
481.0472 )在裂解中形成m/z423.0416 (GA8−CH2COOH)、365.0367 (GA8−CH2COO−CH2COOH)、307.0303 (GA8−(CH2COO)2−CH2COOH)、249.0253 (GA8−(CH2COO)3−CH2COOH),最后裂解为二聚体(m/z133.0143 )与单体(乙醇酸,m/z75.0088 ),其二级质谱图和可能的裂解规律示于图2c。环状低聚物裂解时需要先开环,然后不断丢失−CH2COO−,形成比较明显的相差m/z 58.01的碎片离子,如cyclic GA13(m/z755.0793 )先后共失去5个−CH2COO−,分别形成 m/z697.0730 、639.0680 、581.0615 、523.0565 、465.0521 等碎片离子,其二级质谱图及可能的裂解规律示于图2d。因此,研究低聚物的裂解规律可使结果鉴定更准确,同时有助于分析分子质量更大的PGA低聚物的二级质谱图。 -
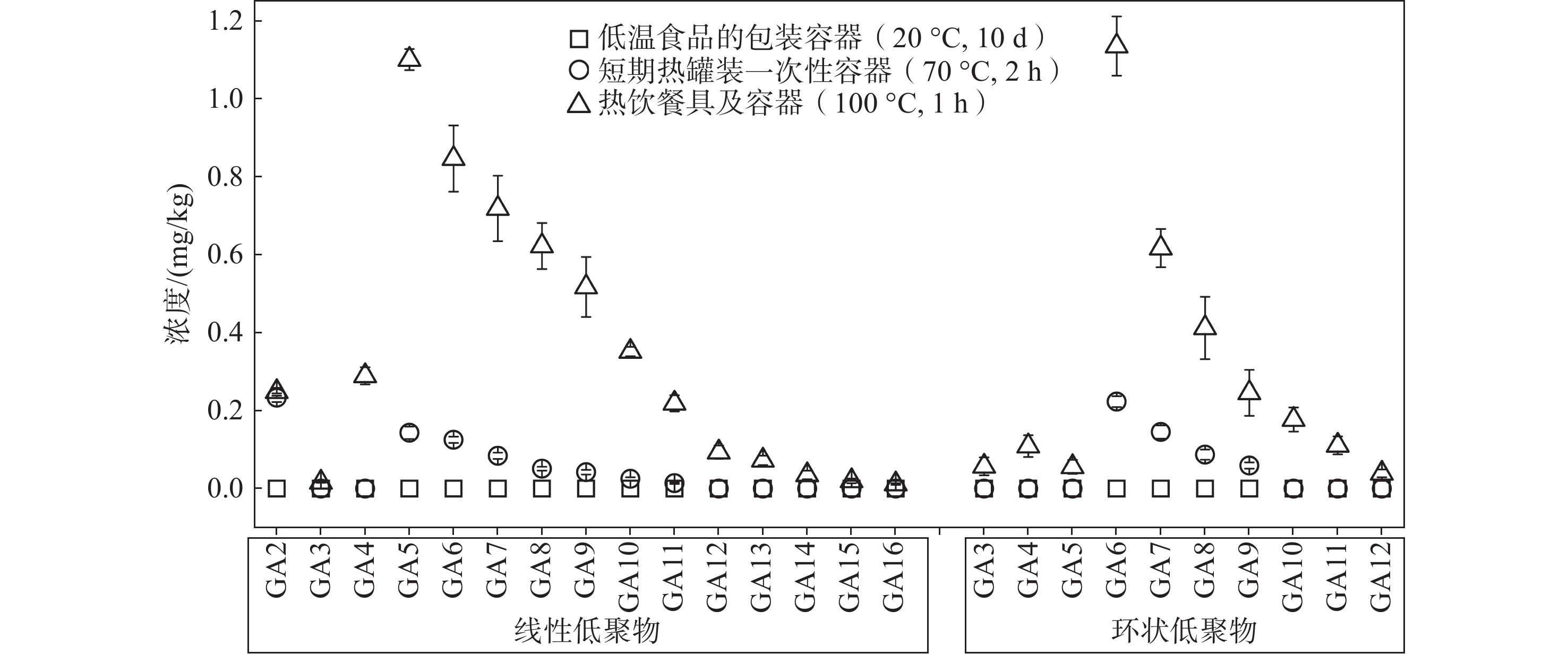
根据PGA样品中低聚物的鉴定结果可知,PGA样品中存在聚合度不同的低聚物,当其作为食品接触材料时,亟需探究低聚物是否会迁移到食品中。因此,本工作研究了3种不同应用场景下PGA样品中低聚物的迁移情况,结果列于表1。当PGA样品作为低温食品的包装容器或器具时(20 ℃, 10 d),在4%乙酸、10%乙醇以及50%乙醇模拟液中均未检出低聚物,表明在低温条件下,PGA样品接触酸性食品、非酸性食品、含酒精饮料均无低聚物迁出,对食品安全影响不大;而在短期储存的热罐装一次性容器(70 ℃, 2 h)和热饮餐具及容器(100 ℃, 1 h)中,分别检出14种(10种线性低聚物,4种环状低聚物)和25种(15种线性低聚物,10种环状低聚物)低聚物,表明PGA样品经热处理后会有低聚物迁移到食品中,且温度越高,低聚物的种类越多。同时,在相同的食品模拟液中,PGA样品在迁移条件为100 ℃, 1 h时检出的大部分低聚物浓度显著高于迁移条件为70 ℃, 2 h(P<0.05)时,主要原因是PGA具有较差的热稳定性,易发生热降解,在高温条件下极易产生低聚物[3],而且温度升高可为物质迁移提供更多能量,加速聚合物链段运动,并提供更多分子运动的通道[19]。此外,在相同环境下,线性低聚物(GA2~GA6)和环状低聚物(cyclic GA3~cyclic GA12)在3种食品模拟液中的迁移量大小顺序分别为4%乙酸>10%乙醇>50%乙醇,50%乙醇>10%乙醇>4%乙酸。据此推测,线性PGA低聚物与4%乙酸的亲和性较强;环状低聚物与乙醇的亲和性较强,且乙醇含量越高,环状低聚物的浓度越高,这可能与低聚物的结构有关。线性PGA低聚物含有1个羧基和1个羟基,由于极性相近,其在4%乙酸中的溶解性更强,更容易从PGA样品中迁移出来;而环状PGA低聚物含有不同数量的酯基,相比羧基,酯基与乙醇中的羟基亲和性更强,更容易从50%乙醇的食品模拟液中迁移出来。
-
PGA作为一种生物可降解聚合物,其骨架具有极强的可水解性。PGA的降解贯穿整个材料,从与水的反应开始水解,然后发生聚合物链中酯键的随机断裂。在反应过程中,降解方式分为水解及裂解诱导结晶,随后在结晶区进一步完成降解[20-21]。此外,由于羧基端基增加,pH值降低,PGA降解速率加快,最后逐渐完成降解[8, 21]。Hurrell等[22]研究了PGA水解机理,认为降解过程分4个阶段,受水扩散和过程水解速率的共同驱动。在第1阶段,水迅速扩散到聚合物中,并在几小时内达到聚合物中的最大浓度;在第2阶段,随着水解反应的开始,水的扩散变得更慢,分子质量稳步下降,这与Chu[23]的报道类似,分子质量的降低和水在非结晶区域的流动导致非结晶区域中低聚物迁移率的增大;在第3阶段,分子质量达到临界值,第2阶段产生的低聚物开始从聚合物表面扩散到溶液中,随着低聚物的扩散,使PGA内部产生更多空间,更多的水分子可以快速扩散,降解速率不断提高,并对整个样品实现快速降解;在第4阶段,低聚物进一步分解[24]。
在不同应用场景下,仅有在迁移条件为20 ℃, 10 d的食品模拟液中未鉴定出低聚物,而在高温场景(迁移条件为70 ℃, 2 h和100 ℃, 1 h)均检出多种低聚物,且在迁移条件为100 ℃, 1 h场景中,低聚物种类更多,迁移量更高,这主要是因为聚合物分解动力学过程的速率取决于样品的温度和在该温度下持续的时间[25]。PGA样品在接触食品模拟液后开始缓慢降解,高温环境加快了食品模拟液在PGA样品的流动性以及扩散速率,低聚物在PGA样品表面不断形成,慢慢迁移到食品模拟液中。同时,本研究发现低聚物的浓度随着分子质量的增大先上升后降低,线性GA5和环状GA6低聚物浓度最高,无论是线性还是环状低聚物,GA6~GA8都保持较高的浓度,示于图3。这可能是由于非结晶区是无定形状态,水分子逐渐扩散,酯键开始断裂,将PGA样品中的连接链段断裂为长链低聚物,而这种链断裂通常先断裂长链分子,然后再降解为短链低聚物,短链低聚物的分子质量较低,更易在非结晶区域迁移到模拟液中[23, 26],长链低聚物分子质量较大,较难迁移到模拟液中,同时短链低聚物能够自我重组,从无序状态到有序状态,容易形成长链形态以及环状形态[23]。相比于长链低聚物,短链低聚物结构不稳定,GA2~GA4容易被食品模拟液快速水解,重组能力降低。因此,GA2~GA4迁移量较低,GA6~GA8迁移量较高,GA8及以上长链低聚物迁移量逐渐降低。
-
本文利用UHPLC-QTOF MS对PGA低聚物进行筛查分析,从 PGA样品中鉴定出12种线性低聚物和9种环状低聚物,并发现每种类型低聚物的保留时间随其分子质量增大而增大,同时,高聚合度的PGA低聚物裂解时会产生低聚合度的分子离子峰,在二级质谱图上呈现一定的规律性。在3种实际应用场景下,当PGA制品用作低温食品包装时,在4%乙酸、10%乙醇以及50%乙醇的食品模拟液中均未检出PGA低聚物,对食品影响不大;当用作短期热罐装容器、热饮餐具时,均有线性和环状低聚物检出,且迁移量较高,尤其是线性GA5~GA8,cyclic GA6~cyclic GA8。上述低聚物可能的形成机理是PGA的非结晶区是无定形状态,水分子逐渐扩散后酯键开始断裂,再降解为短链低聚物,短链低聚物更容易在非结晶区域迁移到模拟液中,分子质量较大的长链低聚物较难迁移到模拟液中,同时短链低聚物通过自我重组更容易形成链状和环状低聚物。以上研究结果表明,温度对PGA样品中低聚物的形成影响较大,且环境温度越高,检出的低聚物种类越多且迁移量越高。因此,当PGA材料及制品在高温环境下储存酸性食品、非酸性食品及含酒精饮料时,需要关注低聚物的迁移风险。
三种应用场景中聚乙醇酸低聚物的迁移和形成机理研究
Study on Migrants and Formation Mechanism of Polyglycolic Acid Oligomers in Three Distinct Application Scenarios
-
摘要: 聚乙醇酸(poly glycolic acid,PGA)是一种生物可降解聚合物,具有良好的性能。但是,用作食品接触材料时,需关注PGA中乙醇酸低聚物迁移至食品中的风险。本文建立了超高效液相色谱-串联四极杆飞行时间质谱(UHPLC-QTOF MS)法筛查分析食品模拟液中PGA低聚物,并研究PGA样品在低温食品的包装容器或器具、短期储存的热罐装一次性容器以及热饮餐具及容器3种应用场景中在酸性食品、非酸性食品和含酒精饮料中的迁移情况。结果表明,当PGA样品用作低温食品包装容器时,在食品模拟物4%乙酸、10%乙醇和50%乙醇中均未检出PGA低聚物;而用作短期热罐装和热饮餐具及容器时,在3种食品模拟物中均检出多种线性低聚物及环状低聚物,且线性GA5-GA8和cyclic GA6-cyclic GA8的迁移量较高。上述低聚物可能的形成机理是:PGA的非结晶区是无定形状态,水分子逐渐扩散后酯键开始断裂,将链段断裂为长链低聚物,长链低聚物经过多次断裂降解为短链低聚物。由于短链低聚物的分子质量较小,更容易在非结晶区域迁移到模拟液中,同时短链低聚物能够自我重组,从无序状态到有序状态,容易形成链状和环状的低聚物。本研究表明,温度对PGA样品中低聚物的形成影响较大,应用场景温度越高,检出的低聚物种类越多且迁移量越高。因此,用PGA材料及其制品在高温场景下储存酸性食品、非酸性食品及含酒精饮料时,需要关注低聚物的迁移情况。
-
关键词:
- 超高效液相色谱-串联四极杆飞行时间质谱(UHPLC-QTOF MS) /
- 聚乙醇酸 /
- 低聚物 /
- 迁移量 /
- 食品接触材料
Abstract: Poly (glycolic acid) (PGA) is an environmentally friendly, biodegradable polymer commonly utilized in biomedical applications. Due to its high thermal deformation temperature, favorable mechanical properties, and effective gas barrier capabilities, PGA has potential application as food contact materials. However, current regulations do not explicitly involve the use of PGA in food contact applications, particularly the migration of oligomers. The potential migration of oligomers from PGA into food must be carefully considered. In this study, a method of ultra-high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry (UHPLC-QTOF MS) was developed for the determination of PGA oligomers. The migration of oligomers in three distinct scenarios were investigated, i.e. packaging for frozen food, disposable containers with heat packaging for short-term storage, and containers for hot food and beverages. These scenarios were assessed in various food simulants, including acidic foods, non-acidic foods, and alcoholic beverages. The results showed that a total of 21 oligomers in PGA samples are identified, including 12 linear oligomers and 9 cyclic oligomers. Notably, the retention time of these oligomers increases with the increase of number of polymerization units. When PGA was employed as packaging for frozen foods, no oligomers are detected in food simulants containing 4% acetic acid, 10% ethanol, or 50% ethanol. In contrast, a variety of linear and cyclic PGA oligomers are identified in the three food simulants when PGA was used for disposable containers with heat packaging and for hot food and beverages. This is particularly evident for linear oligomers GA5 to GA8 and cyclic oligomers GA6 to GA8. The potential mechanisms underlying the migration and formation of these oligomers can be explained that the non-crystalline regions of PGA are an amorphous state, where ester bonds are prone to gradual hydrolysis, facilitated by the diffusion of water molecules. This hydrolysis leads to the cleavage of chain segments, resulting in the generation of long-chain oligomers. Short-chain oligomers, characterized by lower molecular weights, exhibit a higher tendency to migrate into surrounding solutions, particularly within the non-crystalline regions formed by the degradation of long-chain oligomers. Furthermore, short-chain oligomers can undergo self-reorganization from a disordered to an ordered state, facilitating the formation of both linear and cyclic oligomers. Temperature also significantly influences the formation of PGA oligomers, and elevated temperatures lead to a greater variety of oligomers and increased migration concentrations. Therefore, the migration of PGA oligomers into food should be carefully considered in scenarios involving the storage of acidic foods, non-acidic foods, and alcoholic beverages at high temperature. -

-
表 1 PGA样品在不同应用场景中低聚物的迁移量
Table 1. Migrants of oligomers in PGA samples under different conditions
名称
Name迁移量 Migrant/(mg/kg) 20 ℃,10 d 70 ℃,2 h 100 ℃,1 h 4%乙酸
4% Acetic
acid10%乙醇
10%
Ethanol50%乙醇
50%
Ethanol4%乙酸
4% Acetic
acid10%乙醇
10%
Ethanol50%乙醇
50%
Ethanol4%乙酸
4% Acetic
acid10%乙醇
10%
Ethanol50%乙醇
50%
EthanolGA2 — — — 0.265±0.014Ab 0.305±0.026Ab 0.233±0.011Aa 0.362±0.013Bc 0.296±0.011Ab 0.249±0.010Aa GA3 — — — — 0.014±0.003Aa — 0.070±0.003Ac 0.049±0.002Bb 0.016±0.001Aa GA4 — — — 0.048±0.004Aa 0.067±0.004Ab — 0.377±0.025Bb 0.273±0.011Ba 0.289±0.022Aa GA5 — — — 0.176±0.008Ab 0.145±0.011Aa 0.143±0.016Aa 1.075±0.035Bb 0.835±0.016Ba 1.101±0.027Bb GA6 — — — 0.192±0.009Ac 0.173±0.007Ab 0.125±0.008Aa 1.330±0.028Bc 1.040±0.042Bb 0.846±0.085Ba GA7 — — — 0.132±0.011Ab 0.109±0.026Aab 0.084±0.008Aa 1.162±0.021Bc 0.934±0.034Bb 0.718±0.084Ba GA8 — — — 0.074±0.001Ab 0.060±0.005Aa 0.051±0.005Aa 0.893±0.013Bc 0.736±0.037Bb 0.622±0.059Ba GA9 — — — 0.056±0.002Ab 0.039±0.014Aa 0.042±0.006Aa 0.595±0.006Ba 0.533±0.029Ba 0.517±0.077Ba GA10 — — — 0.030±0.002Ab 0.020±0.004Aa 0.025±0.004Aa 0.360±0.008Ba 0.344±0.017Ba 0.352±0.012Ba GA11 — — — 0.016±0.001Aa 0.011±0.003Aa 0.014±0.002Aa 0.193±0.001Ba 0.187±0.013Ba 0.219±0.021Ba GA12 — — — — — — 0.088±0.004Aa 0.076±0.007Aa 0.093±0.017Aa GA13 — — — — — — 0.057±0.001Aa 0.055±0.004Aa 0.072±0.012Aa GA14 — — — — — — 0.028±0.002Aa 0.023±0.003Aa 0.035±0.011Aa GA15 — — — — — — 0.014±0.002Aa 0.012±0.004Aa 0.020±0.006Aa GA16 — — — — — — — — 0.011±0.002Aa cyclic GA3 — — — — — — 0.051±0.002Ab 0.032±0.002Aa 0.057±0.023Aab cyclic GA4 — — — — — — 0.083±0.004Ab 0.058±0.001Aa 0.109±0.028Ac cyclic GA5 — — — — — — 0.097±0.002Ab 0.066±0.005Aa 0.056±0.018Aa cyclic GA6 — — — 0.142±0.004Aa 0.173±0.014Ab 0.223±0.014Ac 0.711±0.011Ba 0.867±0.001Bb 1.135±0.076Bc cyclic GA7 — — — 0.076±0.002Aa 0.093±0.004Ab 0.145±0.017Ac 0.290±0.008Ba 0.375±0.005Bb 0.617±0.049Bc cyclic GA8 — — — 0.048±0.003Aa 0.062±0.006Ab 0.087±0.013Ac 0.181±0.002Ba 0.251±0.002Bb 0.412±0.80Bc cyclic GA9 — — — — — 0.059±0.008Aa 0.064±0.001Aa 0.103±0.003Ab 0.246±0.059Bc cyclic GA10 — — — — — — 0.043±0.004Aa 0.076±0.004Ab 0.177±0.031Ac cyclic GA11 — — — — — — 0.028±0.001Aa 0.048±0.003Ab 0.111±0.023Ac cyclic GA12 — — — — — — — — 0.039±0.010Aa 注:—表示未检出;同行上标大写字母表示同一食品模拟液下差异显著(P<0.05);同行上标小写字母表示同一应用场景下差异显著(P<0.05) -
[1] NORTON M. Tackling the challenge of packaging plastic in the environment[J]. Chemistry, 2020, 26(35): 7 737-7 739. [2] KALE S K, DESHMUKH A G, DUDHARE M S, PATIL V B. Microbial degradation of plastic: a review[J]. Journal of Biochemical Technology, 2015, 6(2): 952 -961 .[3] JEM K J, TAN B. The development and challenges of poly (lactic acid) and poly (glycolic acid)[J]. Advanced Industrial and Engineering Polymer Research, 2020, 3(2): 60 -70 . doi: 10.1016/j.aiepr.2020.01.002[4] HIRAOKA Y, KIMURA Y, UEDA H, TABATA Y. Fabrication and biocompatibility of collagen sponge reinforced with poly (glycolic acid) fiber[J]. Tissue Engineering, 2003, 9(6): 1 101-1 112. [5] ROBERTS A D, HART D M. Polyglycolic acid and catgut sutures, with and without oral proteolytic enzymes, in the healing of episiotomies[J]. Preventive Medicine Reports, 1983, 90(7): 650 -653 .[6] BOLAND E D, TELEMECO T A, SIMPSON D G, WNEK G E, BOWLIN G L. Utilizing acid pretreatment and electrospinning to improve biocompatibility of poly (glycolic acid) for tissue engineering[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2004, 71B(1): 144 -152 . doi: 10.1002/jbm.b.30105[7] TANG S, LI G, ZHANG R, HUANG L, TANG H. In vitro degradation of polyglycolic acid synthesized by a one-step reaction[J]. Journal of Polymer Engineering, 2014, 34(7): 591 -596 . doi: 10.1515/polyeng-2014-0005[8] ZHANG Z, ORTIZ O, GOYAL R, KOHN J. Biodegradable polymers[M]//Handbook of Polymer Applications in Medicine and Medical Devices. Amsterdam: Elsevier, 2014: 303-335. [9] YOU Y, YOUK J H, LEE S W, MIN B M, LEE S J, PARK W H. Preparation of porous ultrafine PGA fibers via selective dissolution of electrospun PGA/PLA blend fibers[J]. Materials Letters, 2006, 60(6): 757 -760 . doi: 10.1016/j.matlet.2005.10.007[10] SPEARMAN S S, RIVERO I V, ABIDI N. Influence of polycaprolactone/polyglycolide blended electrospun fibers on the morphology and mechanical properties of polycaprolactone[J]. Journal of Applied Polymer Science, 2014, 131(9): e40224. doi: 10.1002/app.40224 [11] CASALINI T, ROSSI F, SANTORO M, PERALE G. Structural characterization of poly-l-lactic acid (P(L)LA) and poly (glycolic acid) (PGA) oligomers[J]. International Journal of Molecular Sciences, 2011, 12(6): 3 857-3 870. [12] BENTAYEB K, BATLLE R, ROMERO J, NERÍN C. UPLC-MS as a powerful technique for screening the nonvolatile contaminants in recycled PET[J]. Analytical and Bioanalytical Chemistry, 2007, 388(5): 1 031-1 038. [13] AZNAR M, RODRIGUEZ-LAFUENTE A, ALFARO P, NERIN C. UPLC-Q-TOF-MS analysis of non-volatile migrants from new active packaging materials[J]. Analytical and Bioanalytical Chemistry, 2012, 404(6): 1 945-1 957. [14] BRENZ F, LINKE S, SIMAT T J. Linear and cyclic oligomers in PET, glycol-modified PET and Tritan™ used for food contact materials[J]. Food Additives & Contaminants Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2021, 38(1): 160-179. [15] UBEDA S, AZNAR M, NERÍN C. Determination of oligomers in virgin and recycled polyethylene terephthalate (PET) samples by UPLC-MS-QTOF[J]. Analytical and Bioanalytical Chemistry, 2018, 410(9): 2 377-2 384. [16] GB 31604.1−2023 食品安全国家标准 食品接触材料及制品迁移试验通则[S]. 北京: 中国标准出版社, 2023. [17] GB 5009.156−2016 食品安全国家标准 食品接触材料及制品迁移试验预处理方法通则[S]. 北京: 中国标准出版社, 2016. [18] SILANO V, BOLOGNESI C, CASTLE L, CRAVEDI J P, ENGEL K H, FOWLER P, FRANZ R, GROB K, GÜRTLER R, HUSØY T, KÄRENLAMPI S, MENNES W, MILANA M R, PENNINKS A, de FÁTIMA TAVARES POÇAS M, SMITH A, TLUSTOS C, WÖLFLE D, ZORN H, ZUGRAVU C A. Note for guidance for the preparation of an application for the safety assessment of a substance to be used in plastic food contact materials[J]. EFSA Journal, 2008, 6(7): 2 903. [19] 李波, 白艳红, 栗俊广, 许泽宇, 朱沛源. 发泡餐盒中苯乙烯单体和低聚物的测定及迁移风险评估[J]. 食品安全质量检测学报, 2021, 12(20): 8 279-8 286. LI Bo, BAI Yanhong, LI Junguang, XU Zeyu, ZHU Peiyuan. Determination and migration risk assessment of styrene monomer and oligomers in expanded polystyrene food containers[J]. Journal of Food Safety and Quality, 2021, 12(20): 8 279-8 286(in Chinese). [20] YOU Y, MIN B M, LEE S J, LEE T S, PARK W H. In vitro degradation behavior of electrospun polyglycolide, polylactide, and poly (lactide-co-glycolide)[J]. Journal of Applied Polymer Science, 2005, 95(2): 193-200. [21] 马超, 马兰荣, 魏辽, 尹慧博, 林祥. 聚乙醇酸材料的加工改性及其水下降解特性的研究进展[J]. 中国塑料, 2022, 36(9): 74 -84 . MA Chao, MA Lanrong, WEI Liao, YIN Huibo, LIN Xiang. A review of modification processing and water-soluble degradation ability of polyglycolic acid material[J]. China Plastics, 2022, 36(9):74 -84 (in Chinese).[22] HURRELL S, CAMERON R E. Polyglycolide: degradation and drug release. Part I: changes in morphology during degradation[J]. Journal of Materials Science: Materials in Medicine, 2001, 12(9): 811 -816 . doi: 10.1023/A:1017925019985[23] CHU C C. Hydrolytic degradation of polyglycolic acid: tensile strength and crystallinity study[J]. Journal of Applied Polymer Science, 1981, 26(5): 1 727-1 734. [24] HURRELL S, MILROY G E, CAMERON R E. The distribution of water in degrading polyglycolide. Part I: sample size and drug release[J]. Journal of Materials Science: Materials in Medicine, 2003, 14(5): 457 -464 . doi: 10.1023/A:1023271003571[25] AYYOOB M, LEE D H, KIM J H, NAM S W, KIM Y J. Synthesis of poly (glycolic acids) via solution polycondensation and investigation of their thermal degradation behaviors[J]. Fibers and Polymers, 2017, 18(3): 407 -415 . doi: 10.1007/s12221-017-6889-1[26] LI S. Hydrolytic degradation characteristics of aliphatic polyesters derived from lactic and glycolic acids[J]. J Biomed Mater Res, 1999, 48(3): 342 -353 . doi: 10.1002/(SICI)1097-4636(1999)48:3<342::AID-JBM20>3.0.CO;2-7 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: