-
低温生物医学是一门涉及工程学、生物学、医学等多领域交叉的前沿学科,旨在探寻低温下生物体内物质与能量传输的相互规律,并将低温材料与技术推广到医学实践中。低温治疗和低温保存是低温生物医学两个重要的研究方向,经过长期的科研探索和临床发展,低温生物医学已在诸如肿瘤治疗、辅助生殖、再生医学和组织工程等[1-4]方面实现了广泛应用,为肿瘤的绿色化治疗和生物样本的长期保存提供了重要的技术支撑。
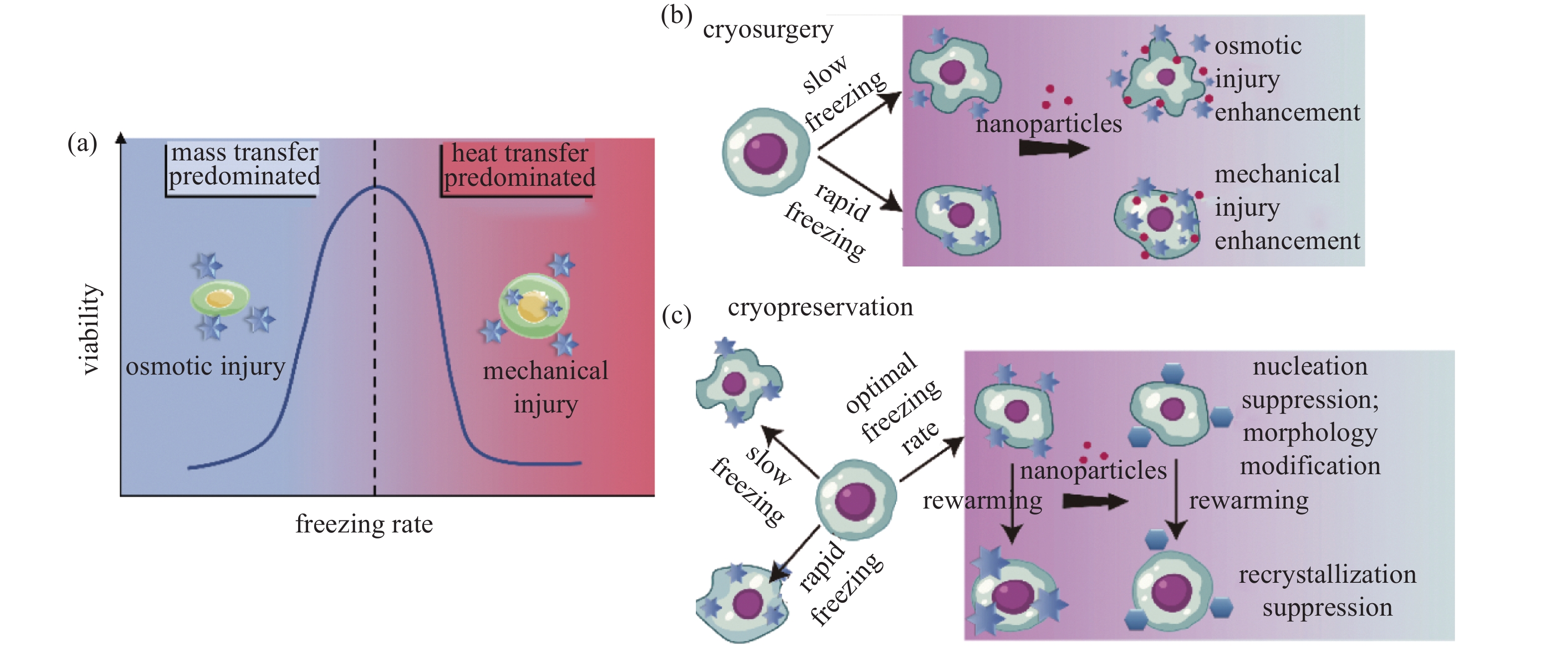
低温治疗是肿瘤物理微创疗法,通过气体节流制冷、相变制冷或半导体制冷等方式实现低温介质在冷冻探针部位的冷量释放,达到杀灭肿瘤组织的目的。与传统的外科手术和放化疗相比,低温治疗具有明显的无毒微创、破坏力强、便于影像追踪的优势[5],并且能够与多种手段(如化疗、电和热疗)联合使用实现治疗过程的优势互补[6]。但是传统的低温治疗存在一定的局限性:首先,低温消融是基于能量作用于生物体的微创介入式手术,但生物组织热导率不高的特性导致温度难以实现在整个病灶内快速均匀分布,结果肿瘤边缘因无法充分消融而引发肿瘤残留或转移,因而低温消融边界往往需要外扩肿瘤边界1 cm;另外,探针持续释放的冷量容易损伤肿瘤周围的健康组织,在加强能量控释、实现适形化治疗方面仍有待进一步突破[7-8]。
低温保存旨在保证活性的同时尽可能延长生物样本的保存时间。当前细胞、小尺度简单组织的低温保存技术满足了高价值生物医学样本保存的基本需求[9]。但对于大尺度组织和器官仍然缺乏成熟的长期低温保存技术。现行临床器官低温保存主要依靠4℃下静态冷保存和低温机械灌注技术[10]。低温可有效抑制生物样本的代谢活性,温度每下降10℃,器官的新陈代谢率就会下降50%~66.7%[11],因此, 4℃的低温能有效减少器官中乳酸等代谢废物的积累,缓解代谢性损伤。但该温度下器官仍有相当的代谢活力,因此器官保存时间局限于以小时为单位的时间尺度而难以突破,无法满足日益紧迫的器官移植需求。而以慢速冷冻和玻璃化技术实现器官的长期保存,面临着无法达到良好的均温和导热以满足快速降温复温要求的难题,同时由于高浓度保护剂带来的毒性、渗透损伤问题困扰,相关技术仍然停留在实验阶段[12],有待于进一步的探索。
客观而言,如何实现物质的精准递送和能量的有效控释,是突破传统低温治疗和低温保存瓶颈的关键。在生物医学领域,纳米颗粒作为实现物质精准靶向释放的有效载体得到了广泛的应用[13]。将纳米材料与低温生物医学有机结合在一起为解决现有挑战带来了新的研究思路:纳米颗粒从分子层面控制冰晶形成来最大化杀伤癌细胞的同时避免了对周围健康组织的损伤,为适形化的肿瘤治疗提供了可能[8]。同时纳米颗粒优异的物质精准递送和强化换热特性,在生物样本低温保护和促进玻璃化冻存快速复温方面展现出了巨大的应用前景[8,14-15]。
-
纳米低温生物医学是功能性纳米材料与低温生物医学相互交叉融合而引申出来的全新研究领域,其基本的思路在于将具备特定功能的纳米材料加载到细胞、生物组织的特定部位,实现强化或削弱冰晶成核、生长及重结晶的功能,突破传统低温生物医学无法精准控冰的研究瓶颈。
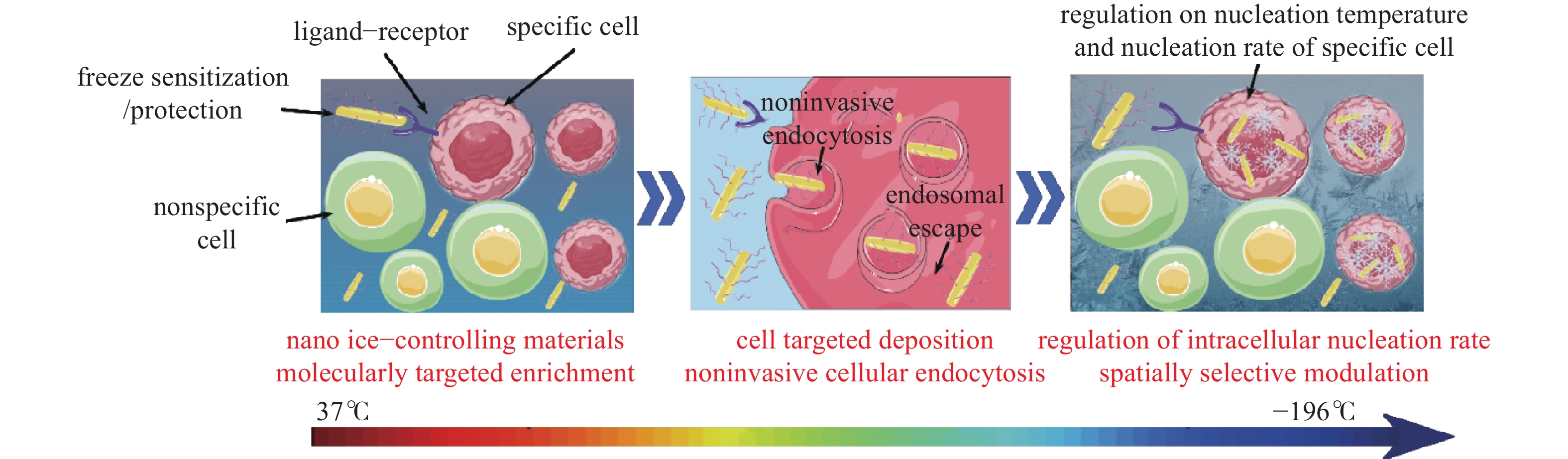
纳米低温生物医学的核心在于纳米尺度的分子靶向控冰,其研究思路是指利用在分子水平上已经明确的细胞结合位点,借助配体-受体相互结合的分子靶向模式来实现控冰材料的精准递送,最终使得特定细胞产生或抑制冰晶成核、生长或重结晶的行为,而不会波及周围非特异性组织细胞。这一技术化低温下控冰材料的输运形式从被动的组织间扩散为主动的细胞定向控制,有效实现了冰晶成核的空间选择性,如图1所示。
-
冰晶的形成及其与细胞的相互作用是低温生物医学的研究基础,由此带来的冰晶和溶液损伤也是需要考虑的关键因素。低温治疗依赖冰晶生长的机械破坏作用来根除肿瘤组织,而低温保存则需要尽可能减小冰晶生成带来的损伤。生物组织的冰晶损伤机制十分复杂且一直是低温生物医学领域的重要研究主题,LoveLock[16]首先提出溶质损伤理论,Mazur[17]在此基础上建立了细胞冷冻损伤模型并成为领域共识,如图2(a)所示。该模型认为快速冷冻与慢速冷冻的杀伤机制不同:快速冷冻时胞内水分无法流出而迅速形成胞内冰晶,诱发机械性损伤;慢速冷冻时,胞外冰大量形成导致细胞脱水产生渗透性损伤。此外,组织器官层次的微脉管损伤理论指出大量冰晶形成导致的毛细血管栓塞和微循环受阻是组织器官失活的重要因素[18,19]。
从细胞冷冻损伤经典模型出发,纳米颗粒能够有效强化低温治疗的传热传质过程,在较低的冷冻速率时诱导大量胞外冰晶形成以增强溶质损伤,而在快速降温时则产生更多胞内冰晶以强化对肿瘤的机械杀伤,有效改善低温治疗预后。而对于需要规避冰晶损伤的冷冻保存过程,纳米颗粒在降温和复温阶段对冰晶产生量及形貌的关键分子调控作用对缓解冷冻损伤具有积极意义(图2(b)-(c))。
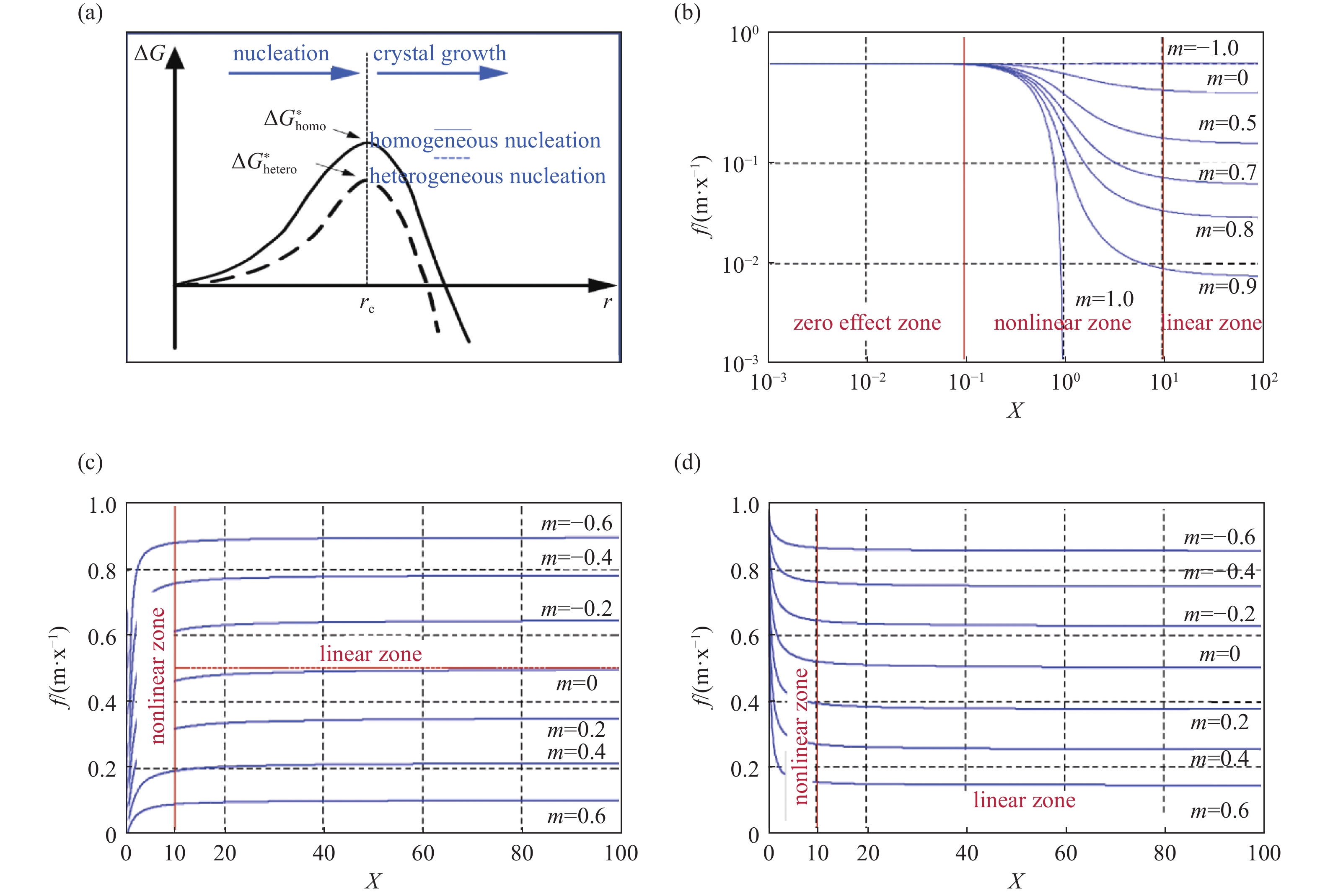
纳米颗粒的引入使得生物环境复杂度增加,因此生物样品的冰晶产生过程必须综合考虑纳米颗粒的影响。通常引入外来颗粒可以降低成核自由能势垒,促进异相成核(图3(a))。为了量化外部颗粒引入导致的自由能势垒下降程度,研究人员定义了界面因子
$ f $ 刻画纳米颗粒在成核过程中的界面效应和尺寸效应[20-22],$ f $ 与颗粒形状、大小和表面特性高度相关,定义如下:式中,
$ m $ 可认为近似等于$ {\rm{cos}}\theta $ ,$ \theta $ 为成核相与基底接触角,$ x=R/r $ ,$ R $ 为外来颗粒半径,$ r $ 为临界成核半径,$ x $ 反映了纳米颗粒的尺寸特性,$ m $ 则为纳米颗粒表面特性参数,即颗粒在液体中的润湿情况。根据定义式,界面因子
$ f $ 为异相成核势垒与同相成核势垒之比,其取值范围在0与1之间。因此在研究外界纳米颗粒引入强化的成核过程时,通过$ f $ 可以更精准的描述外来纳米颗粒引起的相变界面自由能的降低及进而对成核势垒的影响程度。球形、纳米管和实心圆柱体是三种最常见的纳米颗粒类型,如金属纳米颗粒、碳纳米管等。因此从最基本的纳米颗粒形式出发得到的结果具有更广泛的推广意义。三种形状的纳米颗粒对异质成核势垒的影响如式(2)-(8)所示:
球形纳米颗粒:
其中,
纳米管颗粒:
其中,
由于实心圆柱体纳米颗粒变体较多,故只对圆盘形和针状两种极端长径比特例进行描述,其具体形式如下:
圆盘形圆柱体纳米颗粒:
针状圆柱体纳米颗粒:
其中,
纳米颗粒对成核的影响随纳米颗粒的形状、尺寸而被划分为了线性效应区和非线性效应区(图3(b)-(d))。添加尺寸位于非线性效应区的纳米颗粒可以迅速引起成核势垒的改变,而尺寸在线性效应区的纳米颗粒其成核促进作用并不显著。
对于球形纳米颗粒(图3(b)),
$ f $ 随$ x $ 增大而逐渐减小,即随着颗粒尺寸的增加,其对成核势垒的削弱作用在逐渐减弱。实心圆柱体纳米颗粒(图3(d))也表现出了类似的趋势。而纳米管颗粒则表现为$ f $ 随$ x $ 增大而逐渐增大,即随着纳米管颗粒尺寸增加,其对成核势垒的削弱作用会进一步增强。值得注意的是,球形纳米颗粒还存在一个对成核完全没有影响的零效应区,当以促进冰晶成核为应用目的时应避开该尺寸区间。综上所述,纳米颗粒对成核的影响是以下三个因素共同作用下的结果[21]:(1) 纳米颗粒的几何形状; (2) 纳米颗粒在液体环境中的润湿性;(3) 在分子层面,纳米颗粒基底表面与晶胚间的晶格匹配度。上述内容揭示了颗粒大小及表面浸润性对成核势垒的影响规律,建立了纳米冷冻过程中的成核理论框架,为借助纳米颗粒调控生物液体环境冰晶相变行为提供了坚实的理论指导。
在通常意义上,纳米颗粒作为异相成核位点能极大降低液体的成核势垒,纳米低温治疗正是基于这一基本规律在降低成核难度的同时加快成核速率,促进冰晶的生成进而强化冰晶的机械杀伤作用。
自然界中水的结冰通常是由异质成核介导的相变行为,但针对极小尺寸的球形纳米颗粒,其对成核的影响存在明显的“零效应区”,相较于大部分纳米颗粒促进冰晶成核的作用,部分小尺寸纳米颗粒作为抗冻蛋白类似物则表现出显著的抑制冰晶成核特性,其抑冰机理在于纳米颗粒与冰晶表面的结合的形貌修饰作用改变了冰晶边缘曲率,在表面张力作用下,系统的平衡状态改变[23],产生冰晶凝点下降的热滞后效应从而抑制冰晶的快速形成和随之而来的冰晶损伤。热滞后效应可由下式描述:
式中,
${\rm{d}}S/{\rm{d}}V$ 为冰晶面积相对其体积的一阶偏导,$ {T}_{m} $ 为溶液正常冻结温度,$ {\gamma }_{lc} $ 为固液相间的界面张力,$ {\nu }_{c} $ 为晶体相分子体积,$ {\mathrm{\Delta }H}_{m} $ 为冰晶融化的相变潜热。纳米颗粒不仅可以调控降温过程的冰晶成核与生长,对冷冻后的升温过程也能起到关键的调节作用。低温治疗时冷冻过程的降温速率及达到的最低温度、最低温度下的维持时间、冷热循环次数及复温速率是决定低温手术杀伤程度的重要因素[24]。纳米颗粒改变了组织的热物性参数,强化了升温过程并在组织内产生剧烈的热应力以加剧对肿瘤的杀伤作用[25,26]。对冷冻保存而言,生物样本复温过程的重结晶问题是影响保存对象存活率的重点,重结晶是一个经典的热力学过程,即在界面能的驱动下较小的冰晶自发合并成更大冰晶以降低系统总自由能,纳米颗粒借助吸附抑制效应,通过冰晶结合面吸附到冰晶表面而外侧非冰晶结合面存在的带电荷侧链及疏水性侧链能够避免游离水分子的结合,最终抑制冰晶生长和重结晶现象的发生[27],改善冷冻保存效果。
近年来,围绕着冰晶调控问题,许多纳米材料的控冰效果在实验层面得到验证。冰晶的生长本质上是耦合了能量场与物质场及其与生物对象间作用的复杂热力学问题,从传热学的角度,广为接受的细胞冷冻损伤模型可以归结为降温过程中的传热传质问题。冰晶的机械损伤是传热过程强于传质过程的结果,渗透性损伤则是传质过程为主而传热过程为辅(见图2)。值得注意的是纳米技术作为一种优异的干预手段,在平衡传热传质过程,发挥颗粒调控作用以实现能质协同进而优化低温治疗、低温保存方面展现出了极大的优势和广阔的应用前景。
-
低温生物医学的研究与应用对象是多尺度、多层级,涵盖细胞、组织、器官的复杂生物结构,其研究重点在于低温作用下生物对象的传热传质过程。由于水是生命体的重要组成成分,因此低温所涉及的降温结晶与复温融化过程,在根本上落脚于水在外界调控下的固液相转变及其与细胞间的相互作用。在精准医学的时代背景下,发展面向复杂生物对象高时空精确度的冰晶调控手段至关重要,然而由于生物对象通常是热的不良导体,因此无论是低温治疗或是低温保存,常规手段极难实现精准化、适形化的受控冰晶调节,成为开展精准化低温生物医学的基本难题与关键挑战。基于纳米技术作用于微观世界并进而影响宏观尺度基本作用的特性,研究人员藉此实现了对生物对象能量场与物质场的定向控制与精准调节,并提出了一系列面向低温医学的能质调控纳米技术。
-
本课题组首次提出纳米冷冻手术的概念,将纳米材料与低温工程学相互结合并探索了纳米颗粒对低温手术的影响机制。但对于空间结构复杂、异质异构同时与人体血管系统及脏器相互交联的靶病灶,冷冻治疗过程中组织冻融和血液冻结与重新流动产生的能量再分配,以及纳米材料引入产生的全新基础传热特性变化都使得低温治疗的传热传质复杂度显著增加。因此为实现冷冻治疗能量输运适形化与适量化的治疗目标,研究人员面临的主要问题有:(1) 如何促进靶细胞胞内冰晶成核进而实现肿瘤组织内高空间均匀度结晶,强化冰晶机械杀伤;(2) 如何发展精准低温生物医学,实现对靶病灶特异性杀伤的同时而不影响健康组织的适形化治疗,达到在体能量在时空上的精准控制;(3) 如何强化低热导率生物组织传热,达到足够的杀伤能量强度阈值;(4) 如何发挥低温与其他手段(如化疗)的协同治疗优势。针对冷冻治疗过程中的一系列关键环节,研究人员立足于纳米颗粒本征特性逐步发展出了纳米冰晶成核剂、纳米冷冻增敏剂、组织纳米均温剂与冷冻介导的药物靶向控释剂实现对靶病灶冷冻杀伤的能质调控。
-
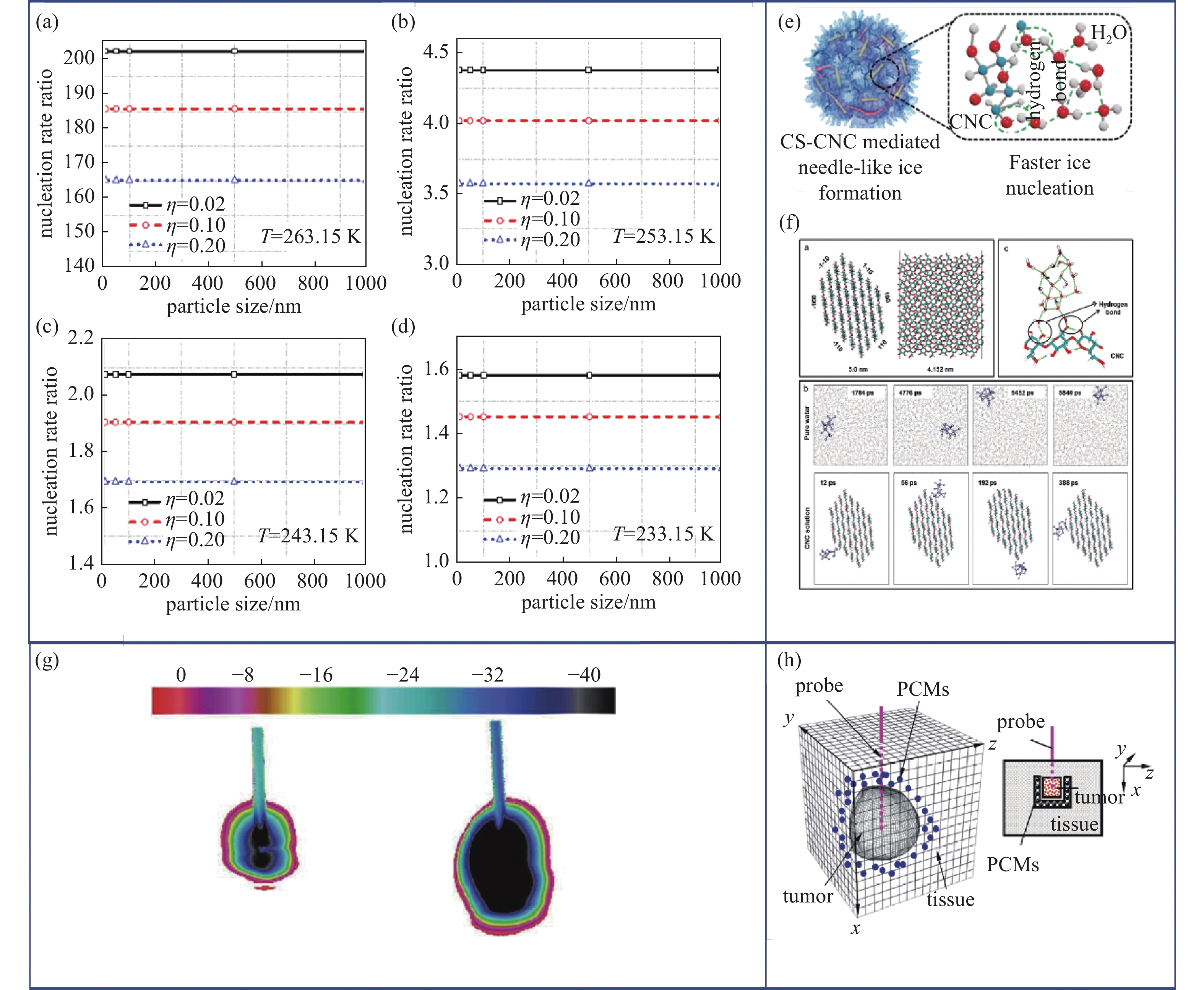
低温治疗的关键在于强化冰晶对不良组织的机械损伤。而冰晶的产生与成核自由能势垒密切相关,外部引入的纳米冷冻成核剂可以显著改变胞内成核概率,降低成核势垒和成核难度继而诱发异质成核。Yan对比了冷冻探针在明胶溶液内产生的冰球体积发现,同等冷冻条件下,添加碳纳米管后冰球体积增加了40%,定量展示了纳米颗粒对成核的促进作用。随后Yan建立了肿瘤细胞的成核速率模型探究了不同降温阶段、不同浓度和不同半径的纳米颗粒对胞内成核的影响(如图4(a)-(d)),结果显示纳米颗粒能够显著提高冷冻初期细胞内异相成核速率从而实现在更高的温度阈值下杀伤肿瘤细胞[25]。Di同样证明了添加纳米颗粒能够促进冰球的生长且冰球体积与纳米颗粒浓度呈正相关[28]。
传统的冰成核剂多为无机物或生物提取物[29-31]。然而考虑到生物相容性、制备难度和低温生物医学领域对更加精准、特异性冰成核剂的需求,Hou等[32]构建了壳聚糖修饰的纳米纤维素晶(Chitosan Decorated Cellulose Nanocrystals, CS-CNC)作为分子靶向成核剂调控胞内冰晶生长,胞内成核温度相较对照组PBS(磷酸盐平衡生理盐水)溶液提高了5℃,成核率提高了约20%,实现了对肿瘤细胞分子尺度的特异性冰晶调控和杀伤。分子动力学模拟揭示纳米纤维素晶表面(-110)是最显著加速冰晶成核的表面,其上分布的羟基有效促进了冰晶四面体氢键网络的形成(图4(e)-(f))。在此基础上的细胞实验与动物实验表明纳米纤维素晶会诱导形成锋利冰晶,同时延长冰晶在细胞内滞留时间以强化冰晶细胞损伤,表现出了优异的低温癌症治疗效能。
-
着力于提高治疗精度,实现适形化治疗以减小对外周健康组织的损伤是改善低温治疗预后的关键步骤。适形治疗概念首先针对肿瘤的放射治疗提出[33-35],其目标在于尽可能将放射剂量集中在肿瘤靶区,减小对周围正常组织器官的放射损伤。低温治疗与放射治疗同属局部治疗,因此精准化、适形化同样是低温治疗要重点关注的问题。传统的低温治疗主要依靠增加探针数量尽可能覆盖靶区[36],多探针的应用扩大了杀伤范围,且可以通过术中调节探针位置来尽可能实现对不规则肿瘤的完整杀伤。但多探针导致的严重穿刺损伤及更严重的冷量泄露对周围组织的低温保护提出了新的挑战。有研究表明直肠手术中使用过多探针会使得冰冻面积过大而导致直肠瘘甚至直肠壁的完全坏死[37]。Yan[25]在离体组织实验中发现,纳米颗粒的引入使得冰球出现了非对称性的生长,因而可以通过在目标组织局部添加纳米颗粒来实现控制冰球形状,缩减肿瘤治疗死区。Di[38]同样发现,纳米粒子对冰晶的生长方向有明显的诱导性,配合不同纳米颗粒浓度调节冰球体积可以发展出更加适形化的手术方法(图4(g))。
针对低温治疗过程中冷量对周围健康组织的损伤问题,Lv等[39-40]通过向肿瘤周围组织引入具有高潜热、高比热、低导热特性的可相变纳米颗粒(Phase Change Materials, PCMs)实现对外周组织的冷冻保护(图4(h)),将探针冷量局限在肿瘤区域以减少冷量外泄,达到适形化杀伤。
-
冷冻终温及损伤区域温度场分布是决定低温杀伤的关键物理参数,由于生物组织的低热导率特性,肿瘤边缘区域常因冷量不足而导致组织残留与复发。同时,解剖学已经证明实体肿瘤周围通常形成了复杂的血管组织,而持续的血液循环不利于温度快速下降,严重阻碍了低温治疗的手术效果[41-42]。因此强化冷冻治疗的传热过程,实现针对病灶的高效能量输运以达到快速响应、空间均匀的低温温度场分布是亟待解决的问题。
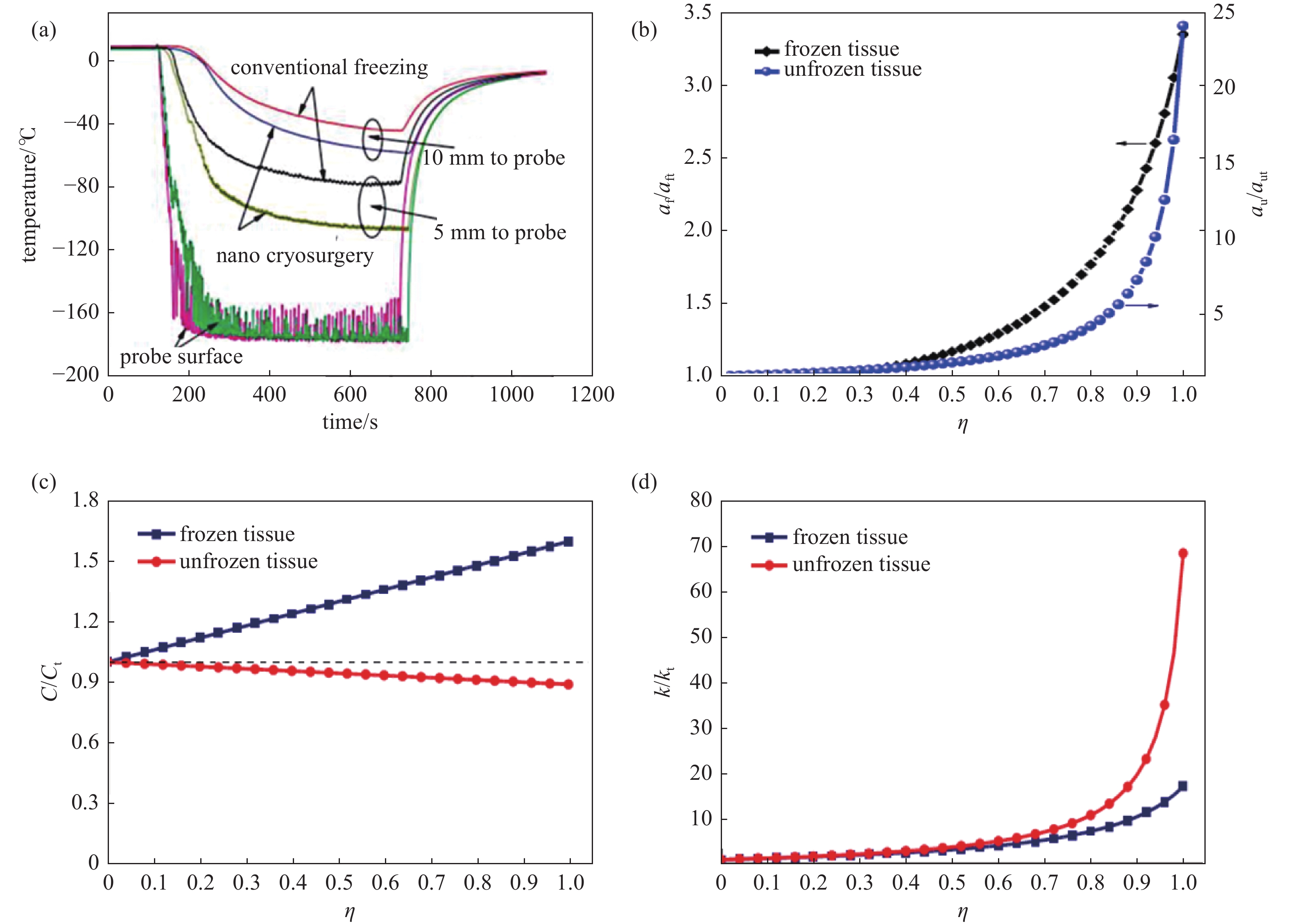
Yu等[7]比较了是否存在铝纳米颗粒时的猪肉组织温度响应曲线(图5(a)),纳米颗粒组最低杀伤温度相较对照组降低了40℃(从−75℃降至−115℃)。同时已有动物实验表明,纳米颗粒可以减弱甚至消除血管对低温治疗的影响[43-45]。纳米颗粒改变了组织的热物性是其强化低温治疗传热过程的根本原因。Di利用纳米流体导热经典理论Hamilton-Crosser(H-C)模型对注入MgO的组织进行热物性分析发现,纳米颗粒最高可使冻结组织热导率提高17.15倍,非冻结组织热导率提高68.6倍,由于比热容未发生较大变化,在热导率主导下热扩散率也得到了显著提升。这表明纳米颗粒能够显著改变组织的导热和热扩散能力,实现肿瘤组织内的快速均温[38],相关结果见图5(b)-(d)。
-
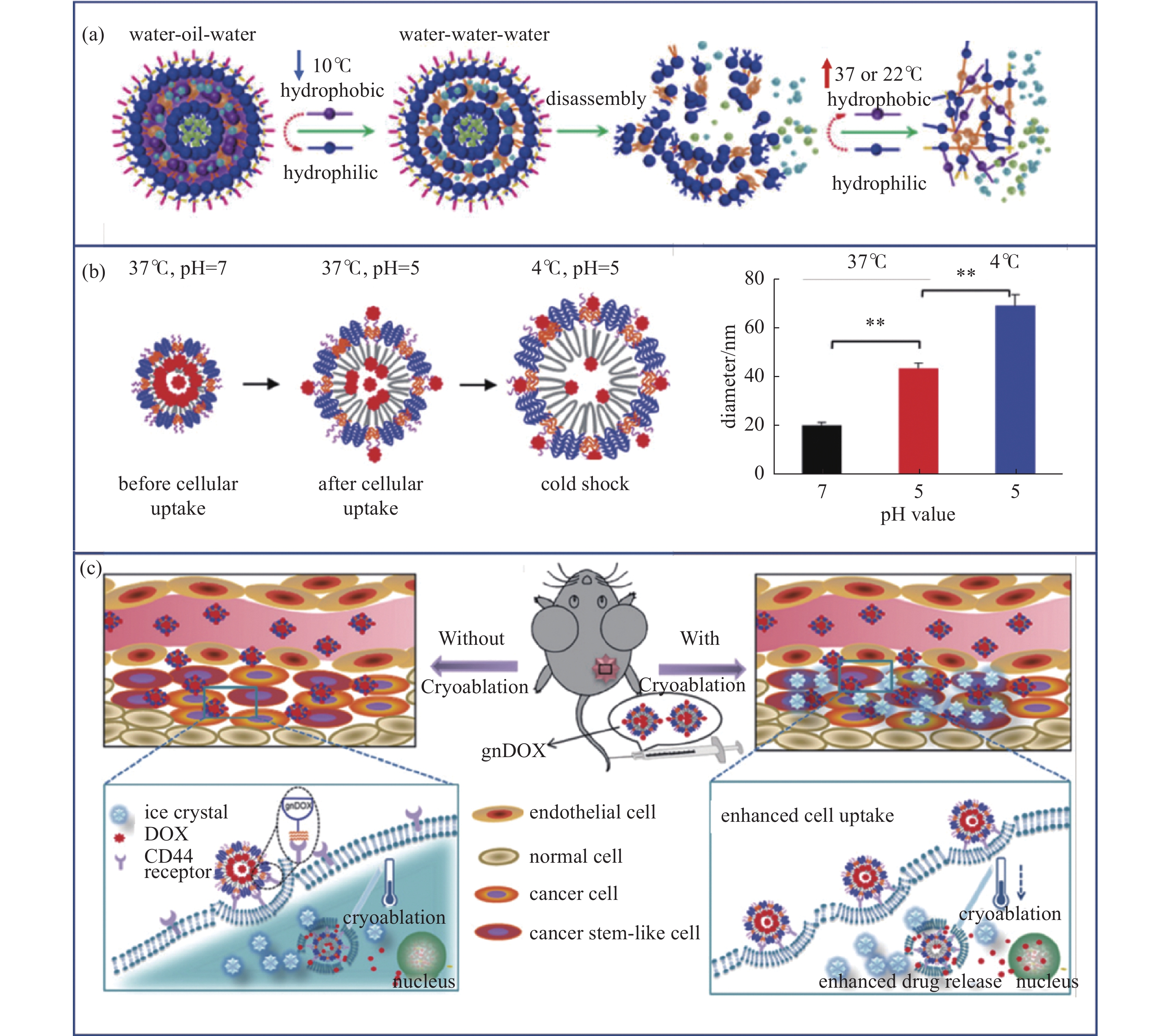
低温治疗尽管可以通过产生冰晶直接杀伤目标组织,但肿瘤消融不完全以及肿瘤干细胞留存等问题仍可能导致癌症复发。低温与其他疗法的协同作用是针对单一消融杀伤不完全的有效强化手段[6],如低温手术与化疗的联合治疗能明显提高病变组织尤其是肿瘤干细胞清除率[47]。Wang等[48]合成了在低温刺激下不可逆裂解的纳米材料强化肿瘤治疗(图6(a))。Hou等[49]构建了对低温和pH具有双重响应的纳米颗粒药物载体,该纳米载体在酸性肿瘤环境中受低温刺激时会通过负膨胀效应实现药物的快速释放(图6(b))。低温条件下,相较于单纯阿霉素化疗主要通过低温诱导的细胞膜高渗实现药物递送,纳米载体可以通过细胞内吞实现更加高效的跨膜运输和更高浓度的抗肿瘤药物富集,达到药物在肿瘤细胞内的高剂量水平、高空间均匀度的分布。此外冷冻消融过程中冰晶对生物膜固有的机械破坏进一步促进了药物在肿瘤组织内的渗透,实现低温介导的药物主动扩散,强化对肿瘤组织的摧毁作用。其协同作用如图6(c)所示。
-
高灵敏度和高分辨率的术中监测手段对实现精准低温生物医学意义重大。具备特定成像功能的纳米粒子不仅利于实现手术过程中对冰球与肿瘤边界的精确划分与实时监测,也摒弃了单纯依靠医师经验进行手术操作的方法,在有效强化肿瘤杀伤的同时有力推动了适形化治疗的发展。
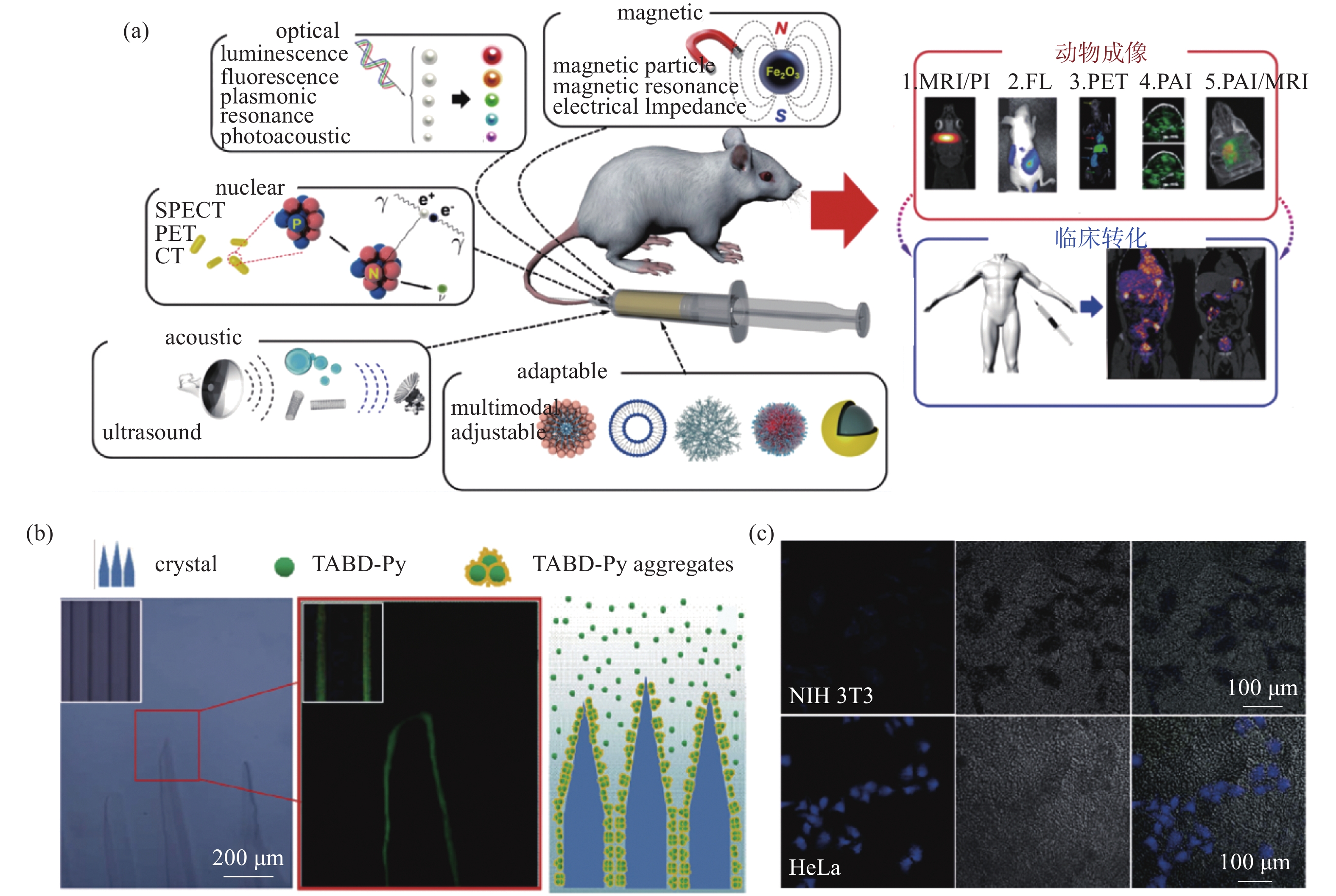
特定外场激励下特异成像功能的纳米粒子能够实现对低温治疗过程可视化和对手术对象的特征描述。最理想的情况下,纳米颗粒兼有强化低温治疗和成像的双重功能,在实现对靶病灶杀伤的同时能以成像的方式及时对手术过程及术后情况进行评估和反馈。如磁性氧化铁纳米颗粒能够强化冷冻的传热过程,磁场作用下直径在20-30 nm的氧化铁纳米颗粒同样能够显著提高磁共振成像(Magnetic Resonance Imaging, MRI)的成像分辨率[50]。光学成像作为最直观的成像方式,能够提供快速、高通量的在体实时监测,然而光学成像的主要限制在于穿透深度十分有限,尤其将其应用到较大的生物体时该缺陷尤为明显,但近年来快速发展的光学相干断层扫描(Optical Coherence Tomography, OCT)以及光声成像法能够在纳米材料的对比下显著改善在体成像质量,多种成像方式如图7(a)所示。荧光成像作为一种简单高效的非侵入式成像方式在低温手术引导方面展现出了良好的应用前景,He等[51]基于聚集诱导发光现象合成的水溶性荧光物质TABY-Py在水溶液结冰时会聚集在冰水界面,从而产生结晶引发的聚集诱导发光现象,进一步细胞水平研究还证明生物相容性良好的TABY-Py能够实现在癌细胞内的特异性富集,这对实际低温手术过程中的癌组织与健康组织的影像分割和手术引导具有潜在的应用价值。除此以外,基于放射的成像方式可以利用放射性同位素标记物或能够削弱高能辐射的纳米材料来提高影像的对比度,其显著优势在于不受生物对象厚度的限制并对几乎所有组织都具有良好的成像功能[52],这对通过冷冻探针治疗机体内部较深处的肿瘤具有明显的应用优势(图7(b)-(c))。
-
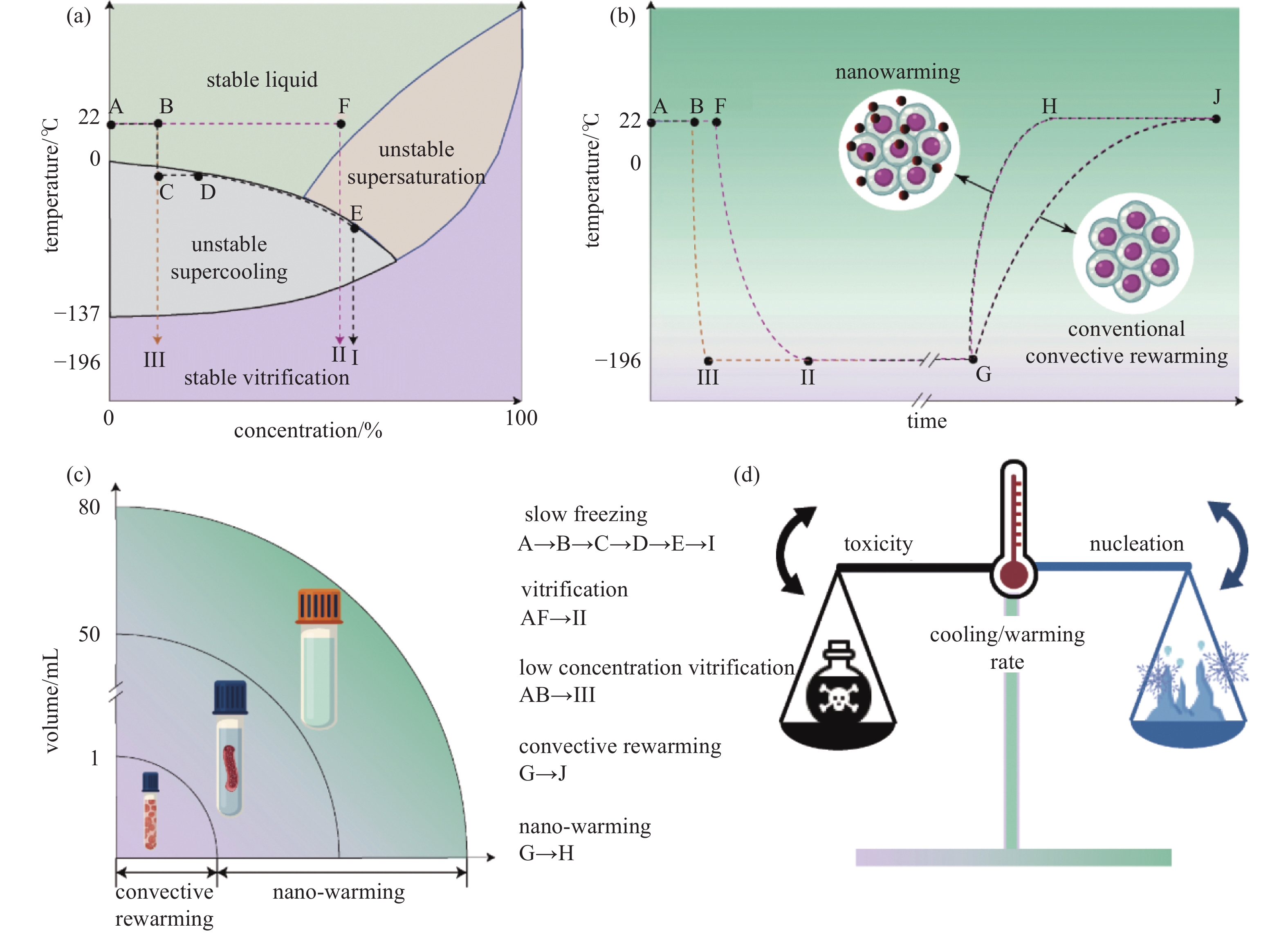
低温通过抑制生物样本的新陈代谢尽可能延长其保存时间,低温保存是生物样本能量与物质高度耦合的复杂物理过程,不管是慢速冷冻或是玻璃化保存(图8(a)),其根本均在于调控细胞内外水分输运和温度扩散过程以实现长期保存。低温保存的主要难题来自于冰晶的产生及其诱发的一系列物理化学损伤,因此高质量的低温保存是权衡升降温速率、保护剂毒性和冰晶损伤的结果(图8(d))。当前主流的保存方法慢速冷冻和玻璃化保存对同质同构的细胞、小尺度组织表现出了良好的保存效能,Manuchehrabadi等[53]最高实现了对50 mL生物样本以及80 mL生理性溶液的磁热复温,展示了外场作用下纳米颗粒对于高效玻璃化复温的积极作用(图8(b)-(c))。然而针对异质异构且空间结构复杂的器官却长期缺乏有效的保存方法,加剧了临床组织器官移植供需不平衡的医疗问题。因此:(1) 如何实现冷冻保护剂的高效、无损递送和胞内富集以最大化发挥其保护效能;(2) 如何对二维乃至三维体相冰晶形貌进行空间选择性调节,避免尖锐冰针造成严重的细胞和组织损伤;(3) 如何强化玻璃化保存的能量输运以实现更大尺度生物样本的快速复温,这些关键问题仍需进一步探索。基于此,纳米冷冻保护剂、纳米冷冻抑冰剂、纳米冷冻复温剂等调节能质传输过程、助力低温保存效果的纳米颗粒被开发出来并得到了广泛应用。
-
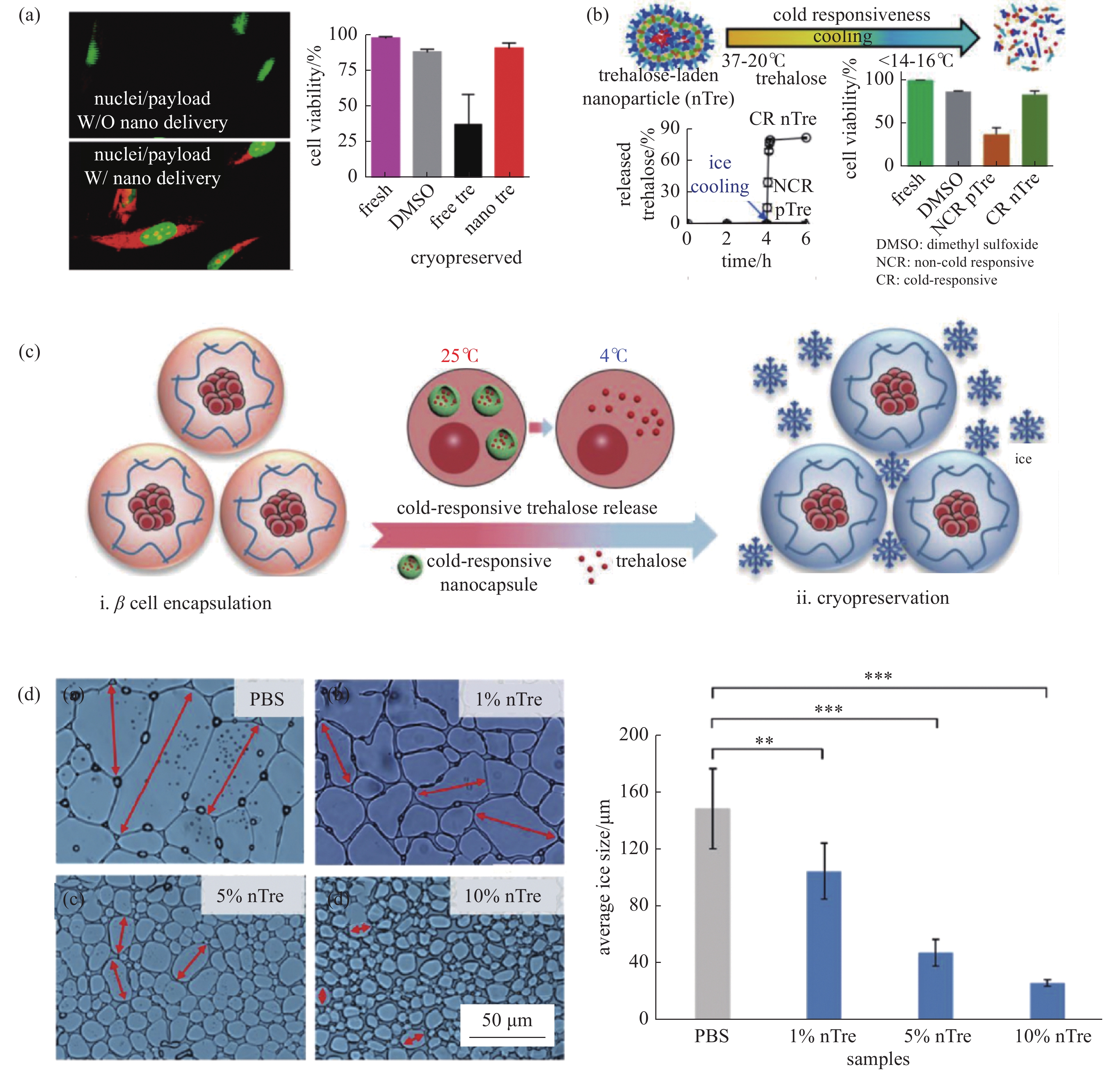
冷冻保护剂的加载是当前样本保存领域不可或缺的环节,而冷冻保护剂在细胞内的空间分布对生物样本的存活率至关重要。根据细胞对保护剂的渗透性,当前主流的保护剂分为渗透性保护剂和非渗透性保护剂。1949年,甘油首先作为一种渗透性保护剂被应用于低温保存领域[55],1959年,Lovelock[56]发现并引入了冷冻保护剂二甲基亚枫(Dimethyl sulfoxide, DMSO),目前DMSO仍然是应用最广泛的渗透性低温保护剂之一。但由于传统低温保护剂复杂的加载与洗脱以及更严重的毒性问题,生物相容性好、安全性高的低温保护剂如海藻糖受到了低温保存领域研究者的关注,但哺乳动物细胞不能自主合成海藻糖,且海藻糖属于非渗透性保护剂[57]。传统的有创加载手段如显微注射[58]、超声[59]、电穿孔[60]等均会对细胞造成严重的机械损伤,因此,迫切的高质量样本保存需求对无创、高效的非渗透性低温保护剂递送体系提出了要求。
纳米材料作为一种小分子靶向载体在肿瘤治疗中已经得到了广泛的应用[49],而作为一种性能优异的物质载体,纳米颗粒在冷冻保存的物质输运过程中同样发挥了关键的调控作用。Rao等[15]合成的基于pH响应的纳米载体被胞吞后可在次级内体和溶酶体的酸性环境中实现内载海藻糖的高效释放,结果显示仅依靠海藻糖就针对间充质干细胞实现了不逊于DMSO的低温保护效果,除了海藻糖优异的低温保护性能,纳米载体对非渗透性保护剂安全高效的加载的作用不可忽视,部分结果见图9(a)。赵刚课题组[61-62]制备了温度敏感的纳米颗粒,在较低温度时能够快速释放海藻糖,配合微流体封装技术实现了良好的胰岛细胞保存 (图9(b)-(c))。
纳米材料作为载体强化了冷冻保存的传热过程,但纳米海藻糖-细胞体系的热力学特性却鲜有研究。Yao[63]研究了纳米海藻糖应用于人诱导多能干细胞冷冻保存过程中的水分输运与结晶特性,揭示了纳米海藻糖传热传质作用机制。纳米海藻糖能够防止细胞快速失水带来的渗透性损伤,因而大大降低脱水过程中细胞内冰晶成核概率,缓解了冷冻保存带来的冰晶损伤。复温过程中纳米海藻糖可以防止大量细小冰核合并为大尺度冰晶而损伤细胞结构,并且重结晶抑制性能随着海藻糖浓度上升而增强(图9(d))。
无创性是纳米递送相对传统手段的显著优势。纳米递送技术的应用,不仅拓宽了非渗透性保护剂的物质传输过程,同时也推动了生物安全、非有机溶剂式低温保护策略的快速发展。
-
冰晶的形成是极为普遍的自然现象,许多生物也面临低温以及体内冰晶生成带来的挑战,因此,木蛙、耐寒昆虫、极地鱼类等物种都进化出了适应寒冷环境的防冻、抗冻策略,如极地鱼类通过产生抗冻蛋白来对抗不利环境,研究表明抗冻蛋白的热滞现象能够抑制冰晶的产生,此外抗冻蛋白还具有与冰晶结合以修饰冰晶形貌、抑制重结晶的功能[64]。但是抗冻蛋白一直存在提取困难、价格高等难题,人工合成抗冻蛋白也因热稳定性较差而难以推广应用[65]。近来相当多研究发现,一些纳米材料具有与抗冻蛋白类似的冰晶调控功能,因此纳米颗粒作为一种抑冰剂在低温保存领域有了新的应用场景。
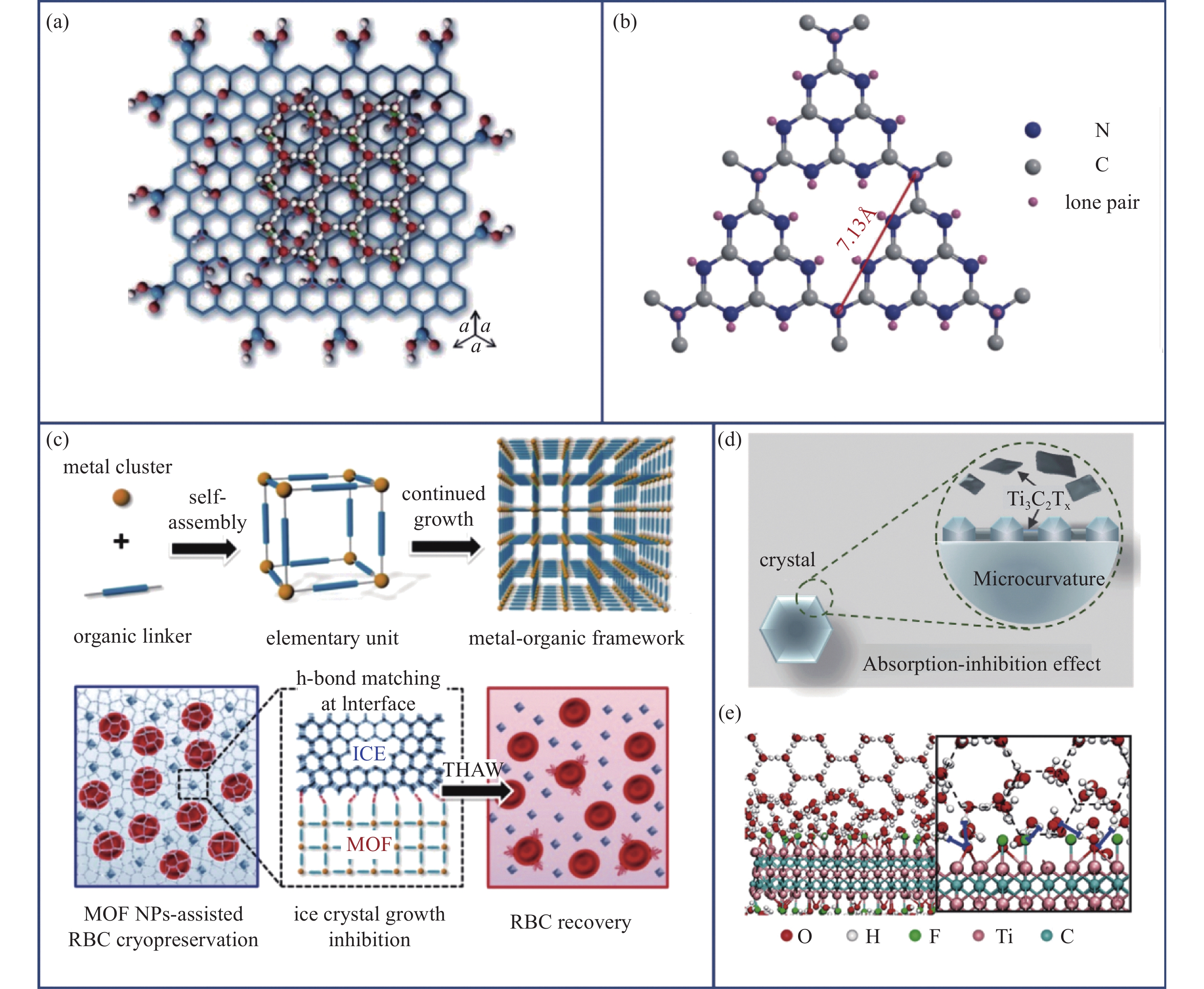
Geng[66]发现氧化石墨烯(Graphene Oxide, GO)展现出了极佳的抑制冰晶生成与重结晶作用,其分子结构如图10(a)所示。GO在水溶液中的分散促进了冰晶由圆盘形向六边形的形貌转变,起到了类似抗冻蛋白抑制冰晶生长的作用。分子动力学模拟阐明GO基面上的羟基与冰晶之间形成的氢键是阻止冰晶进一步长大的关键因素。氧化准氮化碳量子点(Oxidized Quasi-Carbon Nitride Quantum Dots, OQCNs)由于与冰晶优异的晶格匹配结合同样表现出类似的冰晶调控能力,与GO类似,OQCNs(图10(b))能够将圆盘形冰晶修饰为六边形冰晶,根据开尔文效应,此时冰晶生长将处于不利的热力学条件下,其进一步长大受到抑制[65]。
冰晶的生长有赖于以氢键为纽带的水分子之间的相互联结,与冰晶之间通过氢键结合也是众多纳米材料实现冰晶调控的基本策略,因此通过特异性的材料表面化学性质设计促进纳米材料与冰晶间的氢键形成是实现控冰的巧妙手段。Zhu等[67]设计了一类具有特定表面化学性质的锆基金属有机骨架(Metal Organic Framework, MOF)纳米颗粒(图10(c)),该骨架外表面周期性排列的有机连接体作为氢键供体基团能够实现与冰晶的精准识别与匹配,进一步实验还发现不同于二维材料可以紧密吸附到冰晶平面,三维MOF由于结合强度较弱而极易从冰晶平面脱落,由于MOF与冰水界面水分子的相互作用,脱落的MOF会携带部分水分子脱离,对冰水界面的水分子交换起到催化作用而促进冰晶融化,大大提高了对人红细胞的保存效果。最近,Cao等[68]应用二维碳化钛(Ti3C2TX) MXene纳米片将干细胞存活率由38.4%提升到了80.9%,分子模拟证明其优异的抑冰性能来自于表面丰富的可与冰晶形成氢键的官能团,包括醚键、羟基和氟基 (图10(d)-(e)),有效减小了成核过冷度以避免爆发性结晶。值得一提的是,Ti3C2TX还是一种良好的抑菌剂,对避免细胞污染和提高保存效果具有积极意义。
-
研究已经证明外部物理场(如声、光、电、磁场)对于冰晶具有一定的调控作用[69-72]。然而针对大尺度异质异构的生物样品,仅通过施加外场无法取得良好的样本保存效果。Pegg[69]使用2450 MHz商用微波炉对狗的肾脏进行复温再移植,所有移植肾脏完全失能,电子显微镜结果显示肾脏的超微结构受到了严重损伤。而外场与纳米颗粒的联合应用,为解决玻璃化均温和复温问题提供了全新的思路。纳米粒子介导的外场能量高效转化和吸收强化了复温传热过程的能量精准递送,极大的推进了生物样本由小尺度细胞到大尺度器官保存研究工作的开展。
-
磁性氧化铁纳米颗粒是当前借助外界磁场激励实现磁能与热能转换的常用复温介质,能够实现对保存样本内源性的快速、均匀传热。2014年,Etheridge等[73]首先对射频场驱动下的纳米复温技术进行了概念验证,随后又通过理论模型证明了纳米复温相对于传统对流换热的显著优势,至此磁热复温作为一种高效复温手段被引入冷冻保存领域,促进了玻璃化保存在细胞、组织和器官层面研究的发展。
Wang等[74]合成了超顺磁Fe3O4纳米颗粒实现了人脐带基质间充质干细胞的高效玻璃化保存。在交流电磁场作用下(15 A, 375 kHz),0.05%(w/v)的磁性纳米颗粒可以明显抑制反玻璃化现象而提高细胞活力(71.7%)。已有研究表明,只有达到临界降温速率(Critial Cooling Rate, CCR)才可以实现玻璃化状态,同样,复温过程中只有达到临界升温速率(Critial Warming Rate, CWR)才可能避免复温过程中的反玻璃化现象[73]。尽管提高保护剂的浓度来降低CWR是减小复温难度的可行措施,但保护剂的毒性以及因浓度升高而诱发的渗透性损伤成为影响细胞存活率的关键因素,因此低保护剂浓度的玻璃化保存是未来的重点发展方向。赵刚团队[75-77]利用海藻酸盐水凝胶结构将细胞封装在微胶囊内,同时构建Fe3O4纳米颗粒分散体系实现磁热复温,对反玻璃化和重结晶表现出了双重抑制效应,有效改善了细胞保存质量并且规避了高浓度保护剂带来的损伤。
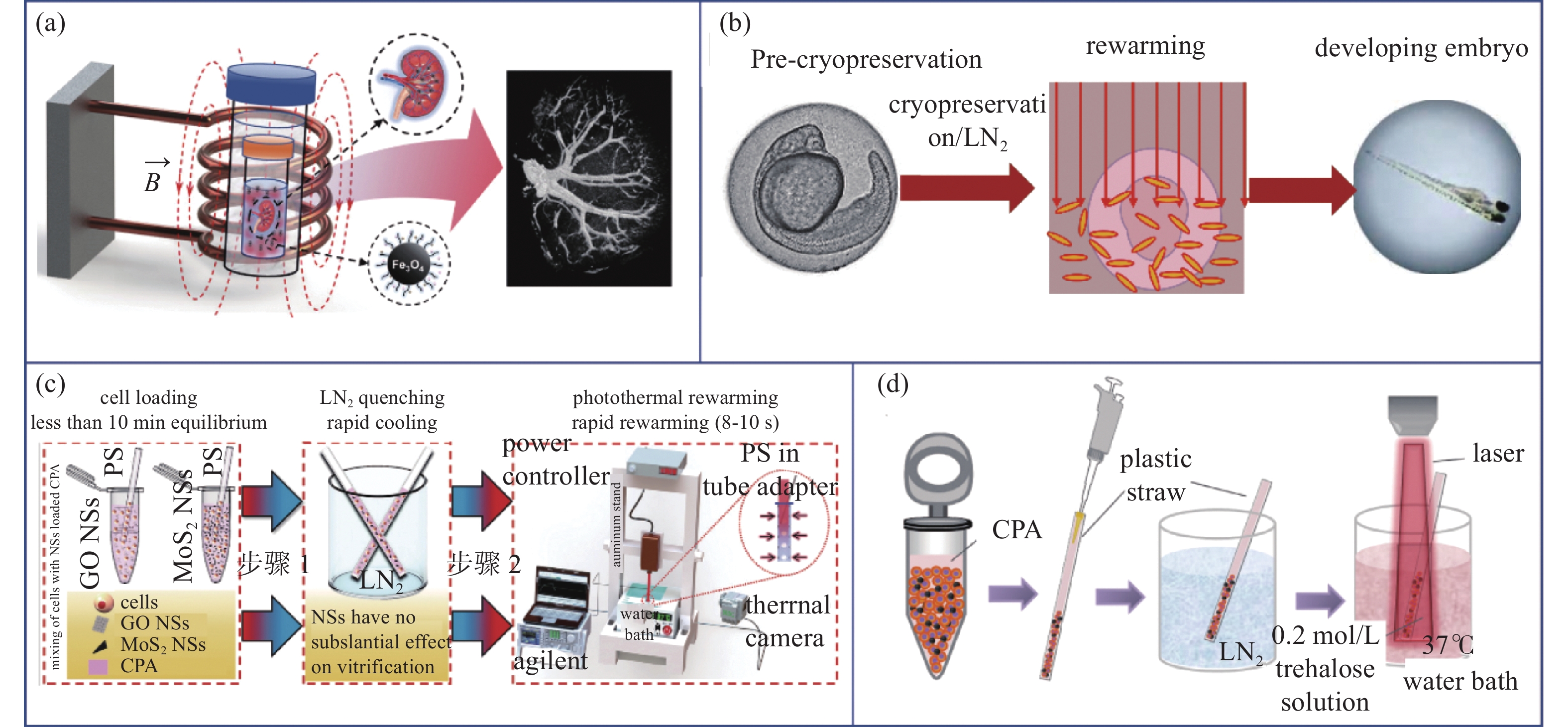
受玻璃化保存的传热限制,传统的玻璃化保存通常针对小尺度、微量(<3 mL)的生物对象,复温时通过水浴对流换热的方式回收样本[78-79],但对于大体积的组织、器官,水浴复温无法满足快速且均匀的复温要求,磁热复温技术的引入改变了这一现状, Manuchehrabadi等[53]借助VS55加载介孔二氧化硅涂层氧化铁纳米颗粒成功实现了1−80 mL保护剂溶液系统以及最大可达50 mL的生物样本的磁热复温,这表明磁热复温针对更大尺度生物样本的快速均匀复温具有推广意义。在器官层面上,Gao等[76]实现了针对器官保存能够形成稳定胶体状态的二氧化硅涂层氧化铁纳米颗粒的大批量制备,同时该纳米颗粒能够有效的通过脉管系统分散在肾脏内且洗脱率可达90%,在此基础上小鼠肾脏的玻璃化保存结果证明,纳米磁热复温能够实现形态完整、细胞活力良好的肾脏保存[79],Zhan[80]进一步证实纳米粒子磁热复温同样能够保持细胞超微结构和血管网络的完整性,如图11(a)所示。
-
具有光热转换效应的纳米材料在吸收外界光(通常为近红外光)辐射能量后,能够将光能转化为热能,近来已经在药物递送[81]、癌症治疗[82]方面展现出了巨大的应用优势。由于具备光热效应的纳米粒子可借助纳米粒子分布场调控生物对象温度场的能力,因而也被引入低温保存领域作为一种实现玻璃化保存快速复温、抑制反玻璃化与重结晶的手段。纳米光热复温设备价格低廉、操作简单且温度可调易控,适用于细胞以及小尺度组织的快速复温[83]。
金纳米棒(Gold Nanorods, GNRs)由于其独特的光学活性、易于制备修饰且生物相容性良好,在玻璃化快速复温方面获得了应用,Khosla等[84]将GNRs与低温保护剂直接注入斑马鱼胚胎内实现了成功的玻璃化保存,见图11(b)。根据模型预测,在1064 nm的脉冲激光激发下,GNRs的复温速率可达1.4×107℃/min,能有效实现对胚胎均匀、快速的复温。
二维氧化石墨烯和二硫化钼纳米片作为一种光热剂已经应用于抗癌载药[85-86],其优良的空间热效应同样被视为一种能够快速均温的加热方式。Khosla利用金纳米棒实现了对斑马鱼胚胎的快速复温[84],但金纳米棒胞内注射的加载方式限制了其对更小尺寸细胞的推广应用,鉴于此,Panhwar[87]利用石墨烯和二硫化钼纳米片实现了对人脐静脉内皮细胞的光热复温,其优势在于该纳米片可以通过内吞作用实现对生物样本的无损加载。其他二维材料如二维碳化钛本身除具备良好的冰晶调控性能,在受近红外光激发产生的局域表面等离子体共振效应作用下同样能够产生良好的光热转换效果,赋予了二维碳化钛在冷冻复温方面的应用潜力,在此基础上,Cao等利用二维碳化钛在冰晶调控、光热复温中的双重作用实现了对干细胞的高效保存[68],操作过程如图11(c)所示。
传统的纳米磁热、光热复温材料均为固态,如Fe3O4、GNRs。但是固态纳米颗粒同样存在促进冰晶成核的风险,Fe3O4纳米颗粒即具有促进肿瘤细胞内结冰的能力[88],这对避免复温过程中反玻璃化与重结晶起到了拮抗作用,同时也可能诱发降温过程中的冰晶形成,不利于玻璃化保存。柔性纳米颗粒由于其更低的表面自由能因而不易促进成核,基于此,Hou等[14]制备了普朗尼克包覆的镓铟合金纳米颗粒,其光热转换效率达到了52%,高于已经广泛应用的GNRs (22%-32.2%),相对于传统复温方式(25±6%)将人骨髓间充质干细胞复温后存活率提高了三倍(78±3%)。进一步对含有血管组织小鼠尾的冷冻保存表明,液态金属纳米颗粒光热复温避免了重结晶造成的机械损伤(图11(d))。液态金属作为一种新的柔性纳米颗粒,能够有效的实现外场调控下的颗粒复合细胞能量选择性吸收,在光热复温领域展现出了巨大的应用前景,考虑到其柔性、高光热转换效率的特点,未来有望在更广阔的细胞、组织保存中发挥作用。
-
纳米材料由于其特殊的尺寸效应,相比于宏观材料在声、光、电、磁、热等一系列物理特性方面表现出显著不同的特性。
从总体上来看,纳米颗粒作为一种功能性材料极大地改观了传统低温生物医学的研究方法和研究现状。纳米低温生物医学作为纳米技术与低温生物医学有机交叉融合的新领域,拓展了传统方式在低温手术治疗和生物样本保存的研究边界,围绕水的相变过程与生物体的相互作用实现了分子尺度的冰晶调控以及针对生物样本的高时间、空间精准度的适形、适量化能质输运,表现出更高质量的治疗和保存效果和更优异的应用优势。
从实际应用上而言,纳米材料作为一种优化手段打通了进一步强化生物传热和外场能量转化的关键环节,具体表现为强化了低温治疗的冰晶杀伤作用,同时作为术中成像引导手段显著改善了低温手术的疗效。此外纳米颗粒介导的冷冻保护剂胞内富集、冰晶微观调控以及外场诱导下的复温特性是提高细胞保存存活率并实现低温保存向更高维度组织、器官保存探索的重要推动力。
-
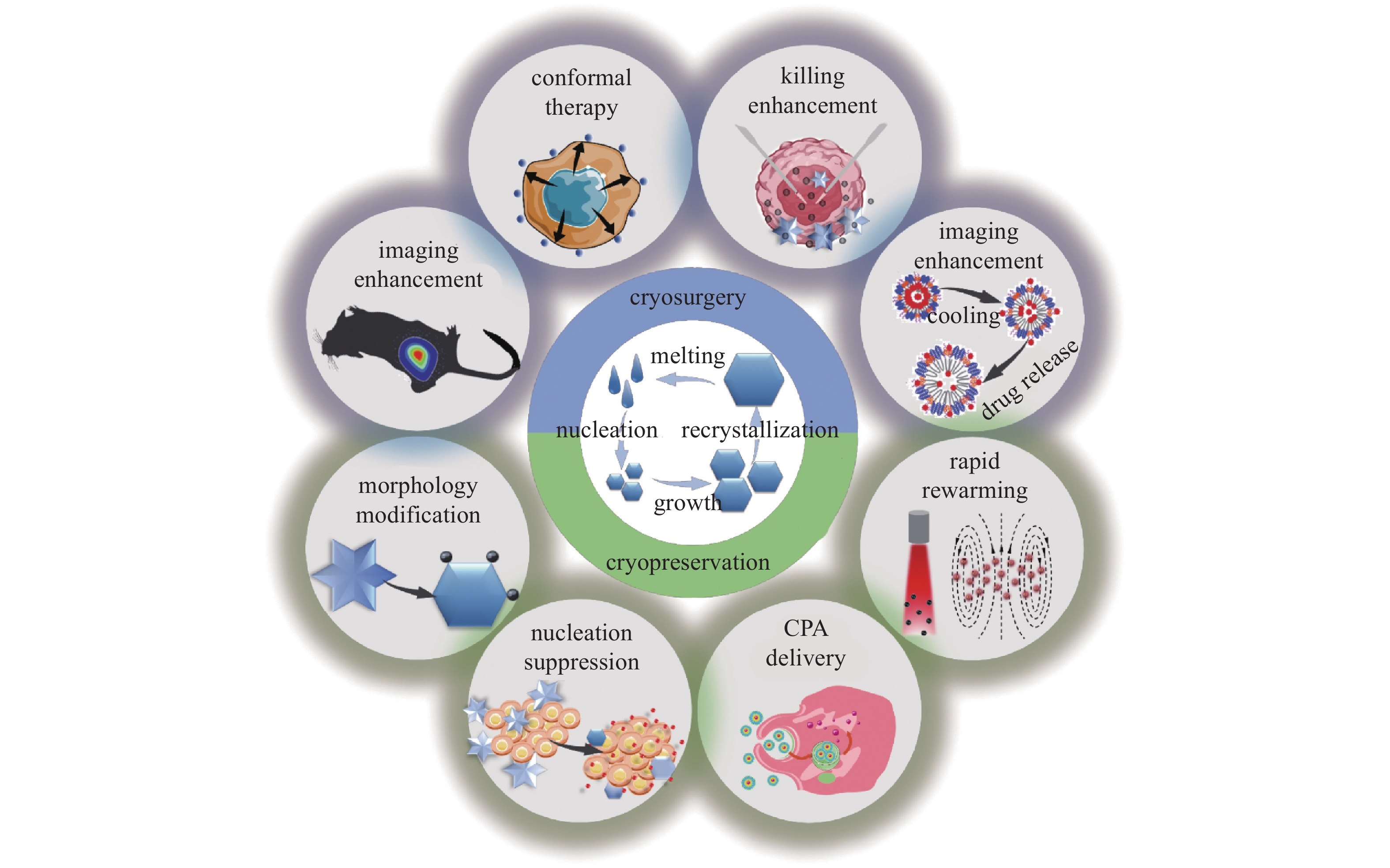
低温生物医学依托其多学科、多领域交叉共融的特点,为重大疾病治疗和生物样本保存提供了不可替代的解决方案。纳米技术的应用,极大地推动了低温生物医学的发展,在此过程中,众多新材料、新方法不断涌现出来,为强化低温治疗效果、提高低温保存质量提供了新的研究思路,拓宽了低温生物医学的研究边界,成为突破领域瓶颈的关键技术,纳米低温生物医学的技术优势如图12所示。
基于对纳米冷冻手术概念与关键问题的精准把握和深刻理解,刘静研究员曾于2007年系统总结了纳米冷冻治疗学中的六大关键基础科学问题[89]。在过去的十五年中,不管是在理论模型或是实验评估,纳米材料导致的生物材料热学性质变化、纳米颗粒的成核机制、生物样本在微纳米尺度的热损伤机理都得到了深入的研究,同时本课题组依托长期的研究和经验积累,提出并发展了多模式冷冻消融理论和方法。随着纳米技术发展以及医学影像引导技术的进步,极大地显示出了纳米冷冻手术在肿瘤治疗方面的优势。但是在热场、物质场以及功能性纳米材料的多因素耦合下,更深层次的冷冻过程中的能质分析,以实现治疗对象能量输入精准化、个体化仍然需要进一步探索。
纳米材料丰富的颗粒调控机制,有力强化了低温保存能质传输过程中的薄弱环节,从仿生的角度而言,纳米颗粒起到了抗冻蛋白类似物调控冰晶生长并削弱冰晶损伤的作用,同时作为递送载体,对实现保护剂的靶向富集和无损加载意义重大。此外,纳米颗粒耦合外部物理场突破了玻璃化保存的复温瓶颈,为实现更大尺度生物样本的长期保存提供了技术支撑。
但值得指出的是,纳米颗粒的调控效应不仅是材料的问题,新材料的开发、新的作用手段的探索仍然要根植于实现能质协同、强化传热传质的热力学基础上,破除低温生物医学研究瓶颈的关键在于厘清生物组织冰晶形成过程中的多尺度能量和物质的精准递送机制。此外,尽管实验表明当前广泛应用的纳米颗粒具有良好的生物相容性,但是纳米材料在外部环境影响下产生的积聚沉降,以及因为无法完全洗脱而产生的组织滞留等问题仍然不容忽视,这些研究都亟需考虑临床层面的切实问题加以验证和解决。
纳米低温生物医学研究进展
Research Progress of Nano Cryobiomedicine
-
摘要: 低温生物医学是一个多学科交叉的领域,低温治疗和低温保存作为其主要的应用方向,在重大疾病治疗、延长生物样本保存时间等领域发挥了积极作用。然而传统的低温治疗在实现精准化适形化治疗方面有待突破,低温保存同样面临着大尺度生物样本无法长期低温保存的挑战。纳米材料与技术的引入极大地拓展了低温治疗与低温保存的研究思路,成为克服低温生物医学发展瓶颈的关键因素之一。本文阐述了纳米技术与低温生物医学结合的基本理念及作用机理,归纳总结了几类典型的纳米低温生物医学材料及技术,介绍了纳米材料在冰晶调控、物质递送、强化传热等方面的作用。Abstract: Cryogenic biomedicine is a multidisciplinary field. As the main application directions, cryosurgery and cryopreservation have played an active role in disease treatment and prolonging the preservation time of biological samples. However, traditional cryotherapy needs to make breakthroughs in achieving intensive killing and satisfying conformal treatment. Cryopreservation also faces the challenges of protective agent loading, ice crystal regulation and rapid rewarming of vitrified samples. The introduction of nanotechnology has greatly expanded the method of cryotherapy and cryopreservation, and has become the key factor to break the bottleneck of cryogenic biomedicine. In this paper, the mechanism of nanotechnology is reviewed, and the applications of nanomaterials in ice regulation, protective agent delivery and heat transfer enhancement are introduced. It is expected to summarize the existing experience and promote faster and better development of the field.
-
Key words:
- Cryosurgery /
- Cryopreservation /
- Nanomaterials /
- Nanotechnology .
-

-
图 3 纳米颗粒对成核势垒的影响[22]。(a) 冰晶成核势垒图, (b) 球形纳米颗粒成核效应曲线, (c) 纳米管成核效应曲线, (d) 实心圆柱体纳米颗粒成核效应曲线
Figure 3. Effect of nanoparticles on nucleation barrier[22]. (a) Diagram of the ice nucleation barrier, (b) nucleation effect curve of spherical nanoparticles, (c) nucleation effect curve of nanotubes, (d) nucleation effect curve of solid cylindrical nanoparticles
图 4 纳米颗粒的低温治疗应用。(a)-(d) 不同降温阶段、不同浓度、不同半径纳米颗粒对成核的影响[25], (e) CS-CNC强化杀伤机理[32], (f) CNC结构示意图[32], (g) 纳米颗粒调节冰晶生长红外热图[25], (h) 可相变纳米颗粒对外周组织冷冻保护机理图[39]
Figure 4. Application of nanoparticles in cryosurgery. (a)-(d) Effects of different cooling stages, different concentrations and different radii of nanoparticles on nucleation[25], (e) enhanced killing mechanism of CS-CNC[32], (f) structural diagram of CNC[32], (g) infrared heat map of ice crystal growth regulated by nanoparticles[25], (h) schematic diagram of cryopreservation mechanism of phase change nanoparticles in peripheral tissues[39]
图 5 纳米颗粒对传热的影响。(a) 生物组织低温治疗温度曲线[46],(b) 加载MgO纳米颗粒组织的热扩散率比值变化曲线[38]:下标f、u 分别表示冻结区域纳米颗粒与生物组织混合物、未冻结区域纳米颗粒与生物组织混合物;ft、ut分别代表冻结组织和未冻结组织;η为纳米颗粒的体积分数,(c) 加载MgO纳米颗粒组织的热容比值变化曲线[38],(d) 加载MgO纳米颗粒组织的热导率比值变化曲线[38]
Figure 5. Thermal effect of nanoparticles. (a) Temperature curves of biological tissue in cryotherapy[46], (b) the curve of thermal diffusivity ratio when loaded MgO nanoparticles: subscripts f and u represent frozen and unfrozen mixtures of nanoparticles and tissues, respectively, and subscripts ft and ut represent frozen and unfrozen tissues, respectively, and η is the volume friction of nanoparticles[38], (c) the curve of thermal capacity ratio when loaded MgO nanoparticles[38], (d) the curve of thermal conductivity ratio when loaded with MgO nanoparticles[38]
图 6 低温响应的纳米药物的协同治疗作用。(a)纳米颗粒低温裂解示意图[48], (b)低温、pH双重响应纳米颗粒[49], (c) 冷冻消融与化疗联合治疗示意图[49]
Figure 6. Synergistic therapeutic effect of nanoparticles. (a) Cold-responsive disassembled nanoparticles[48], (b) Cold and pH-responsive nanoparticles[49], (c) schematic diagram of cryoablation combined with chemotherapy[49]
图 7 纳米颗粒的强化成像作用。(a)强化成像的不同纳米颗粒[52], (b)结晶诱发的聚集诱导发光现象[51], (c) 癌细胞内的特异性聚集诱导发光现象[51]
Figure 7. Enhanced imaging effect of nanoparticles. (a) Different nanoparticles in enchancing imaging[52]. (b) Aggregation-Induced Emission (AIE) triggered by crystallization[51]. (c) Specific aggregation-induced Emission in cancer cells[51]
图 8 生物样本冷冻保存的热力学过程分析。(a)冷冻保存热力学过程图[54], (b)玻璃化保存温度曲线[54], (c)玻璃化保存复温方式比较图, (d)冷冻保存主要影响因素图示
Figure 8. Cryopreservation of biospecimens. (a) Diagram of thermodynamic process of cryopreservation[54], (b) temperature curve of vitrification[54], (c) comparison of rewarming methods for vitrification, (d) diagram of main influencing factors of cryopreservation
图 9 纳米颗粒的无创递送应用。(a) 海藻糖无创递送[15], (b) 温度敏感纳米颗粒递送海藻糖机理[61],(c) 海藻糖无创递送与微流体封装技术用于胰岛细胞保存[62], (d) 纳米海藻糖的重结晶抑制作用,nTre,fTre分别指代纳米海藻糖和自由海藻糖[63]
Figure 9. Application of non-invasive delivery of nanoparticles. is needed. (a) Non-invasive delivery of trehalose[15], (b) Mechanism of trehalose delivery of cold-responsive nanoparticles[61], (c) Non-invasive trehalose delivery and microfluidic encapsulation for islet cell preservation[62], (d) Recrystallization inhibition of nano-trehalose, nTre, fTre refer to nano-trehalose and free-trehalose[63]
图 10 纳米颗粒的冰晶调控作用。(a) GO结构示意图[66],(b) OQCN结构示意图[65], (c) MOF结构示意图及抑冰机理[67], (d) Ti3C2Tx的抑冰机理示意图[68], (e) Ti3C2Tx表面官能团示意图[68]
Figure 10. Ice crystal regulation of nanoparticles. (a) Structural diagram of GO[66], (b) structural diagram of OQCN[65], (c) structural diagram of MOF and mechanism of ice inhibition[67], (d) schematic diagram of anti-ice mechanism of Ti3C2Tx[68], (e) schematic diagram of the surface functional groups of Ti3C2Tx[68]
图 11 纳米颗粒的高效复温应用。(a) 纳米磁热复温示意图[80], (b) 斑马鱼胚胎光热复温[84], (c) HUVECs光热复温示意图[87], (d) 柔性液态金属纳米颗粒光热复温示意图[14]
Figure 11. Application of nanoparticles in re-warming. (a) Schematic diagram of nano-magnetic re-warming[80], (b) laser-mediated re-warming of zebrafish embryos[84], (c) schematic diagram of HUVECs re-warming[87], (d) schematic diagram of photothermal re-warming of flexible liquid metal nanoparticles[14]
-
[1] Liu J, Yan J F, Deng Z S. Nano-cryosurgery: a basic way to enhance freezing treatment of Tumor[C]. Proceedings of the ASME 2007 International Mechanical Engineering Congress and Exposition, 2007, 2: 87-94 [2] Anger J T,Gilbert B R,Goldstein M. Cryopreservation of Sperm: Indications, Methods and Results[J]. The Journal of Urology,2003,170(4):1079−1084 [3] Asghar W,El Assal R,Shafiee H,et al. Preserving human cells for regenerative, reproductive, and transfusion medicine[J]. Biotechnology Journal,2014,9(7):895−903 doi: 10.1002/biot.201300074 [4] Chen G,Lv Y. Nanotechnology-based cryopreservation of cell-scaffold constructs: a new breakthrough to clinical application[J]. Cryo Letters,2016,37(6):381−387 [5] 刘静. 低温生物医学工程学原理[M]. 北京, 科学出版社, 2006, 1−2. Liu J. Principles of cryogenic biomedical engineering[M]. Beijing: Science Press, 2006, 1−2 [6] Yu T H,Liu J,Zhou Y X. Selective freezing of target biological tissues after injection of solutions with specific thermal properties[J]. Cryobiology,2005,50(2):174−182 doi: 10.1016/j.cryobiol.2005.01.001 [7] Yu T H,Liu J,Zhou Y X. Selective freezing of target biological tissues after injection of solutions with specific thermal properties[J]. Cryobiology,2009,9(8):4521−4542 [8] Hou Y,Sun Z,Rao W,et al. Nanoparticle-mediated cryosurgery for tumor therapy[J]. Nanomedicine:Nanotechnology, Biology and Medicine,2017,14(2):493−506 [9] Dou M,Lu C,Rao W. Bioinspired materials and technology for advanced cryopreservation[J]. Trends in Biotechnology,2021,40(1):93−106 [10] de Vries R J,Yarmush M,Uygun K. Systems engineering the organ preservation process for transplantation[J]. Current Opinion in Biotechnology,2019,58:192−201 doi: 10.1016/j.copbio.2019.05.015 [11] Rubinsky B,Perez P A,Carlson M E. The thermodynamic principles of isochoric cryopreservation[J]. Cryobiology,2005,50(2):121−138 doi: 10.1016/j.cryobiol.2004.12.002 [12] Taylor M J,Weegman B P,Baicu S C,et al. New approaches to cryopreservation of cells, tissues, and organs[J]. Transfusion Medicine and Hemotherapy, Karger Publishers,2019,46(3):197−215 doi: 10.1159/000499453 [13] Mi P,Cabral H,Kataoka K. Ligand-installed nanocarriers toward precision therapy[J]. Advanced Materials (Deerfield Beach, Fla. ),2020,32(13):e1902604 doi: 10.1002/adma.201902604 [14] Hou Y,Lu C,Dou M,et al. Soft liquid metal nanoparticles achieve reduced crystal nucleation and ultrarapid rewarming for human bone marrow stromal cell and blood vessel cryopreservation[J]. Acta Biomaterialia,2020,102:403−415 doi: 10.1016/j.actbio.2019.11.023 [15] Rao W,Huang H,Wang H,et al. Nanoparticle-mediated intracellular delivery enables cryopreservation of human adipose-derived stem cells using trehalose as the sole cryoprotectant[J]. ACS Applied Materials & Interfaces,2015,7(8):5017−5028 [16] Lovelock J E. The haemolysis of human red blood-cells by freezing and thawing[J]. Biochimica Et Biophysica Acta,1953,10(3):414−426 [17] Mazur P. Cryobiology: the freezing of biological systems[J]. Science,1970,168(3934):939−949 doi: 10.1126/science.168.3934.939 [18] Bourne M H,Piepkorn M W,Clayton F,et al. Analysis of microvascular changes in frostbite injury[J]. Journal of Surgical Research,1986,40(1):26−35 doi: 10.1016/0022-4804(86)90141-1 [19] Hoffmann N E,Bischof J C. The cryobiology of cryosurgical injury[J]. Urology,2002,60(2, Supplement 1):40−49 [20] Fletcher N H. Nucleation by crystalline particles[J]. The Journal of Chemical Physics,1963,38(1):237−240 doi: 10.1063/1.1733468 [21] Zhang Z S,Liu X Y. Control of ice nucleation: freezing and antifreeze strategies[J]. Chemical Society Reviews,2018,47(18):7116−7139 doi: 10.1039/C8CS00626A [22] 李方方. 生物材料纳米冷冻过程的理论与实验研究[D]. 中国科学院理化技术研究所, 2010. Li F F. Theoretical and experimental study on nano-freezing process of biological materials[D]. Technical Institute of Physics and Chemistry, CAS, Beijing, 2010,128 [23] Raymond J A,DeVries A L. Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J]. Proceedings of the National Academy of Sciences of the United States of America,1977,74(6):2589−2593 doi: 10.1073/pnas.74.6.2589 [24] Gage A A,Baust J. Mechanisms of tissue injury in cryosurgery[J]. Cryobiology,1998,37(3):171−186 doi: 10.1006/cryo.1998.2115 [25] 闫井夫. 肿瘤高效冷热治疗机理的研究[D]. 中国科学院理化技术研究所, 2008. Yan J F. Study on mechanisms for a highly efficient freezing/heating physical treatment of tumor[D]. Technical Institute of Physics and Chemistry, CAS, Beijing, 2008, 173 [26] Liu J,Zhou Y,Yu T,et al. Minimally invasive probe system capable of performing both cryosurgery and hyperthermia treatment on target tumor in deep tissues[J]. Minimally Invasive Therapy & Allied Technologies,2004,13(1):47−57 [27] Davies P L. Ice-binding proteins: a remarkable diversity of structures for stopping and starting ice growth[J]. Trends in Biochemical Sciences,2014,39(11):548−555 doi: 10.1016/j.tibs.2014.09.005 [28] He Z Z, Di D R, Liu J. Enhancement of cryosurgery using biodegradable mgo nanoparticles[C]. ASME 2012 Third International Conference on Micro/Nanoscale Heat and Mass Transfer, 2013: 951–954 [29] Zachariassen K E,Hammel H T. Nucleating agents in the haemolymph of insects tolerant to freezing[J]. Nature,1976,262(5566):285−287 doi: 10.1038/262285a0 [30] Vonnegut B. The nucleation of ice formation by silver iodide[J]. Journal of Applied Physics,1947,18(7):593−595 [31] Lindow S E. The role of bacterial ice nucleation in frost injury to plants[J]. Annual Review of Phytopathology,1983,21(1):363−384 doi: 10.1146/annurev.py.21.090183.002051 [32] Hou Y,Sun X,Dou M,et al. Cellulose nanocrystals facilitate needle-like ice crystal growth and modulate molecular targeted ice crystal nucleation[J]. Nano Letters,2021,21(11):4868−4877 doi: 10.1021/acs.nanolett.1c00514 [33] Proimos B S. Beam-shapers oriented by gravity in rotational therapy[J]. Radiology,1966,87(5):928−932 doi: 10.1148/87.5.928 [34] Takahashi S. Conformation Radiotherapy. Rotation techniques as applied to radiography and radiotherapy of cancer[J]. Acta Radiologica: Diagnosis, 1965: Suppl 242: 1+ [35] Wright K A,Proimos B S,Trump J G,et al. Field shaping and selective protection in megavolt radiation therapy[J]. Radiology,1959,72(1):101−101 doi: 10.1148/72.1.101 [36] Rabin Y,Stahovich T F. Cryoheater as a means of cryosurgery control[J]. Physics in Medicine and Biology,2003,48:619−632 doi: 10.1088/0031-9155/48/5/305 [37] Baissalov R,Sandison G A,Reynolds D,et al. Simultaneous optimization of cryoprobe placement and thermal protocol for cryosurgery[J]. Physics in Medicine and Biology,2001,46(7):1799−1814 doi: 10.1088/0031-9155/46/7/305 [38] 狄德瑞. 可生物降解纳米颗粒的强化冷冻机理研究[D]. 中国科学院理化技术研究所, 2012. Di D R. Study on the freezing enhancement mechanisms of biodegradable nanoparticles[D]. Technical Institute of Physics and Chemistry, CAS, Beijing, 2012, 125 [39] Lv Y,Zou Y,Yang L. Feasibility study for thermal protection by microencapsulated phase change Micro/Nanoparticles during Cryosurgery[J]. Chemical Engineering Science,2011,66(17):3941−3953 doi: 10.1016/j.ces.2011.05.031 [40] Lv Y,Zou Y,Yang L. Uncertainty and sensitivity analysis of properties of phase change micro/nanoparticles for thermal protection during cryosurgery[J]. Forschung im Ingenieurwesen,2012,76(1–2):41−50 [41] Seifert J K,Morris D L. Indicators of recurrence following cryotherapy for hepatic metastases from colorectal cancer[J]. British Journal of Surgery,1999,86(2):234−240 [42] Crezee J,Lagendijk J J. Temperature uniformity during hyperthermia: the impact of large vessels[J]. Physics in Medicine and Biology,1992,37(6):1321−1337 doi: 10.1088/0031-9155/37/6/009 [43] Deng Z S,Liu J,Wang H-W. Disclosure of the significant thermal effects of large blood vessels during cryosurgery through infrared temperature mapping[J]. International Journal of Thermal Sciences,2008,47(5):530−545 doi: 10.1016/j.ijthermalsci.2007.05.007 [44] Deng Z S, Liu J, Yan J F, et al. Experimental and numerical investigation on simulating nanocryosurgery of target tissues embedded with large blood vessels[M]. Advances in Numerical Heat Transfer, 2009, 3 [45] 孙子乔. 低温冷冻治疗中纳米材料强化传热方法研究[D]. 中国科学院理化技术研究所, 2012 Sun Z Q. Study on the nano materials freezing enhancement effects of cryosurgery[D]. Technical Institute of Physics and Chemistry, CAS, Beijing, 2012, 175 [46] Liu J,Deng Z S. Nano-cryosurgery: advances and challenges[J]. Journal of Nanoscience and Nanotechnology,2009,9(8):4521−4542 doi: 10.1166/jnn.2009.1264 [47] Rao W,Bellotti A,Littrup P J,et al. Nanoparticle-encapsulated doxorubicin enhances cryoablation of cancer stem-like cells[J]. Technology,2014,2(1):28−35 doi: 10.1142/S2339547814500022 [48] Wang H,Agarwal P,Liang Y,et al. Enhanced cancer therapy with cold-controlled drug release and photothermal warming enabled by one nanoplatform[J]. Biomaterials,2018,180:265−278 doi: 10.1016/j.biomaterials.2018.07.021 [49] Hou Y,Sun X,Yao S,et al. Cryoablation-activated enhanced nanodoxorubicin release for the therapy of chemoresistant mammary cancer stem-like cells[J]. Journal of Materials Chemistry B,2020,8(5):908−918 doi: 10.1039/C9TB01922G [50] Oldenburg A,Toublan F,Suslick K,et al. Magnetomotive contrast for in vivo optical coherence tomography[J]. Optics Express,2005,13(17):6597−6614 doi: 10.1364/OPEX.13.006597 [51] He Z,Liu P,Zhang S,et al. A freezing-induced turn-on imaging modality for real-time monitoring of cancer cells in cryosurgery[J]. Angewandte Chemie International Edition,2019,58(12):3834−3837 doi: 10.1002/anie.201813239 [52] Smith B R,Gambhir S S. Nanomaterials for In vivo imaging[J]. Chemical Reviews,2017,117(3):901−986 doi: 10.1021/acs.chemrev.6b00073 [53] Manuchehrabadi N,Gao Z,Zhang J,et al. Improved tissue cryopreservation using inductive heating of magnetic nanoparticles[J]. Science Translational Medicine,2017,9(379):eaah4586 doi: 10.1126/scitranslmed.aah4586 [54] Huang H,He X,Yarmush M L. Advanced technologies for the preservation of mammalian biospecimens[J]. Nature Biomedical Engineering,2021,5(8):793−804 doi: 10.1038/s41551-021-00784-z [55] Polge C,Smith A U,Parkes A S. Revival of spermatozoa after vitrification and dehydration at low temperatures[J]. Nature,1949,164(4172):666−666 doi: 10.1038/164666a0 [56] Lovelock J E,Bishop M W H. Prevention of freezing damage to living cells by dimethyl sulphoxide[J]. Nature, Nature Publishing Group,1959,183(4672):1394−1395 [57] Wolkers W F,Tablin F,Crowe J H. From anhydrobiosis to freeze-drying of eukaryotic cells[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2002,131(3):535−543 [58] Eroglu A,Toner M,Toth T L. Beneficial effect of microinjected trehalose on the cryosurvival of human oocytes[J]. Fertility and Sterility,2002,77(1):152−158 doi: 10.1016/S0015-0282(01)02959-4 [59] Centner C S,Murphy E M,Priddy M C,et al. Ultrasound-induced molecular delivery to erythrocytes using a microfluidic system[J]. Biomicrofluidics,2020,14(2):024114 doi: 10.1063/1.5144617 [60] Shirakashi R,Köstner C M,Müller K J,et al. Intracellular delivery of trehalose into mammalian cells by electropermeabilization[J]. The Journal of Membrane Biology,2002,189(1):45−54 doi: 10.1007/s00232-002-1003-y [61] Zhang Y,Wang H,Stewart S,et al. Cold-responsive nanoparticle enables intracellular delivery and rapid release of trehalose for organic-solvent-free cryopreservation[J]. Nano Letters,2019,19(12):9051−9061 doi: 10.1021/acs.nanolett.9b04109 [62] Cheng Y,Yu Y,Zhang Y,et al. Cold-responsive nanocapsules enable the sole-cryoprotectant-trehalose cryopreservation of β cell–laden hydrogels for diabetes treatment[J]. Small,2019,15(50):1904290 doi: 10.1002/smll.201904290 [63] 姚思远. 纳米海藻糖在人诱导多能干细胞冷冻保存中的传热传质特性研究[D]. 中国科学院理化技术研究所, 2021. Yao S Y. Study on heat and mass transfer characteristics of nano trehalose in cryopreservation of human pluripotent stem cells[D]. Technical Institute of Physics and Chemistry, CAS, Beijing, 2021, 79 [64] He Z,Liu K,Wang J. Bioinspired materials for controlling ice nucleation, growth, and recrystallization[J]. Accounts of Chemical Research,2018,51(5):1082−1091 doi: 10.1021/acs.accounts.7b00528 [65] Bai G,Song Z,Geng H,et al. Oxidized quasi-carbon nitride quantum dots inhibit ice growth[J]. Advanced Materials,2017,29(28):1606843 doi: 10.1002/adma.201606843 [66] Geng H,Liu X,Shi G,et al. Graphene oxide restricts growth and recrystallization of ice crystals[J]. Angewandte Chemie International Edition,2017,56(4):997−1001 doi: 10.1002/anie.201609230 [67] Zhu W,Guo J,Agola J O,et al. Metal–organic framework nanoparticle-assisted cryopreservation of red blood cells[J]. Journal of the American Chemical Society,2019,141(19):7789−7796 doi: 10.1021/jacs.9b00992 [68] Cao Y,Chang T,Fang C,et al. Inhibition effect of Ti3C2Tx MXene on ice crystals combined with laser-mediated heating facilitates high-performance cryopreservation[J]. ACS Nano,2022,16(6):8837−8850 doi: 10.1021/acsnano.1c10221 [69] Pegg D E,Green C J,Walter C A. Attempted Canine renal cryopreservation using dimethyl sulphoxide helium perfusion and microwave thawing[J]. Cryobiology,1978,15(6):618−626 doi: 10.1016/0011-2240(78)90086-X [70] Jin B,Mazur P. High survival of mouse oocytes/embryos after vitrification without permeating cryoprotectants followed by ultra-rapid warming with an Ir laser pulse[J]. Scientific Reports,2015,5:9271 doi: 10.1038/srep09271 [71] Otero L,Rodríguez A C,Pérez-Mateos M,et al. Effects of magnetic fields on freezing: application to biological products[J]. Comprehensive Reviews in Food Science and Food Safety,2016,15(3):646−667 doi: 10.1111/1541-4337.12202 [72] Chemat F,Zill-e-Huma null,Khan M K. Applications of ultrasound in food technology: processing, preservation and extraction[J]. Ultrasonics Sonochemistry,2011,18(4):813−835 doi: 10.1016/j.ultsonch.2010.11.023 [73] Etheridge M L,Xu Y,Rott L,et al. Rf Heating of magnetic nanoparticles improves the thawing of cryopreserved biomaterials[J]. Technology,2014,02(3):229−242 doi: 10.1142/S2339547814500204 [74] Wang J,Zhao G,Zhang Z,et al. Magnetic induction heating of superparamagnetic nanoparticles during rewarming augments the recovery of hucm-mscs cryopreserved by vitrification[J]. Acta Biomaterialia,2016,33:264−274 doi: 10.1016/j.actbio.2016.01.026 [75] Zhang X,Zhao G,Cao Y,et al. Magnetothermal heating facilitates the cryogenic recovery of stem cell–laden Alginate–Fe3O4 nanocomposite hydrogels[J]. Biomaterials Science, The Royal Society of Chemistry,2018,6(12):3139−3151 doi: 10.1039/C8BM01004H [76] Gao Z,Ring H L,Sharma A,et al. Preparation of scalable silica‐coated iron oxide nanoparticles for nanowarming[J]. Advanced Science,2020,7(4):1901624 doi: 10.1002/advs.201901624 [77] Liu X,Zhao G,Chen Z,et al. Dual suppression effect of magnetic induction heating and microencapsulation on ice crystallization enables low-cryoprotectant vitrification of stem cell–alginate hydrogel constructs[J]. ACS Applied Materials & Interfaces,2018,10(19):16822−16835 [78] Brockbank K G M,Chen Z,Greene E D,et al. Vitrification of heart valve tissues[J]. Methods in Molecular Biology (Clifton, N. J. ),2015,1257:399−421 [79] Sharma A,Rao J S,Han Z,et al. Vitrification and nanowarming of kidneys[J]. Advanced Science,2021,8(19):2101691 doi: 10.1002/advs.202101691 [80] Zhan T,Liu K,Yang J,et al. Fe3O4 nanoparticles with carboxylic acid functionality for improving the structural integrity of whole vitrified rat kidneys[J]. ACS Applied Nano Materials,2021,4(12):13552−13561 doi: 10.1021/acsanm.1c03014 [81] Zhen X,Cheng P,Pu K. Recent advances in cell membrane-camouflaged nanoparticles for cancer phototherapy[J]. Small (Weinheim an Der Bergstrasse, Germany),2019,15(1):e1804105 doi: 10.1002/smll.201804105 [82] Nam J,Son S,Ochyl L J,et al. Chemo-photothermal therapy combination elicits anti-tumor immunity against advanced metastatic cancer[J]. Nature Communications,2018,9(1):1074 doi: 10.1038/s41467-018-03473-9 [83] Khosla K, Zhan L, Bhati A, et al. Characterization of laser gold nanowarming: a platform for millimeter-scale cryopreservation[J]. Langmuir, 2018, 35 [84] Khosla K,Wang Y,Hagedorn M,et al. Gold nanorod induced warming of embryos from the cryogenic state enhances viability[J]. ACS Nano,2017,11(8):7869−7878 doi: 10.1021/acsnano.7b02216 [85] Knavel E M,Brace C L. Tumor ablation: common modalities and general practices[J]. Techniques in Vascular and Interventional Radiology,2013,16(4):192−200 doi: 10.1053/j.tvir.2013.08.002 [86] Chatterjee D K,Diagaradjane P,Krishnan S. Nanoparticle-mediated hyperthermia in cancer therapy[J]. Therapeutic Delivery, Future Science,2011,2(8):1001−1014 doi: 10.4155/tde.11.72 [87] Panhwar F,Chen Z,Hossain S M C,et al. Near-infrared laser mediated modulation of ice crystallization by two-dimensional nanosheets enables high-survival recovery of biological cells from cryogenic temperatures[J]. Nanoscale,2018,10(25):11760−11774 doi: 10.1039/C8NR01349G [88] Yuan F,Zhao G,Panhwar F. Enhanced killing of HepG2 during cryosurgery with Fe3O4-nanoparticle improved intracellular ice formation and cell dehydration[J]. Oncotarget,2017,8(54):92561−92577 doi: 10.18632/oncotarget.21499 [89] Liu J. Nano cryosurgical therapy: new frontier in nano medicine[J]. Science & Technology Review,2007(15):67−74 (刘静. 纳米冷冻治疗学——纳米医学的新前沿[J]. 科技导报,2007(15):67−74(in chinese) doi: 10.3321/j.issn:1000-7857.2007.15.015 Liu J. Nano cryosurgical therapy: new frontier in nano medicine[J]. Science & Technology Review, 2007, 25(15): 67-74 doi: 10.3321/j.issn:1000-7857.2007.15.015 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: