-
随着全球工业化进程的加快,对矿产资源的需求日益增长,尤其是对锰矿石的需求[1]。锰作为我国重要的战略资源,广泛应用于钢铁、化工、电池制造等领域[2-3]。软锰矿作为一种常见的锰矿石,其主要成分为二氧化锰(MnO2),由于其结构疏松、反应活性较高,被认为是一种理想的锰源。而MnO2可以稳定存在于酸性溶液或碱性溶液中,因此锰冶金的本质是将软锰矿中难溶的四价锰(MnO2)还原为易溶于酸的锰的低价氧化物(MnO)[4-6]。
传统碳热还原软锰矿工艺一般需要在973.15~1273.15 K的温度下反应2 h以上才能够得到稳定的MnO,存在还原温度高和能耗大的问题,且无法满足环保要求[7-10]。而湿法冶金一般需要在90℃以上、较低的pH值下反应3~5 h[11-12];存在着酸耗大、时间长和浸出效率低等问题,更加适用于低品位软锰矿的还原[13-14]。
近年来,生物质能因其可持续性、环境兼容性、成本效益以及广泛的可获得性而受到了学术界的广泛关注。生物质在573.15~1073.15 K的温度下热解可以产生还原性挥发物(CO、H2、CH4)以及固定碳,因此被认为是一种优良的还原剂[15];但生物质却存在着能量密度低的缺点,其热值通常只有煤炭的1/3~1/2[16-19]。而真空冶金作为一种新兴的环保冶金技术,通过在远低于标准大气压下进行冶金作业,可以有效降低还原温度,提高反应效率,减少反应中的副产物、分离沸点较低的杂质[20-21]。
针对目前软锰矿的处理方法,本研究提出真空热解生物质还原软锰矿,以玉米秸秆为生物质还原剂,采用真空还原的方法,在真空环境下热解玉米秸秆产生的还原性气体和固定碳还原软锰矿,从而弥补生物质热值低的缺点,实现在较低温度下有效地将软锰矿中MnO2还原为MnO的目的。
-
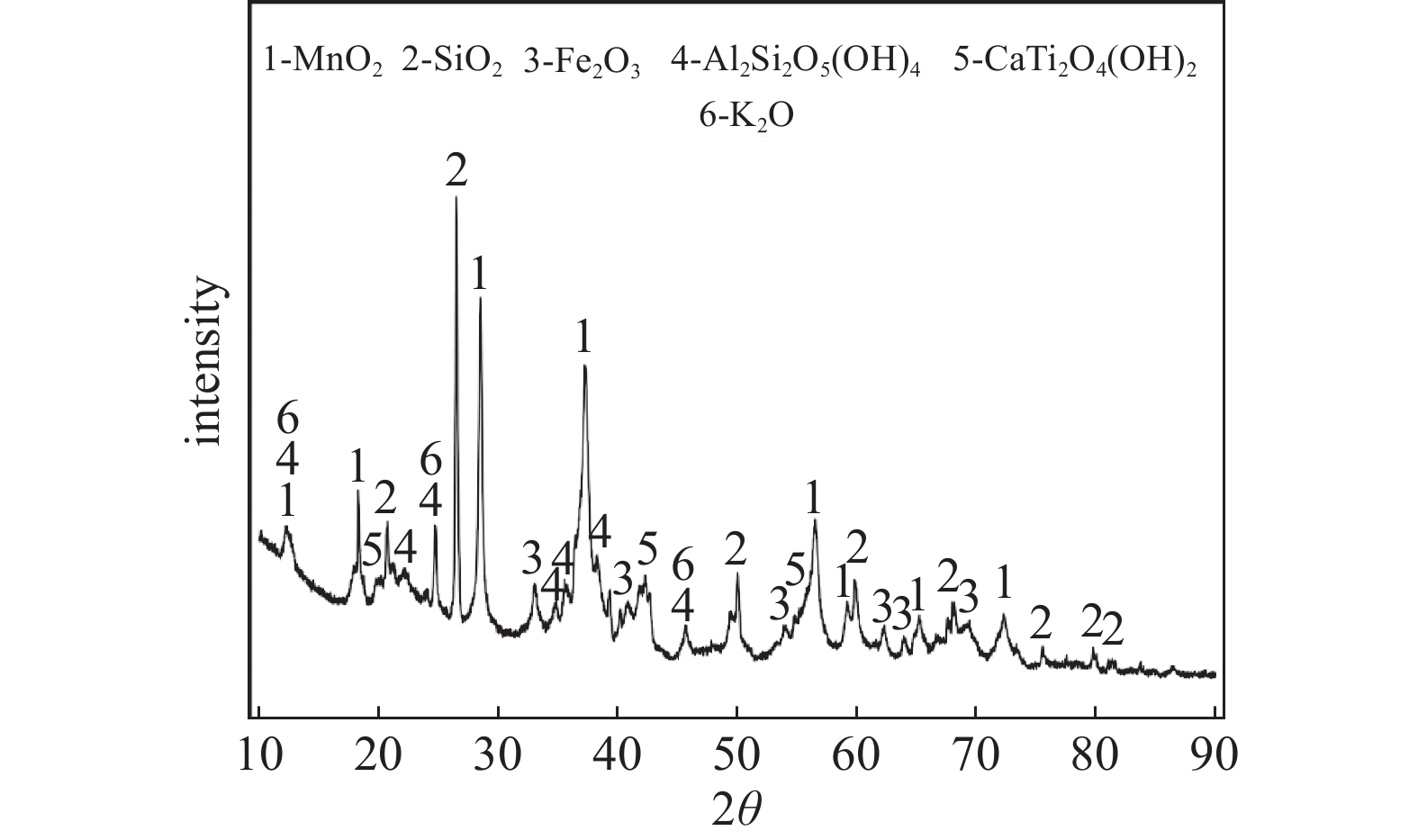
本研究选取湖南青冲锰业有限公司提供的软锰矿作为主要实验原料,软锰矿的主要化学成分、物相和形貌分析分别如表1、图1和图2所示。由表1可知,软锰矿中含锰量为40.02%,属于高品位软锰矿。软锰矿主要由Mn、Fe、Al、Si、K、Ca、Ti、Zn8种元素组成,这8种元素的质量分数总和为57.11%。由图1可以看出,软锰矿中的主要物相为MnO2、SiO2、Fe2O3、K2O、Al2Si2O5(OH)4、CaTi2O4(OH)2等。由图2可以看出软锰矿的微观结构呈现颗粒状,表面结构光滑且致密。
选取江苏省连云港市某农产品加工厂的玉米秸秆作为生物质还原剂。实验前将玉米秸秆粉碎成粉末,并筛分至200目,再在80℃下干燥2 h,分析其主要化学成分,结果如表2所示。由表可知,玉米秸秆主要由C、H、O、N、S五种元素组成,其中C、H、O占原料重量的98.82%,其中C的含量达到了45.80%,因此,可以推断玉米秸秆对软锰矿有着较好的还原效果。
-
实验仪器与设备主要为:SK-2-10型管式电阻炉,2XZ-Ⅰ型旋片式真空泵,DP-AF(真空)精密数字压力计,TCE-Ⅱ型智能温度控制器,电加热的真空室(自制,由热电偶控温)。
-
称取一定质量的软锰矿与玉米秸秆,加入少量的质量分数为15%的Na2SiO3溶液,将软锰矿与玉米秸秆混合均匀,采用油压式粉末压片机将混匀后的物料压块,压块后进行干燥。将真空室以20℃/min的升温速率升温至目标温度,再将上述干燥后的物料置于真空室中,抽真空,开始计算还原时间,还原结束后,取出物料,称重、取样,并测定还原渣中Mn2+的含量,然后按照式(1)计算MnO产率η。
其中,m为还原渣中Mn2+的质量,M为软锰矿中Mn4+的质量。其中Mn2+和Mn4+含量检测均采用硝酸铵(NH4NO3)法(GB/T1506-2016)。
软锰矿和还原渣采用XRD-6000型X射线衍射仪(XRD)进行物相分析,采用JSM-6510 LA型扫描电镜进行形貌分析。
-
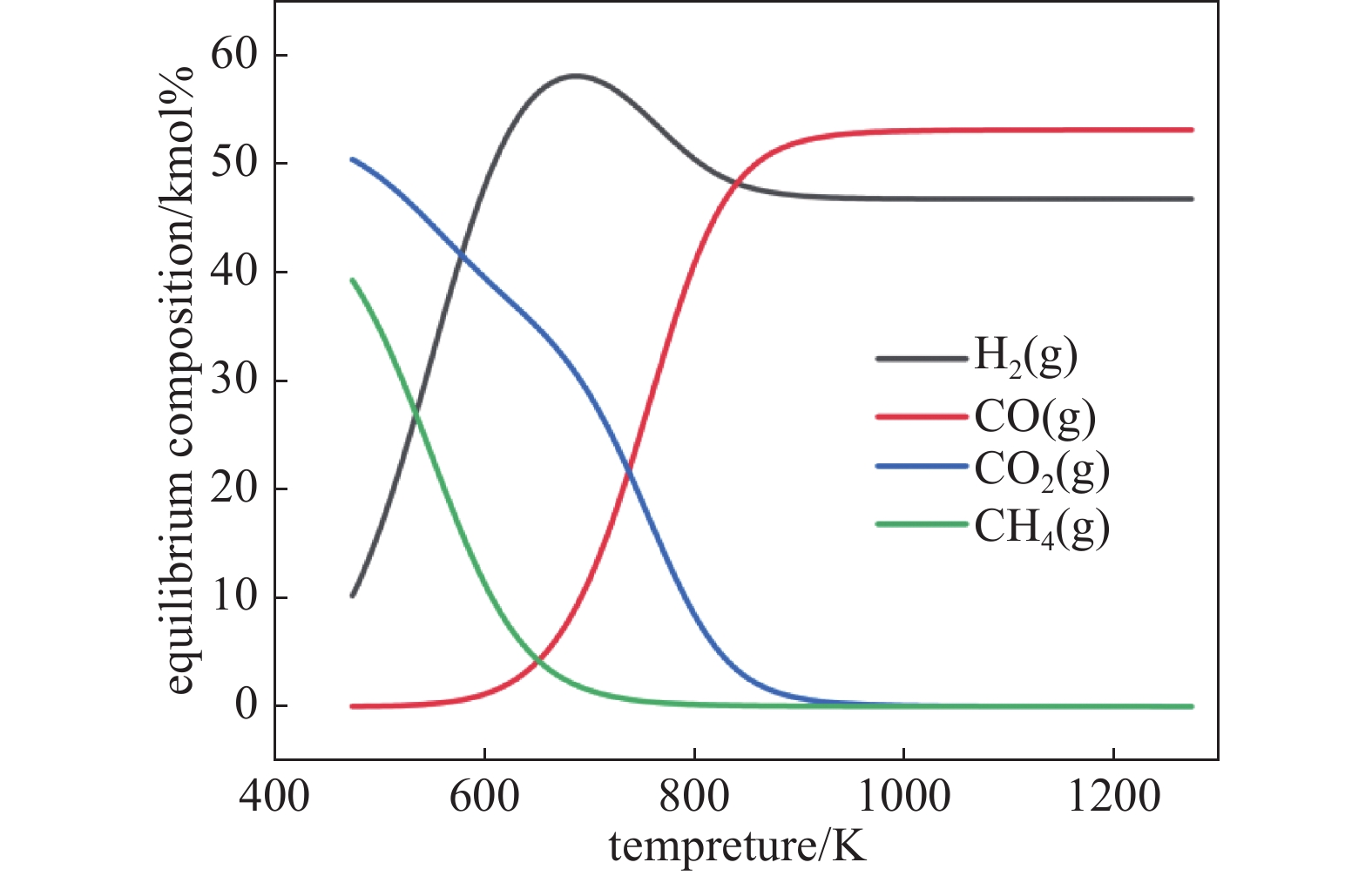
根据玉米秸秆的元素分析结果,在模拟过程中将生物质看作为CH1.76O,在500 Pa的残压下,温度范围为298.15 K~1473.15 K,对其可能产生的热解气体进行模拟。结果如图3所示。
由图可知,真空热解玉米秸秆生成的气体有H2、CO、CH4和CO2,随着热解温度的升高,生成的CO和H2含量逐渐增加,而CO2和CH4的含量逐渐降低,当温度升高至700 K时,H2的平衡含量达到峰值,CH4开始趋于稳定,且含量几乎为0;当温度升高至800 K时,CO、CO2、和H2均开始趋近于稳定,此时CO的平衡含量要明显高于H2的平衡含量;CO2和CH4的平衡含量趋近于0;因此,可以认为在还原温度范围723.15~973.15 K,起主要作用的还原性气体是CO和H2。
由于生物质真空热解产生的还原性组分为固定碳以及CO、H2等还原性气体[22],因此,真空热解生物质还原软锰矿过程中发生的主要化学反应为:
由上述反应可知,真空热解生物质还原软锰矿是由多个复杂的固−固和气−固多相反应过程组成。
-
影响MnO产率主要有还原温度、还原时间、还原剂与软锰矿质量比和系统残压等因素。
-
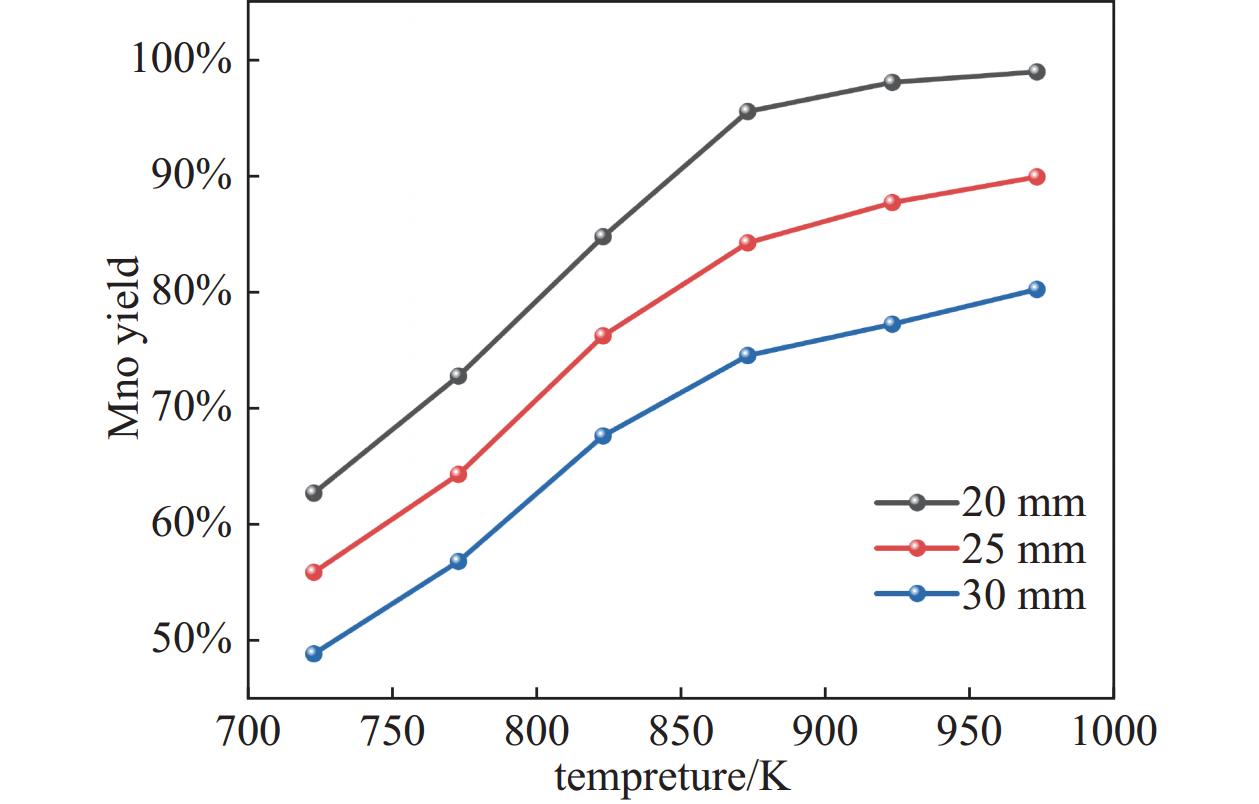
在还原剂与软锰矿质量比为16.67%,还原时间为90 min,系统残压为500 Pa,原料混合物压块截面直径分别为20 mm、25 mm和30 mm的条件下,考察温度对MnO产率的影响,结果如图4所示。由图可知,在温度范围为723.15~973.15 K内,随着温度的升高,MnO产率明显增大,这是由于温度的升高,加快了还原过程中的反应速率,同时使得真空热解生物质产生的还原性成分分子运动更加剧烈,碰撞频率和能量显著增加,使得更多的分子可以跨过反应壁垒,从而促进反应的进行。且随着截面直径的增大,MnO产率逐渐降低,这是因为真空热解玉米秸秆产生的还原性成分在截面直径较小样品中的还原扩散路径较短,有利于还原性挥发物与软锰矿充分接触。且截面直径小的样品在高温条件下更快达到反应温度,从而加快了还原反应。当温度升高至873.15 K后,MnO产率增加幅度减缓,继续升高温度对MnO产率影响程度较小。因此选取最佳还原温度为873.15 K。
-
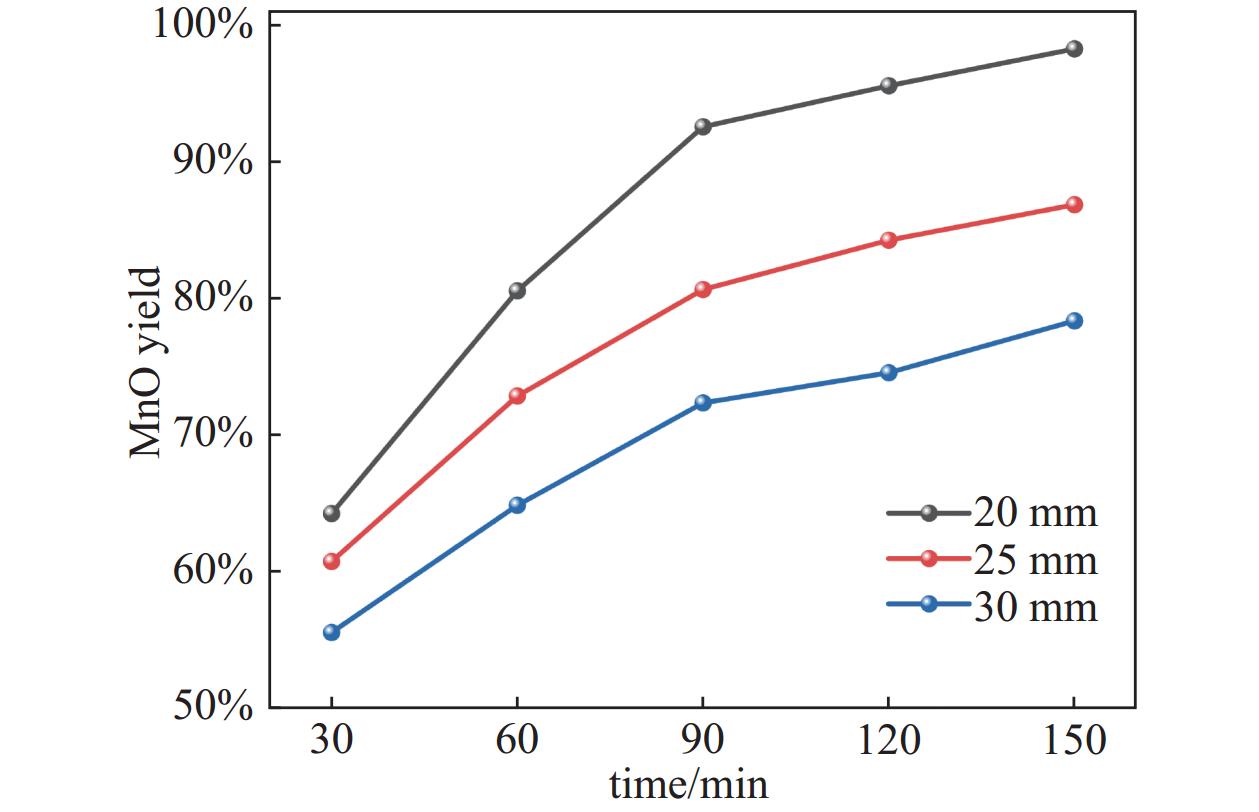
在还原剂与软锰矿质量比为16.67%,还原温度为873.15 K,系统残压为500 Pa时,考察还原时间对MnO产率的影响,结果如图5所示。由图可知,在30~120 min的还原时间内,随着还原时间的延长,不同压块截面面积(20 mm~30 mm)的原料混合物中MnO产率曲线整体均呈现迅速上升的趋势。这是因为随着时间的延长,真空热解生物质产生的还原性成分含量逐渐增加,不断与软锰矿发生反应,使得MnO产率迅速提高。当还原时间超过90 min以后,继续延长还原时间,MnO产率增大幅度减小,这是因为还原性成分含量此时已经趋于饱和,不再有明显变化。因此,选取最佳还原时为90 min。
-
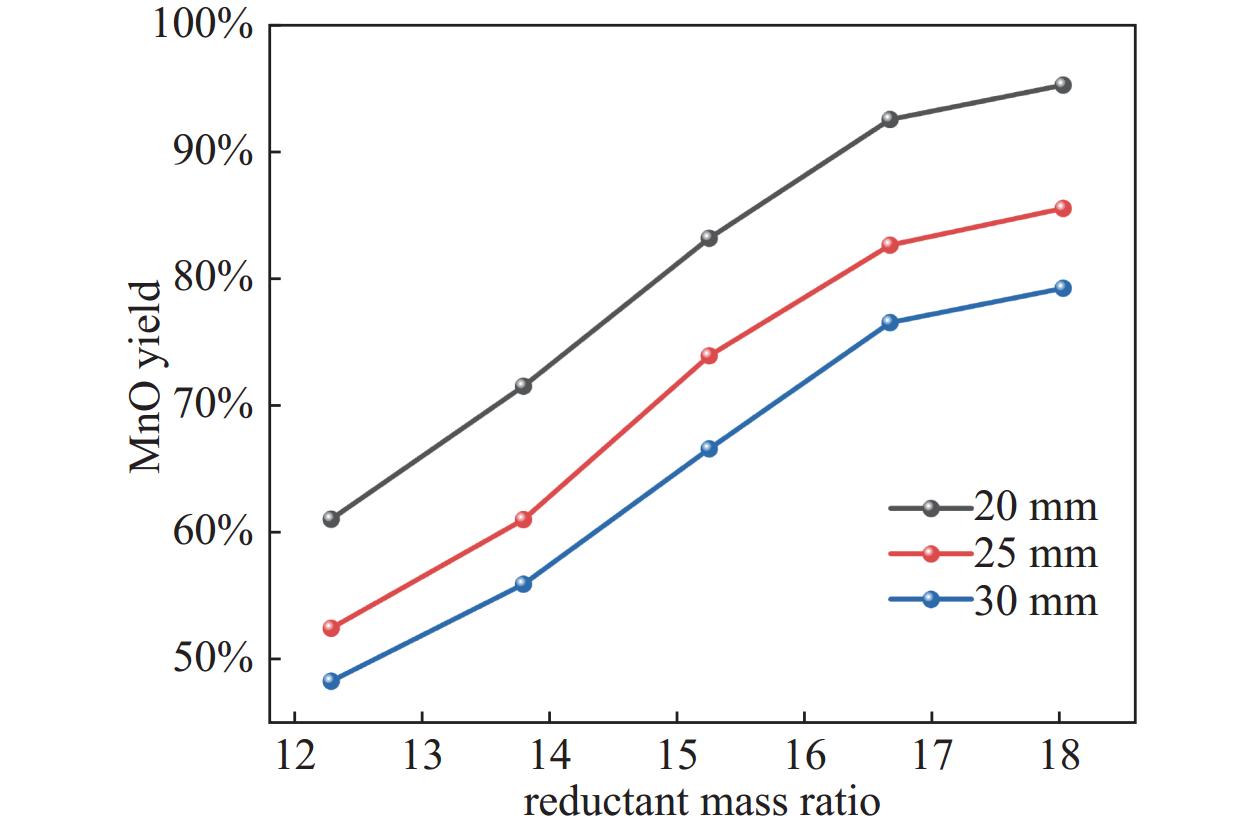
在还原温度873.15 K、还原时间90 min、残压500 Pa的条件下考察还原剂与软锰矿质量比对MnO产率的影响,结果如图6所示。还原剂与软锰矿质量比在12%~18%的范围内,MnO产率随着还原剂与软锰矿质量比的增大而升高,这是因为随着还原剂与软锰矿质量比的增大,生物质真空热解产生的还原性成分含量增加,从而加快反应速率,使MnO产率升高。当还原剂与软锰矿质量比达到16.67%后,MnO产率增大幅度减缓。因此选取最佳还原剂与软锰矿质量比为16.67%。
-
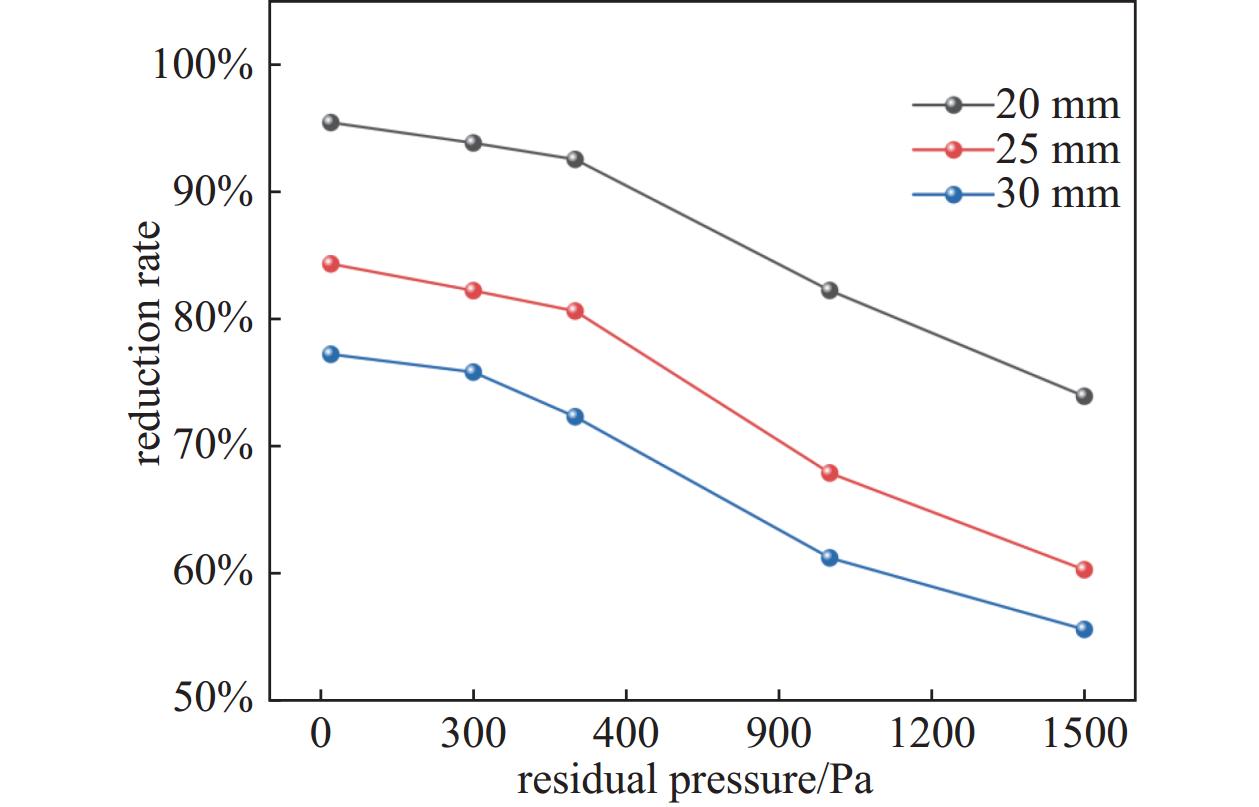
在还原温度873.15 K、还原时间90 min、还原剂与软锰矿质量比为16.67%的条件下,考察系统残压对MnO产率的影响,结果如图7所示。在系统残压范围为20 Pa~1500 Pa的范围内,MnO产率随着系统残压的升高而降低。当系统残压由20 Pa升高至500 Pa时,MnO产率缓慢减小。但当系统残压升高至500 Pa后,MnO产率减小程度迅速增大。这是因为随着系统残压的升高,还原系统中的气体分子的碰撞速率降低,使得反应速率减缓。此外,较高的系统残压条件下,反应体系中残留的氧组分会与已经还原的MnO反应,形成锰的高价态氧化物,从而进一步降低了MnO产率。因此选取最佳系统残压为500 Pa。
-
利用XRD分析不同还原温度下还原渣中的物相组成,系统研究真空热解玉米秸秆还原软锰矿的机理。
当还原时间为90 min、还原剂与软锰矿的质量比为16.67%、原料混合物压块截面直径为20 mm、系统残压为500 Pa时,还原温度范围为723.15~973.15 K的还原渣的X射线衍射图如图8所示。
由图可知,在温度范围为723.15~973.15 K,对比标准PDF卡片,还原渣中均出现了MnO。当还原温度为723.15 K时,还原渣中还有少量未被完全还原的MnO2、Mn2O3和Mn3O4,且衍射图谱上出现了许多杂峰,经与标准PDF卡片对比,这些杂峰主要是未被完全还原的Mn3O4。当温度升至773.15 K时,MnO2和Mn2O3的衍射峰完全消失,Mn3O4的衍射峰增多,MnO的衍射峰强度显著增强,这是因为随着还原温度的增加,有利于MnO2向低价态氧化物转变。当温度增加到873.15 K时,MnO的衍射峰强度较高,衍射峰较为尖锐,杂峰几乎完全消失。这表明温度达到873.15 K时,MnO的结晶度较好且MnO产率较高。
以上还原渣的X射线衍射分析结果表明:真空热解玉米秸秆还原软锰矿的还原过程依次经历了MnO2→Mn2O3→Mn3O4→MnO的物相转变。
-
在真空条件下,对玉米秸秆与软锰矿的混合物进行热解处理时,主要发生的化学反应包括软锰矿中二氧化锰(MnO2)与热解生物质产生的还原性气体(CO、H2)及残留的固定碳之间的气−固相还原反应和固−固相还原反应。根据“收缩核模型”和扩散理论[23];
(1)在忽略外部气体可以通过软锰矿气相边界层向软锰矿内部扩散;
(2)软锰矿内部各向同性,软锰矿中的MnO2分布均匀;
(3)忽略气体在压块内部扩散对整个还原过程的影响;
(4)反应前后软锰矿粉粒径不变。
真空热解生物质还原软锰矿可能的限制性环节有界面化学反应和扩散环节。在还原过程中具体的动力学方程见表3。其中,η为MnO的产率;k为速率常数;t为还原时间。
-
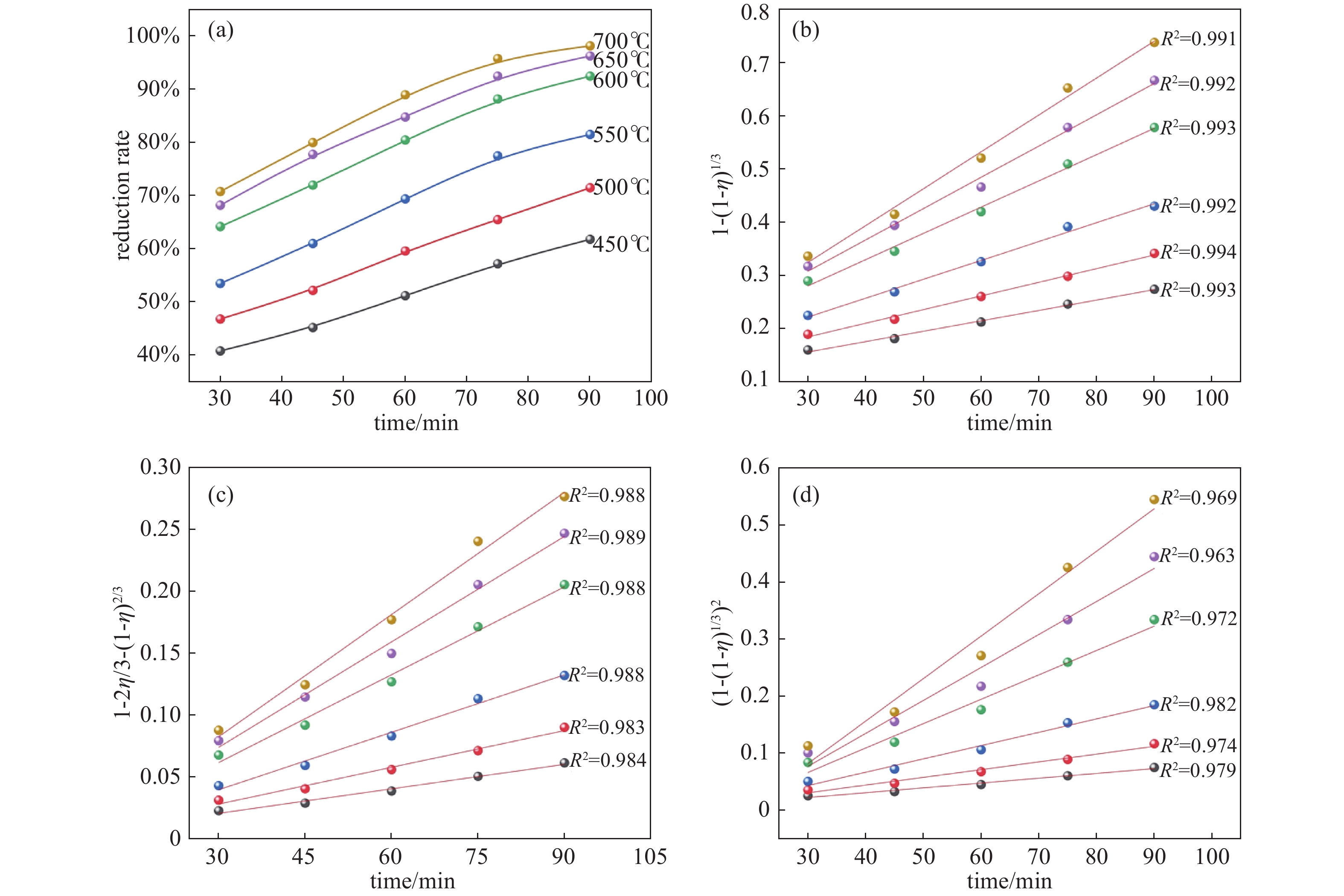
根据还原温度分别为723.15、773.15、823.15、873.15、923.15和973.15 K下的MnO产率实验数据(图9(a)),用表3中不同控制速率方程作图,分别对三个速率方程进行拟合,结果分别如图9(b)~9(d)所示。
考虑到真空热解生物质还原软锰矿的过程中,Mn的还原过程主要在30 min~90 min之内,因此选取30 min~90 min时间范围对Mn的还原过程进行动力学分析。
由图可知,当温度范围在723.15~973.15 K范围内,其中式(24)拟合效果最好,R2值均达到了0.99以上,最接近于1,拟合效果非常好。而式(25)拟合的R2值在0.98~0.99之间,拟合效果好;式(26)的拟合效果R2值处于0.963~0.982之间,拟合效果较好。因此,可以认为在真空热解玉米秸秆还原软锰矿的过程中,MnO2被还原成氧化锰MnO的过程主要受到界面化学反应的控制。
-
由图9(b)中的线性关系,用线性回归方程可以分别得到不同温度的反应速率常数k,按Arrhenius方程:
式中,E为表观活化能(J/mol),A为指前因子(S−1),R为理想气体常数J/(mol·K),T为开尔文温度(K)。
以
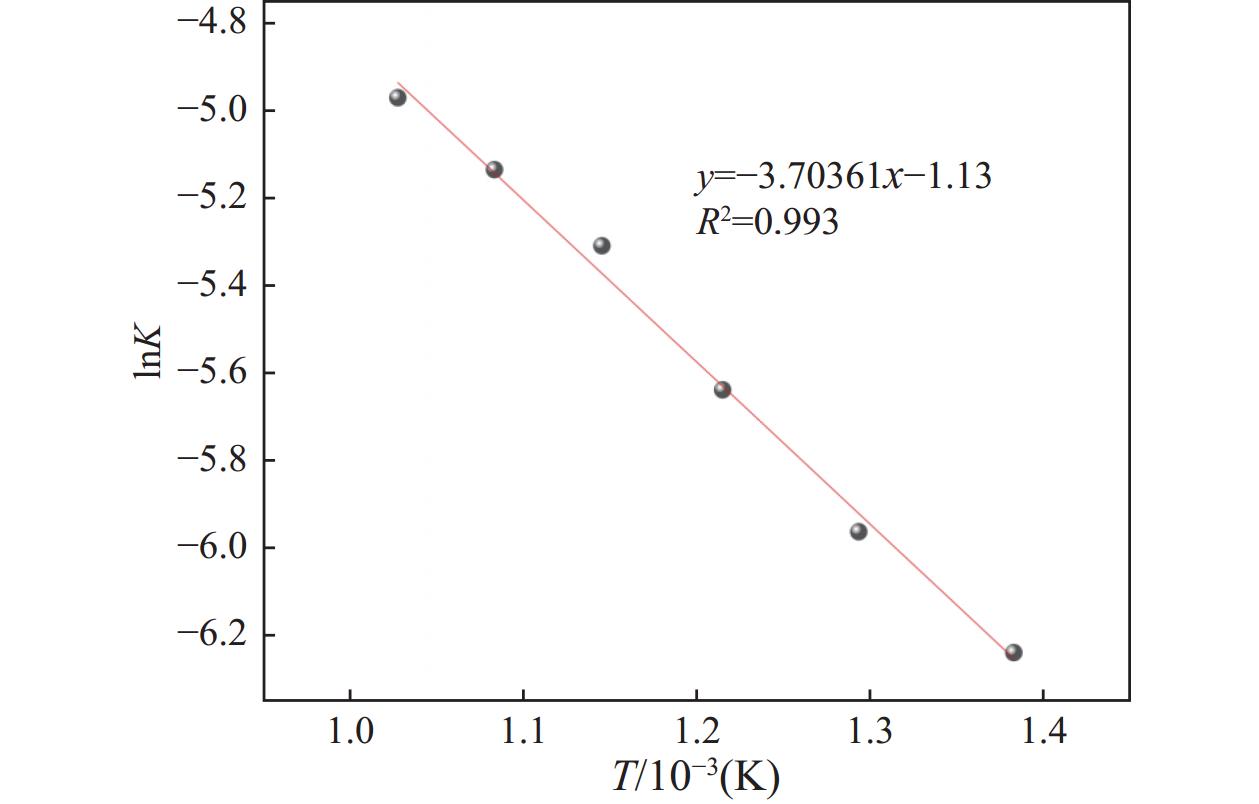
$ \text{ln}\text{k} $ 对T−1/10−3作图,得到图10所示的直线。由图10可知,界面化学反应控制回归方程为lnk=−3.70361T−1−1.13,根据Arrhenius公式计算可以得出表观活化能为30.7929 kJ/mol。因此,由式(24)和式(27)可知,真空热解生物质还原软锰矿中,Mn的还原反应动力学方程为:
将E=30.7929 KJ/mol=307929 J/mol、R=8.314 J/(mol·K)代入式(29)得到式(30):
将上述实验数据代入式(30)求得A的平均值为1.7。因此,根据研究结果,真空热解生物质还原软锰矿中,Mn的还原动力学方程可以表述为:
-
(1)真空热解玉米秸秆生物质还原软锰矿时,还原温度、还原时间、还原剂与软锰矿质量比和系统残压对MnO产率均有不同程度的影响。在还原温度873.15 K,还原时间120 min,还原剂与软锰矿质量比16.67%,系统残压500 Pa的条件下,MnO产率达到92.5%。
(2)真空热解玉米秸秆还原软锰矿的过程依次经历了MnO2→Mn2O3→Mn3O4→MnO的物相转变过程。采用真空热解玉米秸秆还原软锰矿工艺,能够有效地将软锰矿中的MnO2还原成MnO,且得到的MnO结晶度较好。
(3)真空热解生物质还原软锰矿过程中,Mn的还原受界面化学反应控制,还原反应的表观活化能为30.7929 KJ/mol,其动力学方程为:1−(1−η)(1/3)=1.7e(3703.61/T)t。
玉米秸秆真空还原高品位软锰矿的工艺研究及其动力学分析
Vacuum Reduction of High-Grade Pyrolusite with Corn Stalk and Its Kinetic Rate Analysis
-
摘要: 以玉米秸秆为生物质还原剂,采用真空热解生物质技术对高品位软锰矿进行还原。研究了还原温度、还原时间、软锰矿与玉米秸秆质量比和系统残压对MnO产率的影响,结果表明在还原温度为873.15 K、还原时间为90 min、软锰矿与玉米秸秆质量比为16.67%、系统残压500 Pa时,MnO产率达到了92.5%。不同温度下还原渣的XRD分析结果表明真空热解生物质还原软锰矿经历了MnO2→Mn2O3→Mn3O4→MnO的物相转变。在温度为723.15~973.15 K范围内,真空热解生物质还原软锰矿过程中,Mn的还原受界面化学反应控制,还原反应的表观活化能为30.7929 kJ/mol,还原过程中的动力学方程为:1−(1−η)(1/3)=1.7e(3703.61/T)t。Abstract: High-grade pyrolusite was decreased via biomass vacuum pyrolysis with corn straw as a reductant. The effects of reduction temperature, reduction time, mass ratio of pyrolusite to corn stalks, and system residual pressure on the MnO yield were investigated. The results showed that when the reduction temperature was 873.15 K, the reduction time was 90 min, the mass ratio of pyrolusite to corn straw was 16.67%, and the residual pressure was 500 Pa, the yield of MnO could reach 92.5%. XRD results of the reducing slag indicate that the reduction process of pyrolusite with corn straw as the reductant successively experiences phase transformation of MnO2→Mn2O3→Mn3O4→MnO. Within the temperature range of 723.15~973.15 K, the vacuum pyrolysis biomass reduction process of soft manganese ore is controlled by interface chemical reactions, with an apparent activation energy of 30.7929 kJ/mol. The kinetic equation of the reduction process is given by: 1−(1−η)(1/3)=1.7e(3703.61/T)t.
-
Key words:
- Pyrolusite /
- Biomass /
- Vacuum pyrolysis /
- Reduction kinetics .
-

-
图 9 Mn的还原动力学分析。(a)不同温度下的MnO产率,(b)不同温度下
$ 1 - {(1 - \eta )^{\frac{1}{3}}} $ 与时间t的关系,(c)不同温度下$ 1 - \frac{{2\eta }}{3} - {(1 - \eta )^{\frac{2}{3}}} $ 与时间t的关系,(d)不同温度下$ {\left[ {1 - {{(1 - \eta )}^{\frac{1}{3}}}} \right]^2} $ 与时间t的关系Figure 9. Reduction kinetics analysis of Mn. (a) MnO yield at different temperatures, (b) relationship between
$ 1 - {(1 - \eta )^{\frac{1}{3}}} $ and time at different temperatures, (c) relationship between$ 1 - \frac{{2\eta }}{3} - {(1 - \eta )^{\frac{2}{3}}} $ and time at different temperatures, (d) relationship between$ {\left[ {1 - {{(1 - \eta )}^{\frac{1}{3}}}} \right]^2} $ and time at different temperatures表 1 软锰矿主要化学成分/%
Table 1. Composition analysis of pyrolusite/%
元素 Mn Fe Al Si K Ca Ti Zn 含量 40.02 6.58 4.86 4.15 0.98 0.32 0.10 0.10 表 2 玉米秸秆成分分析/%
Table 2. Composition analysis of corn straw/%
元素 C H O N S 含量 45.80% 6.32% 46.60% 1.18% 0.10% 表 3 收缩核模型控制方程
Table 3. Governing equations of the shrinking core model
控制环节 速率方程 式编号 界面化学反应 $ 1-(1-\eta)^{\frac{1}{3}}=\mathit{{kt}} $ (24) 内扩散 $ 1 - \frac{{2\eta }}{3} - {(1 - \eta )^{\frac{2}{3}}} = kt $ (25) 外扩散 $ {\left[ {1 - {{(1 - \eta )}^{\frac{1}{3}}}} \right]^2} = {{kt}} $ (26) -
[1] He H, Cao J, Duan N. Analytical and mineralogical study of a Ghana manganese ore: Quantification of Mn speciation and effect of mechanical activation[J]. Chemosphere, 2016, 162: 8−15 doi: 10.1016/j.chemosphere.2016.07.061 [2] Behera A, Patel P, Ghosh A, et al. Pyrometallurgical processing of manganese ore[J]. Engineering Research Express, 2024, 6(3): 035010 doi: 10.1088/2631-8695/ad70f2 [3] Li K, Chen J, Peng J, et al. Efficient improvement for dissociation behavior and thermal decomposition of manganese ore by microwave calcination[J]. Journal of Cleaner Production, 2020, 260: 121074 doi: 10.1016/j.jclepro.2020.121074 [4] Ju J, Feng Y, Li H, et al. High-efficiency and environment-friendly separation and recovery of manganese from braunite via the ammonium sulfate roasting-water leaching process: Behavior and mechanism[J]. Chemical Engineering Journal, 2023, 466: 143218 doi: 10.1016/j.cej.2023.143218 [5] Sinha M, Purcell W. Reducing agents in the leaching of manganese ores: A comprehensive review[J]. Hydrometallurgy, 2019, 187: 168−186 doi: 10.1016/j.hydromet.2019.05.021 [6] Wu H, Feng Y, Li H, et al. Co-recovery of manganese from pyrolusite and gold from carbonaceous gold ore using fluidized roasting coupling technology[J]. Chemical Engineering and Processing - Process Intensification, 2020, 147: 107742 doi: 10.1016/j.cep.2019.107742 [7] Chen G, Jiang C, Liu R, et al. Leaching kinetics of manganese from pyrolusite using pyrite as a reductant under microwave heating[J]. Separation and Purification Technology, 2021, 277: 119472 doi: 10.1016/j.seppur.2021.119472 [8] Li T. Technology of low grade pyrolusite ore reduction process and recent advances[J]. China's Manganese Industry, 2008, 2: 143−144 [9] Yang C, Duan X, Zhang X, et al. Acid-free extraction of manganese from pyrolusite tailings by in situ redox interaction with waste copperas[J]. Process Safety and Environmental Protection, 2023, 169: 149−158 doi: 10.1016/j.psep.2022.11.026 [10] Zhang Y, Liang Y, Li S, et al. A review of biomass pyrolysis gas: Forming mechanisms, influencing parameters, and product application upgrades[J]. Fuel, 2023, 347: 128461 doi: 10.1016/j.fuel.2023.128461 [11] Wang R, Gao P, Yuan S, et al. Precise regulation of the phase transformation for pyrolusite during the reduction roasting process[J]. International Journal of Minerals, Metallurgy and Materials, 2024, 31(1): 81−90 doi: 10.1007/s12613-023-2688-4 [12] Xue Z, Feng Y, Li H, et al. Extraction of various valuable elements from oceanic manganese nodules using coal gasification slag via reduction roasting-acid leaching process[J]. Journal of Industrial and Engineering Chemistry, 2024, 129: 390−402 doi: 10.1016/j.jiec.2023.08.052 [13] Ju J, Feng Y, Li H, et al. Efficient extraction of manganese from low-grade pyrolusite by a sawdust pyrolysis reduction roasting-acid leaching process[J]. Jom, 2022, 74(5): 1978−1988 doi: 10.1007/s11837-022-05215-1 [14] Lin S, Gao L, Yang Y, et al. Dielectric properties and high temperature thermochemical properties of the pyrolusite-pyrite mixture during reduction roasting[J]. Journal of Materials Research and Technology, 2020, 9(6): 13128−13136 doi: 10.1016/j.jmrt.2020.09.056 [15] Cheng Z, Zhu G, Zhao Y. Study in reduction-roast leaching manganese from low-grade manganese dioxide ores using cornstalk as reductant[J]. Hydrometallurgy, 2009, 96(1-2): 176−179 doi: 10.1016/j.hydromet.2008.08.004 [16] Biswas S, Sharma D. A review on the co-processing of biomass with other fuels sources[J]. International Journal of Green Energy, 2021, 18(8): 793−811 doi: 10.1080/15435075.2021.1880914 [17] Jiang K, Xing R, Luo Z, et al. Pollutant emissions from biomass burning: A review on emission characteristics, environmental impacts, and research perspectives[J]. Particuology, 2024, 85: 296−309 doi: 10.1016/j.partic.2023.07.012 [18] Meng S, Li W, Li Z, et al. Recent progress of the transition metal-based catalysts in the catalytic biomass gasification: A mini-review[J]. Fuel, 2023, 353: 129169 doi: 10.1016/j.fuel.2023.129169 [19] Park S, Song J, Lee W. et al. Advances in biomass-derived electrode materials for energy storage and circular carbon economy[J]. Chemical Engineering Journal, 2023, 470: 144234 doi: 10.1016/j.cej.2023.144234 [20] Ji W, Xie K, Yan S. Separation and recovery of heavy metals zinc and lead from phosphorus flue dust by vacuum metallurgy[J]. Journal of Environmental Management, 2021, 294: 113001 doi: 10.1016/j.jenvman.2021.113001 [21] Lu S, Li J, Chen D, et al. A novel process for silver enrichment from Kaldo smelting slag of copper anode slime by reduction smelting and vacuum metallurgy[J]. Journal of Cleaner Production, 2020, 261: 121214 doi: 10.1016/j.jclepro.2020.121214 [22] Zhang H, Zhu G, Yan H, et al. The mechanism on biomass reduction of low-grade manganese dioxide ore[J]. Metallurgical and Materials Transactions B, 2013, 44(4): 889−896 doi: 10.1007/s11663-013-9835-7 [23] Zhang R, Li X. Kinetics simulation of Zn extraction from dust dried in blast furnace by carbothermic reduction in vacuum[J]. Chinese Journal of Vacuum Science and Technology, 2014, 34(1): 53−57 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: