-
西洋参(Panax quinquefolium L.)作为五加科人参属的名贵中药材,具有养阴生津、安神益智和抗心律失常等多重功效[1]。其核心成分人参皂苷因其增强免疫力、抗癌、抗衰老和抗疲劳等效用而广受消费者欢迎[2-3]。然而,西洋参高含水分、淀粉和糖分,若处理不当易遭虫害、霉菌污染和腐烂,降低药用价值及影响色泽[4]。据报道,每年约1/3西洋参因干燥不当失去商品价值[5]。干燥能有效降低西洋参水分活度,预防虫蛀和霉变,抑制酶活性,阻止皂苷水解和淀粉酶解糖化,从而保存有效成分并延长其货架期[6]。
目前,国内外对西洋参片的干燥技术主要有冷冻干燥[7-8]、热风干燥[9-10]和组合干燥[11-12]等。冷冻干燥法的产品品质好,有效成分损失小,但突出的问题在于:设备投资和运转费用高昂,其干燥时间远超过其他干燥技术,能耗更是普通干燥加工设备的数倍乃至数十倍。相对而言,组合干燥方法能根据物料的特性进行选择,并能够充分发挥各种干燥技术的优势,因而被视为是目前较为先进的一种干燥方法[13]。
综观现有研究成果可知,热风干燥虽加工温度高,易导致酶促与非酶促褐变,但其升温迅速,适用于物料高含水率的干燥前期,迅速去除多余水分。相较之下,真空干燥速率虽较慢,但产品品质更佳,尤适用于干燥后期。在真空环境中,不仅能有效抑制物料生化反应,保留营养成分,提升产品品质,还能防止物料表面结壳硬化导致的干燥速率下降问题[14]。目前,热风干燥技术和真空干燥技术相结合的策略,已成功应用于黄秋葵[15]、哈密瓜[16]、胡萝卜[17]等农产品的加工中,但在西洋参的加工过程中相关报道和研究尚少。因此,本文旨在通过对比冷冻干燥、热风干燥、真空干燥以及热风与真空干燥的组合方法在西洋参片上的应用,深入研究不同干燥方法对西洋参孔隙率、孔隙面积、孔隙直径等孔隙结构参数的影响。此外,本文还检测了西洋参粉和西洋参片的总皂苷含量,并利用压汞法(MIP)和扫描电子显微镜(SEM)技术对西洋参片进行了微观结构和形态观察,以期为西洋参的加工和保存提供理论依据和实践指导。
-
新鲜试验用的4年生西洋参采购于陕西汉中西洋参种植基地,挑选外形完整、无腐烂的西洋参,鲜西洋参的初始含水率约为70%(参考GB5009.3-2016《食品中水分的测定》),将鲜西洋参置于冰箱内冷藏备用;Amberlite-XAD-2大孔树脂、正丁醇、乙醇、高氯酸、冰乙酸、香草醛、中性氧化铝、人参皂苷Re标准溶液(批号 110754-200822),购于国药集团。
-
热风干燥及热风−真空组合干燥的热风阶段采用DHG-9070A电热鼓风干燥箱,真空干燥及热风−真空组合干燥的真空阶段采用DZF-6032真空干燥箱(上海一恒仪器有限公司);真空冷冻干燥采用TF-LFD-1冷冻干燥箱(上海田枫实业有限公司);FA1104N型万分之一型分析天平(上海舜宇恒平科学仪器有限公司);SFY-60红外线快速水分测定仪(上海灿孚机电有限公司);Vega3-SBH扫描电子显微镜(上海泰思肯贸易有限公司);Autopore Ⅳ-9500压汞仪(上海麦克默瑞提克仪器有限公司);总皂苷测定仪器包括UV-1700型紫外分光光度计(上海美析仪器有限公司);KQ-300 VDE超声波清洗器(昆山舒美有限公司),HWS-24型电热恒温水浴锅(上海一恒科学仪器有限公司);ZNC-750中药研磨机(北京中国耐驰技术有限公司)。
-
为排除物料差异对试验结果的影响,选择大小相近的物料进行试验(长约13~15 cm,直径约2~2.5 cm)。将西洋参洗干净并沥干,去芦头和侧根,然后将其切成0.2 cm薄片装入塑封袋中,在4℃冰箱中冷藏一晚(12 h)以均匀水分。经测得,平均初始含水率约为72.0%±0.5%(红外线快速水分测定仪检测得到)。
-
表1为西洋参片干燥试验方案表,每组试验用200 g左右西洋参片,平铺一层于物料盘中,通过表1四种方法干燥。其中,冷冻干燥作为公认的较优干燥方法,作为对照组,代表着较优的干燥效果。为了忽略温度对试验结果的影响,除冷冻干燥外,其余3种方法干燥温度设置为同一数值,根据Ning等[18]的研究,干燥温度为45℃较为恰当。在热风−真空组合干燥试验中,首先运用热风干燥技术,通过加热空气并强化对流效应,迅速脱除物料中的大量自由水分。当物料的湿基含水率降至30%时,随即转入真空干燥阶段,该阶段利用环境压力的降低,促使物料中残留的结合水及难以通过常规手段去除的水分,在减压环境下实现更为彻底的脱除。这种结合最终可减少活性成分的损失,并可提高干燥产品质量[19]。除冷冻干燥外,其余三组试验每隔0.5 h从干燥机中取出脱水样品测定含水率,相关数据用于绘制干燥曲线。当物料的湿基含水率小于等于10%时,停止干燥试验。
-
使用Micromeritics Autopore Ⅳ-9500压汞仪测定孔隙相关参数。进行MIP试验前,先将西洋参片冻干,去除残余水分并保持孔隙结构[20]。最后采用AutoPore Ⅳ 9500 V1.09分析软件对样品孔径分布、孔隙率、累计进汞量、孔隙平均直径、孔面积、分形维数等相关参数进行计算分析。
-
试样制备:称取1.000 g左右的试样,置于100 mL容量瓶中,加少量水,超声30 min,再用水定容至100 mL,摇匀,放置,吸取上清液1.0 mL进行柱层析。
柱层析:用10 mL注射器作层析管,内装3 cm Amberlite-XAD-2大孔树脂,上加1 cm中性氧化铝。先用25 mL70%乙醇洗柱,弃去洗脱液,再用25 mL水洗柱,弃去洗脱液,精确加入1.0 mL试样溶液,25 mL水洗柱,弃去洗脱液,用25 mL70%乙醇洗脱人参皂苷,收集洗脱液于蒸发皿中,置于60℃水浴挥干,以此作显示用。在上述已挥干的蒸发皿中准确加入0.2 mL 5%香草醛冰乙酸溶液,转动蒸发皿,使残渣都溶解,再加0.8 mL高氯酸,混匀后移入5 mL带塞刻度离心管中,60℃水浴上加热10 min,取出冷却后,准确加入冰乙酸5.0 mL,摇匀后,以1 cm比色池于560 nm波长处与标准管一起进行比色测定。吸取人参皂苷Re标准溶液(2.0 mg/mL)100 μl放蒸发皿中,放在水浴挥干(低于60℃)[21]。总皂苷计算公式如下:
式中:x为样品总皂苷量(g/100 g),A1为被测液吸光度,A2为标准液吸光度,C为标准管人参皂苷Re量(μg),V1为试样稀释体积(mL),V2为显示液体积(mL),m为试样质量(g)。
-
用同样的方法分别提取并检测西洋参粉和西洋参片的总皂苷含量,西洋参粉由西洋参片打粉制得,结果显示:无论用何种方法干燥,西洋参粉的总皂苷含量总是高于西洋参片,且不同干燥方法的差异程度不同。由此可知,片状形式相比于粉状形式不利于人参皂苷的溶出,而片与粉的差异在于是否保留了西洋参原有的基质及孔隙结构,进而可推断出,西洋参片的孔隙结构对皂苷的溶出产生了影响。不同的干燥方式会产生不同特点的孔隙结构,对皂苷溶出的影响程度也不一样,为方便表述,定义总皂苷残留率来描述这一影响程度,其计算公式如下:
式中:L为总皂苷残留率,其数值越小,表明产品质量越好。rp为西洋参粉的总皂苷检测值(g/100 g),代表该种样品本身总皂苷的含量,rs为西洋参片的总皂苷检测值(g/100 g),代表片状样品经提取后可被检测到的总皂苷含量,rp与rs之差即为片状样品损失的总皂苷,再除以rp可知损失量的百分比。
-
扫描电子显微图像显示了样品的微观结构特征。在10 kV的加速电压下观察了西洋参片的平面微观结构,得到西洋参切片的孔径。测试前将样品薄片喷金40 s[22]。显微照片是200倍放大倍数下获得的,选择代表性的显微照片代表每个样品。
-
采用SPSS 22.0进行统计学显著性检验(p < 0.05);线性拟合分析使用Origin 2018。
-
表2为不同方法干燥的西洋参的总皂苷检测结果(西洋参片与西洋参粉),其中,用西洋参粉末提取并检测总皂苷是国标操作方法[23],检测结果可视为该方法干燥西洋参的真实总皂苷含量。不难得出,冷冻干燥西洋参的总皂苷含量分别高于热风干燥、真空干燥、热风−真空组合干燥42.46%,34.92%,20.28%,这验证了冷冻干燥工艺出色的营养成分保留能力。其余三种干燥方法中,热风−真空组合干燥的西洋参总皂苷含量高于单纯热风干燥和真空干燥,这与人参皂苷的理化特性和干燥方法特点有关:其一,人参皂苷热稳定性差[24],在干燥条件相同的情况下,干燥时间越短,人参皂苷的保留情况就越好;其二,人参皂苷在真空环境下的保留效果优于有氧环境[25]。热风干燥技术相比于真空干燥可快速除去物料中的水分,提高干燥效率(真空干燥时长240 min,热风干燥时长160 min),但热风干燥在有氧环境下进行,不如真空干燥对人参皂苷的保留有利,因此,在干燥前期采用热风干燥(物料含水率高,快速除去水分),干燥后期采用真空干燥,可相比于单纯采用热风−真空干燥,可以达到更好的人参皂苷保留效果。
此外,西洋参粉末的总皂苷检测结果总是比切片的高。西洋参粉由干燥的西洋参片打磨制得,二者的人参总皂苷含量应该是相同的,但检测结果出现了显著差异,说明西洋参产品的物理形态差异对其总皂苷提取造成了影响。西洋参片具有原有基质结构和干燥产生的孔隙结构[26],而西洋参粉在打磨过程中将这些结构都破坏,由于二者的提取和检测方法均相同,故推断:粉末形式更有利于人参总皂苷的提取,西洋参片的结构或许对皂苷溶出有影响。此外,不同干燥方法导致西洋参片的总皂苷残留率存在差异,这因为西洋参片的结构具有差异[27],其中,真空干燥的损失率最大,冷冻干燥的损失率最小,这种现象将通过MIP的检测结果进行分析。值得注意的是,对于西洋参粉,真空干燥的总皂苷含量比热风干燥的高,但对于西洋参片,二者总皂苷含量不相上下,此现象将在2.2小节解释。
-
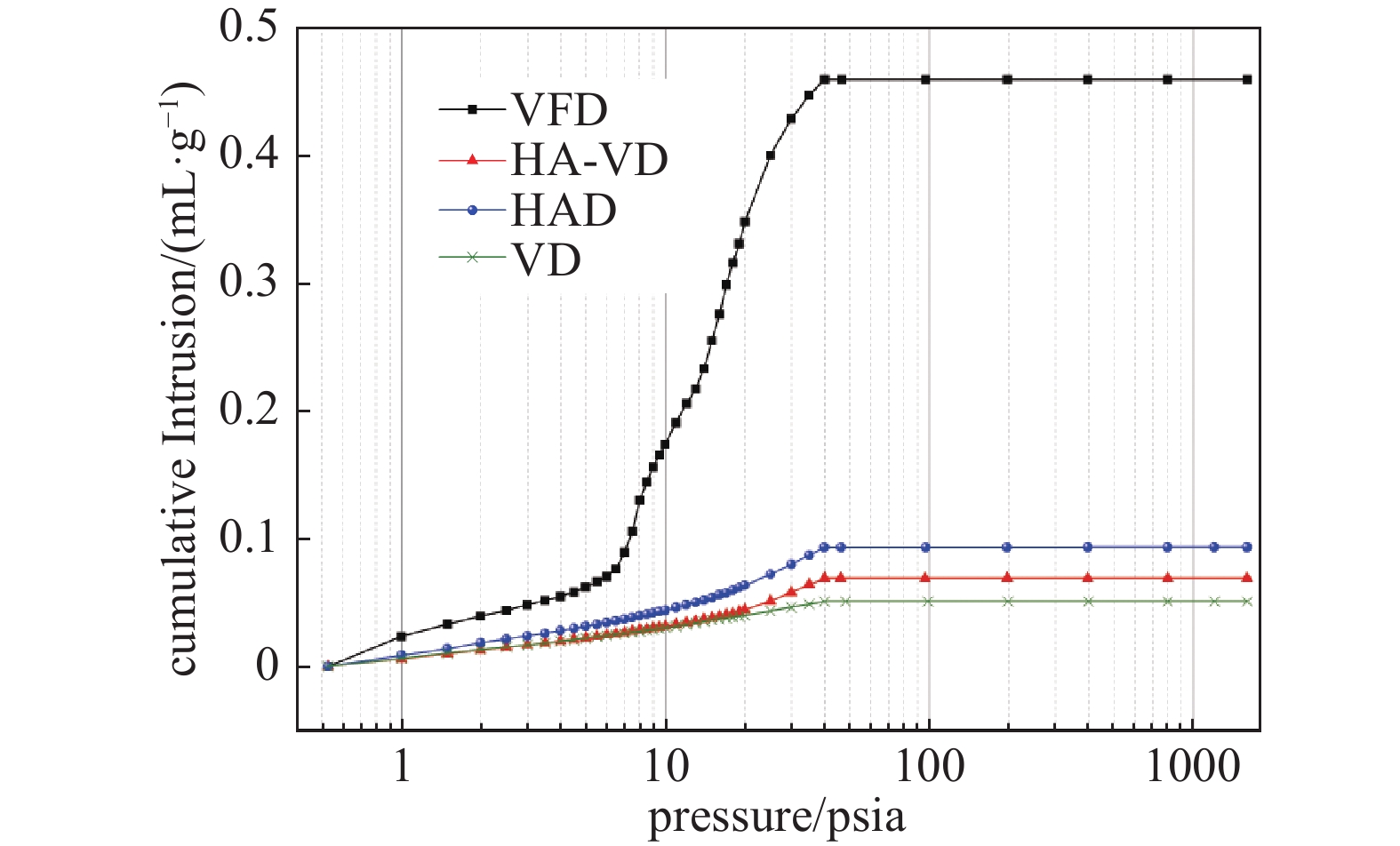
图1为四种干燥技术干制西洋参切片的进汞曲线。根据Wasburn方程可知,注汞压力越大,对应的液态汞进入的孔半径就越小,且每个压力值都对应一个孔径值。由图可得,冷冻干燥西洋参切片的累计进汞量显著大于其他三种方式,进汞曲线的趋势差异也较大。进汞压力在0.5~40 psia时,热风、真空及热风−真空组合干燥的曲线始终呈缓慢上升的状态,而冷冻干燥的曲线在6.5 psia时有一个明显的转折点,转折点之后进汞量急剧上升。压力小于10 psia时,热风−真空组合干燥与真空干燥的进汞曲线几乎重合,说明两种样品的孔径大于18 μm的孔分布相同。压力大于39.97 psia后,冷冻干燥、真空干燥和热风−真空组合干燥样品的进汞曲线均不再变化,说明此时进汞已经达到饱和。而热风干燥样品的进汞曲线在39.97~396.92 psia之间依然缓慢增长,说明热风干燥会导致样品产生更小的孔隙。陈三强等[28]指出当进汞压力小于1167.32 psia时,不考虑压汞造成的结构破坏。本试验的最大进汞压力小于此值,因此测量结果有效。
根据孔隙率的检测结果,冷冻干燥、热风干燥、热风−真空干燥、真空干燥的孔隙率分别为34.9%、10.4%、8.4%、6.3%。整体而言,较高的孔隙率对应着较低的人参总皂苷残留率,丰富的多孔结构有利于物质的溶出与传输[29]。真空干燥片状样品的孔隙率较低,影响了人参皂苷的提取,因此,即便其本身总皂苷含量高于热风干燥样品,但经过提取后能检测到的含量却与热风相近,甚至更低。值得注意的是,孔隙率只是衡量多孔结构的参数之一,不能完全解释样品皂苷残留率与孔结构之间的关系,热风−真空组合干燥的损失率比热风干燥小,但孔隙率却比热风干燥低,此现象在2.3中解释。
-
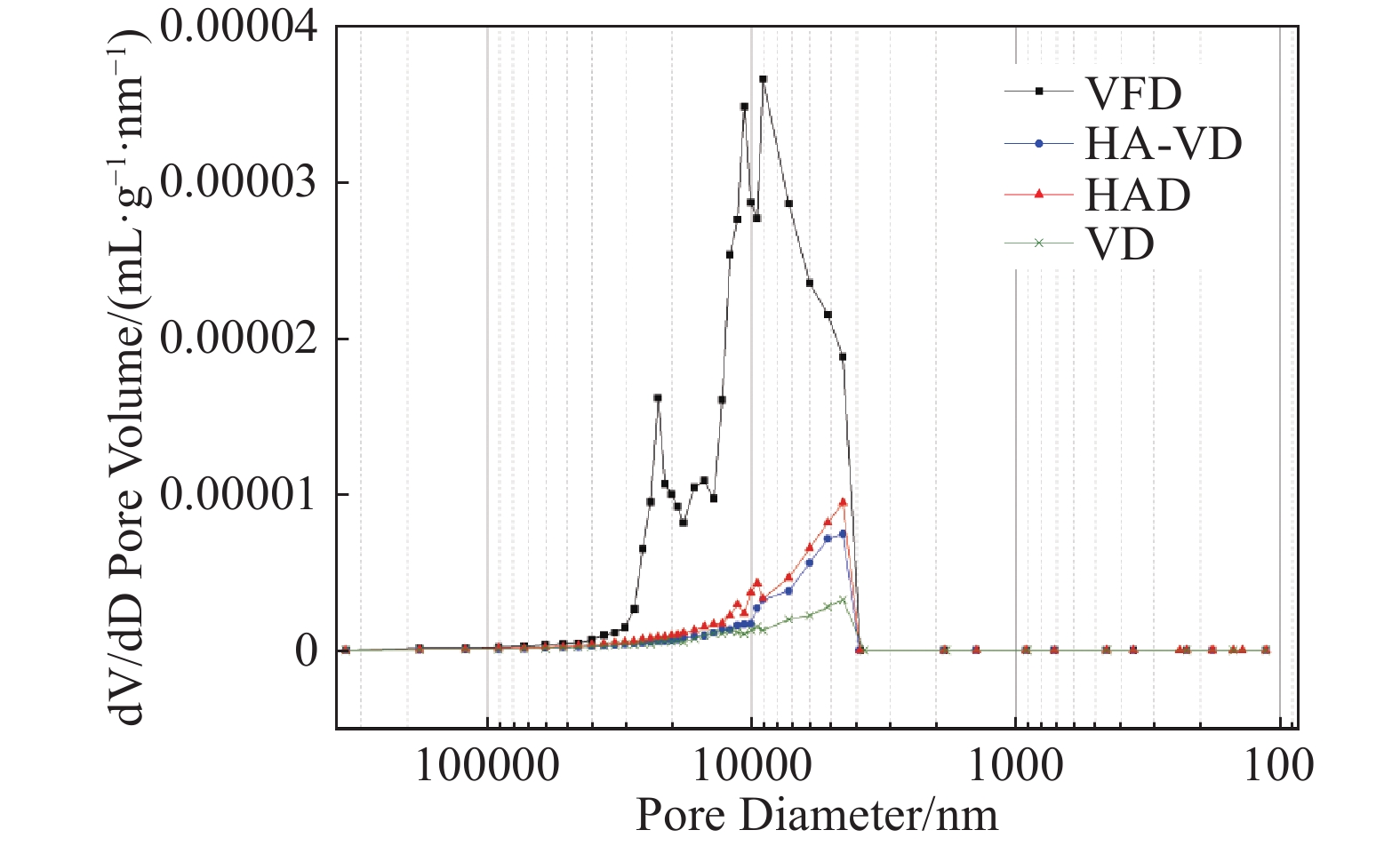
图2为四种技术干燥西洋参片的孔隙体积变化率曲线,样品的孔径范围为452~19082 nm。冷冻干燥样品的孔隙体积变化率曲线有4个较为明显的峰值,最大峰值对应的孔径范围为9.1~9.5 μm,说明此范围内的孔体积占比最大、数量最多,其他三个峰值分别出现在10.7~11.3 μm, 15.1~16.5 μm和22.7~24.2 μm。热风干燥样品的孔隙体积变化率曲线具有三个峰值,其最大峰值对应的孔径为4.5~5.2 μm,这与热风−真空组合干燥和真空干燥的最大峰值相同。
由表3可知,热风−真空组合干燥样品的孔隙中,小孔占比最高,平均孔径最小,总孔隙面积大于热风干燥。较大的孔隙面积有助于西洋参基质与提取液充分接触,有利于人参皂苷的溶出,这就是热风−真空组合干燥样品的孔隙率小于热风干燥,但人参皂苷残留率却小于热风干燥的原因。真空干燥的样品大孔所占比相对于其他三种样品最大,平均孔径最大,且总孔隙面积最小,这导致真空干燥样品的人参皂苷残留率最大。综上所述,孔隙面积比孔隙率的影响更大。
分形维数是描述多孔介质的一个重要特征参数[30],分形维数越接近3,样品的孔道分布越混乱无规律,孔壁越凹凸不平;分形维数越趋于2,孔道结构越单一,孔壁越光滑[31]。由表3可得,热风干燥、真空干燥、热风−真空组合干燥和冷冻干燥的分形维数分别为2.71、2.81、2.68、2.67,说明组合干燥样品的孔隙复杂程度和孔隙表面情况与冷冻干燥接近,真空干燥样品的分形维数最大,说明其孔壁粗糙,结构复杂。
-
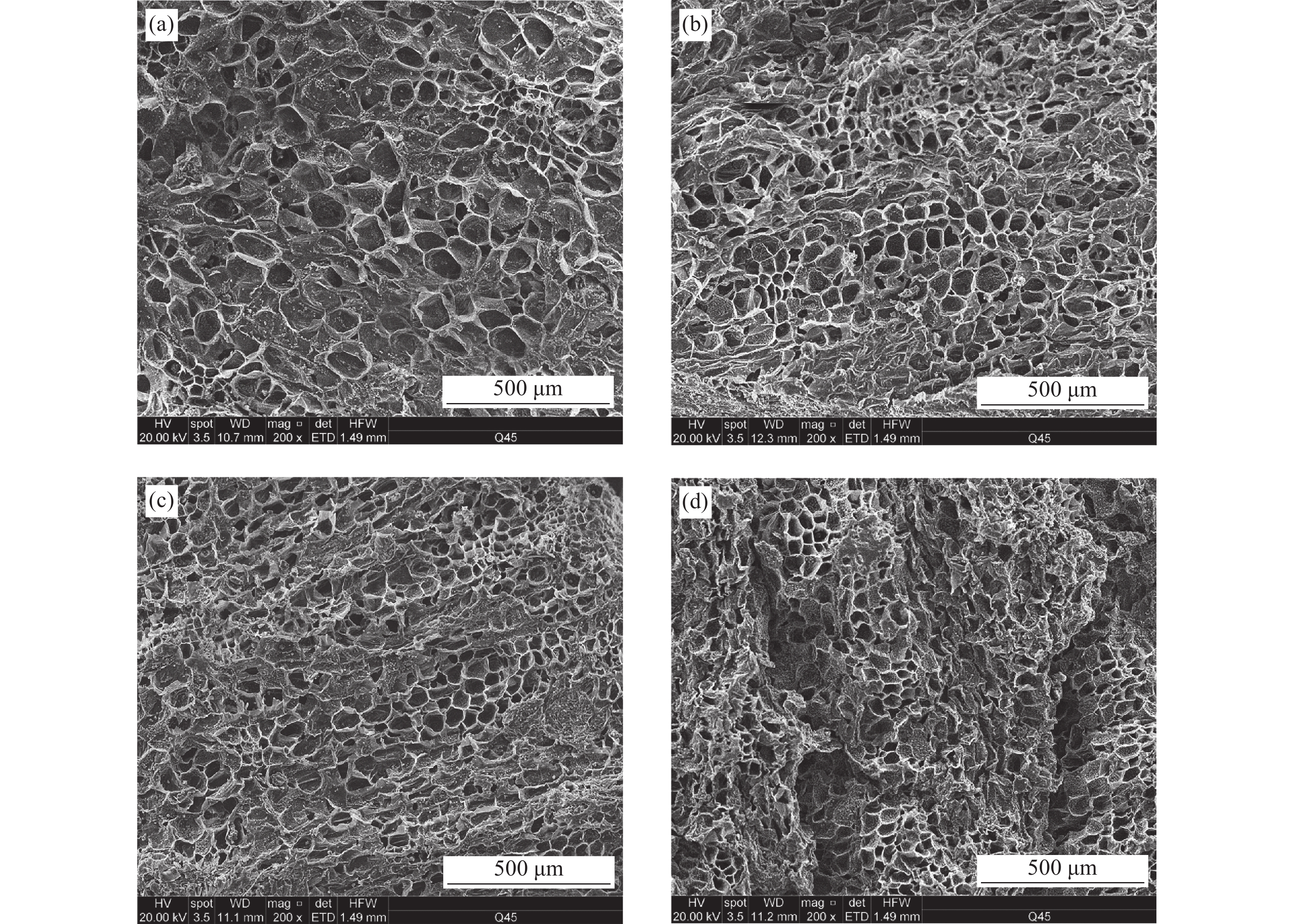
图3为四种样品的SEM图片,细胞壁及胞间孔隙清晰可见,呈蜂窝状分布。冷冻干的西洋参片孔隙分布较均匀,大部分孔在10~100 μm范围内,由于冷冻时形成冰晶,细胞大都为椭圆形。热风−真空组合干燥的西洋参片孔隙大小不一,部分区域出现了细胞壁塌陷的情况。热风干燥的西洋参片孔隙分布与组合干燥分布类似,细胞壁出现褶皱卷曲的情况。真空干燥的西洋参片细胞收缩明显,但较好的保留了细胞的多边形形状,由于收缩变形严重,样品表面出现了卷曲造成的沟壑,照片左半部分的区域还出现了明显的基质塌陷。整体而言,样品SEM图片展示出的情况与MIP检测结果相符。
-
本文通过四种方法干燥了西洋参片,检测了西洋参粉与西洋参片的总皂苷含量,并对西洋参片进行了MIP和SEM检测,得到的结论如下:
(1)对比4种方法干燥的样品,西洋参粉的总皂苷检测结果总是高于西洋参片,由于提取与检测方法相同,二者总皂苷含量本应相同,但检测结果出现差异,说明西洋参片所保留的原有基质与孔隙结构对人参皂苷的溶出产生了影响。将这种影响程度定义为总皂苷残留率L,L值越大,说明孔隙结构对人参皂苷溶出的影响越大。
(2)不同干燥方法会形成不同的孔隙结构,孔隙率的大小排序为:冷冻干燥>热风干燥>热风−真空组合干燥>真空干燥,与SEM图像的观察结果相符;孔隙面积的大小排序为:冷冻干燥>热风−真空组合干燥>热风干燥>真空干燥;样品的孔径范围为452~19082 nm;组合干燥样品的表面分形维数与冷冻干燥接近,真空干燥样品的分形维数最大,说明其孔壁粗糙,结构复杂。
(3)人参总皂苷残留率的排序为:真空干燥>热风干燥>热风−真空组合干燥>冷冻干燥。孔隙率与孔隙面积对总皂苷残留率L都有影响,但孔隙面积的影响更大:虽然热风−真空组合干燥的孔隙率低于热风干燥,但其孔面积大于热风干燥,因此人参皂苷残留率小于热风干燥。
不同干燥技术对西洋参片孔隙结构及人参皂苷溶出的影响
Effects of Different Drying Techniques on the Pore Structure and Ginsenoside Solubilization of American Ginseng Slices
-
摘要: 探索不同干燥方式对西洋参片的微观结构特性,及孔隙结构对人参皂苷溶出的影响机制。采用冷冻干燥作为对照组,比较热风、真空及热风−真空组合干燥方式下人参皂苷的溶出量。同时,运用压汞法(MIP)和扫描电子显微镜(SEM)进行微观检测。结果显示,相比于单一的干燥方式,热风−真空组合干燥方式下总皂苷残留率最小(42.19%),而热风干燥方式下孔隙率最大(10.4%),但热风−真空组合干燥总孔隙面积大于热风干燥,这表明虽然孔隙率与孔隙面积都对总皂苷残留率有一定影响,但孔隙面积的影响更为显著。因此,除冷冻干燥外,热风−真空组合干燥更适用于西洋参干燥,能有效提高西洋参皂苷溶出率。Abstract: This study examines the microstructural properties of Radix et Rhizoma Ginseng slices obtained through different drying methods and investigates how pore structure affects ginsenoside dissolution. Freeze drying was used as the control group to compare the dissolution of ginsenosides under hot air, vacuum, and hot air vacuum combined drying methods. Microscopic examinations were performed using mercuric intrusion porosimetry (MIP) and scanning electron microscopy (SEM). The results revealed that, compared to single drying methods, the saponin residue rate was lowest (42.19%) with the hot air-vacuum combination method. Although porosity was highest (10.4%) with the hot air method, the total pore area was greater with the hot air-vacuum combination. This indicates that while both porosity and pore area affect ginsenoside residue rates, pore area has a more significant impact. Therefore, in addition to freeze drying, hot air-vacuum combined drying is more effective for American ginseng, significantly enhancing ginsenoside dissolution rates.
-

-
表 1 西洋参片干燥试验方案
Table 1. Experimental plan of drying American ginseng slices
试验名称 工艺参数 热风干燥(HAD) 热风温度45℃,风速1.5 m/s 真空干燥(VD) 真空温度45℃,压力10 kPa 热风−真空组合干燥(HA-VD) 热风、真空温度45℃,压力10 kPa,转换点湿基含水率30% 真空冷冻干燥(VFD) −30℃预冻3 h—-15℃解析干燥8 h—30℃升华干燥5 h(冷阱温度−50℃,真空度1 Pa) 表 2 不同方法干燥的西洋参总皂苷含量及损失率
Table 2. Total ginsenosides content and L value of American ginseng dried by various methods
干燥方法 总皂苷含量/ (g/100 g) 总皂苷残留率 /% 西洋参粉 西洋参片 热风干燥(HAD) 1.79±0.03a 0.86±0.03a 48.81% 真空干燥(VD) 1.89±0.02b 0.85±0.02a 52.5% 热风−真空组合干燥(HA-VD) 2.12±0.00c 1.11±0.01b 42.19% 真空冷冻干燥(VFD) 2.55+0.05d 1.44±0.02c 32.87% 表 3 不同方法干燥西洋参片的孔隙特征参数及孔径分布
Table 3. Pore characteristic parameters and pore distribution of ASG by various drying methods
干燥方法 平均孔径/nm 总孔隙面积/ (m2/g) 孔径分布/% 分形维数 >100 μm 10~100 μm 0~10 μm 热风干燥(HAD) 12702.3 0.029 14.71 49.30 35.99 2.71 真空干燥(VD) 16647.3 0.012 20.70 55.16 24.14 2.81 热风−真空组合干燥(HA-VD) 11721.2 0.035 14.41 45.48 40.11 2.68 真空冷冻干燥(VFD) 12597.5 0.146 7.23 61.55 31.22 2.67 -
[1] 钟运香, 袁娇, 刘丰惠, 等. 西洋参化学成分, 药理作用及质量控制研究进展[J]. 中国中医药现代远程教育, 2020, 18(7): 130−133 (in Chinese) Zhong Y X, Yuan J, Liu F H, et al. Research progress on chemical constituents, pharmacological effects and quality control of Panax quinquefolius[J]. China Journal of Traditional Chinese Medicine and Modern Distance Education, 2020, 18(7): 130−133 [2] 巨浩羽, 赵士豪, 赵海燕, 等. 干燥介质相对湿度对西洋参根干燥特性和品质的影响[J]. 中草药, 2020, 51(3): 631−638 (in Chinese) doi: 10.7501/j.issn.0253-2670.2020.03.012 Ju H Y, Zhao S H, Zhao H Y, et al. Effects of relative humidity of drying medium on drying characteristics and quality of Panax quinquefolius roots[J]. Chinese Herbal Medicines, 2020, 51(3): 631−638 doi: 10.7501/j.issn.0253-2670.2020.03.012 [3] Pu J Y, Ramadhania Z M, Mathiyalagan R, et al. Ginsenosides conversion and anti-oxidant activities in puffed cultured roots of mountain ginseng[J]. Processes, 2021, 9(12): 2271 doi: 10.3390/pr9122271 [4] 李家磊, 卢淑雯, 任传英, 等. 西洋参贮藏保鲜技术的研究进展[J]. 中国食物与营养, 2015, 21(11): 27−31(in Chinese) doi: 10.3969/j.issn.1006-9577.2015.11.007 Li J L, Lu S W, Ren C Y, et al. Research progress on storage and preservation technology of Panax quinquefolius[J]. Food and Nutrition in China, 2015, 21(11): 27−31 doi: 10.3969/j.issn.1006-9577.2015.11.007 [5] 赵明安. 西洋参加工技术[J]. 农村新技术, 2011(18): 41−42 (in Chinese) doi: 10.3969/j.issn.1002-3542.2011.18.040 Zhao M A. Processing technology of panax quinquefolius[J]. New Rural Technology, 2011(18): 41−42 doi: 10.3969/j.issn.1002-3542.2011.18.040 [6] Wang D, Ma M, Zhao Z, et al. American ginseng slice drying and optimization: Effect of different drying methods on drying kinetics and physicochemical properties[J]. Processes, 2024, 12(6): 1226 doi: 10.3390/pr12061226 [7] 陆国胜. 西洋参真空冷冻干燥工艺研究[J]. 食品研究与开发, 2018, 39(14): 115−119 (in Chinese) doi: 10.3969/j.issn.1005-6521.2018.14.020 Lu G S. Study on vacuum freeze-drying technology of panax quinquefolius[J]. Food Research and Development, 2018, 39(14): 115−119 doi: 10.3969/j.issn.1005-6521.2018.14.020 [8] 王丽艳, 郭树国, 于海业. 人参真空冷冻干燥时间的试验研究[J]. 食品工业, 2013(8): 101−103 (in Chinese) Wang L Y, Guo S G, Yu H Y. Experimental study on vacuum freeze-drying time of panax ginseng[J]. Food Industry, 2013(8): 101−103 [9] Li M, Chen Y, Wang X, et al. Determination of drying kinetics and quality changes of Panax quinquefolium L. dried in hot-blast air[J]. LWT, 2019, 116: 108563 doi: 10.1016/j.lwt.2019.108563 [10] 吴小华, 马渊博, 宁旭丹, 等. 西洋参分段式热风干燥动力学模型构建[J]. 农业工程学报, 2020, 36(05): 318−324 (in Chinese) Wu X H, Ma Y B, Ning X D, et al. Construction of a segmented hot-air drying dynamics model for panax quinquefolius[J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(05): 318−324 [11] Ning X, Feng Y, Gong Y, et al. Drying features of microwave and far-infrared combination drying on white ginseng slices[J]. Food science and biotechnology, 2019, 28: 1065−1072 doi: 10.1007/s10068-018-00541-0 [12] Pei Y, Li Z, Song C, et al. Effects of combined infrared and hot‐air drying on ginsenosides and sensory properties of ginseng root slices (Panax ginseng Meyer)[J]. Journal of Food Processing and Preservation, 2020, 44(1): e14312 [13] 张慜, 徐艳阳, 孙金才. 国内外果蔬联合干燥技术的研究进展[J]. 无锡轻工大学学报: 食品与生物技术, 2013, 22(6): 103−106 (in Chinese) Zhang M, Xu Y Y, Sun J C. Research progress on combined drying technologies for fruits and vegetables at home and abroad[J]. Journal of Wuxi University of Light Industry: Food and Biotechnology, 2013, 22(6): 103−106 [14] 袁越锦, 赵哲, 曹博涛, 等. 响应面法优化西芹热风真空组合干燥工艺[J]. 真空科学与技术学报, 2014, 34(04): 313−319 (in Chinese) Yuan Y J, Zhao Z, Cao B T, et al. Optimization of hot-air and vacuum combined drying process for celery using response surface methodology[J]. Chinese Journal of Vacuum Science and Technology, 2014, 34(04): 313−319 [15] 段续, 刘文超, 任广跃. 热风干燥联合真空降温缓苏提升黄秋葵干制品品质[J]. 农业工程学报, 2016, 32(18): 263−270 (in Chinese) Duan X, Liu W C, Ren G Y. Quality improvement of dried Abelmoschus esculentus through hot-air drying combined with vacuum cooling and tempering[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(18): 263−270 [16] 赵泽颖, 袁越锦, 王栋, 等. 多指标试验公式法优化哈密瓜片真空热风干燥工艺[J]. 食品与发酵工业, 2020, 46(15): 140−146 (in Chinese) Zhao Z Y, Yuan Y J, Wang D, et al. Optimization of vacuum and hot-air combined drying process for hami melon slices using a multi-index experimental formula method[J]. Food and Fermentation Industries, 2020, 46(15): 140−146 [17] 袁越锦, 洪晨, 徐英英, 等. 组合干燥方式下胡萝卜真空脉动蒸汽烫漂工艺优化[J]. 浙江农业学报, 2022, 34(1): 163−172 (in Chinese) doi: 10.3969/j.issn.1004-1524.2022.01.19 Yuan Y J, Hong C, Xu Y Y, et al. Optimization of vacuum pulse steam blanching process for carrots under combined drying methods[J]. Acta Agriculturae Zhejiangensis, 2022, 34(1): 163−172 doi: 10.3969/j.issn.1004-1524.2022.01.19 [18] Ning X F, Han C. Suitable drying model for far infrared drying of taegeuk ginseng[J]. Food Science and Biotechnology, 2012, 21(4): 1087−1094 doi: 10.1007/s10068-012-0141-y [19] 牛静怡, 袁越锦, 李颖, 等. 基于层次分析法的红枣切片热风真空及组合干燥试验与品质评价[J]. 真空科学与技术学报, 2024, 44(10): 892−900 (in Chinese) Niu J Y, Yuan Y J, Li Y, et al. Experiment and quality evaluation of hot air-vacuum and combined drying of red date slices based on analytic hierarchy process[J]. Journal of Vacuum Science and Technology, 2024, 44(10): 892−900 [20] 李文采, 田寒友, 白京, 等. 采用压汞法研究不同冷冻羊肉冰晶结构特征[J]. 农业工程学报, 2019, 35(20): 280−287 (in Chinese) doi: 10.11975/j.issn.1002-6819.2019.20.034 Li W C, Tian H Y, Bai J, et al. Study on the ice crystal structure characteristics of different frozen mutton by mercury injection method[J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(20): 280−287 doi: 10.11975/j.issn.1002-6819.2019.20.034 [21] 姜志辉, 姜丽萍, 高晖富, 等. 不同方法测定红参中人参皂苷含量的比较研究[J]. 人参研究, 2017, 29(3): 6−10 (in Chinese) Jiang Z H, Jiang L P, Gao H F, et al. Comparative study on the determination of ginsenoside content in red ginseng by different methods[J]. Ginseng Research, 2017, 29(3): 6−10 [22] An F, Qiu D, Song H, et al. Effects of instant pressure drop puffing with super‐heated vapor on the physical properties of granny smith apple chips[J]. Journal of Food Process Engineering, 2015, 38(2): 174−182 doi: 10.1111/jfpe.12157 [23] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015: 131 (in Chinese) National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science Press, 2015: 131 [24] 林龙飞, 杨培, 闫磊, 等. 人参茎叶水提液中人参皂苷热稳定性研究及其有效期推算[J]. 中国实验方剂学杂志, 2012, 18(24): 137−141 (in Chinese) Lin L F, Yang P, Yan L, et al. Study on the thermal stability of ginsenosides in the aqueous extract of ginseng stem and leaf and estimation of its shelf life[J]. Chinese Journal of Experimental Traditional Medical Formulas, 2012, 18(24): 137−141 [25] 周国燕, 王春霞, 胡晓亮, 等. 干燥方法对三七切片有效成分和感官特性的影响[J]. 食品科学, 2011, 32(22): 1−5 (in Chinese) Zhou G Y, Wang C X, Hu X L, et al. Effects of drying methods on active ingredients and sensory properties of notoginseng slices[J]. Food Science, 2011, 32(22): 1−5 [26] Rahman M M, Joardder M U H, Karim A. Non-destructive investigation of cellular level moisture distribution and morphological changes during drying of a plant-based food material[J]. Biosystems Engineering, 2018, 159: 126−138 [27] Koc B, Eren I, Ertekin F K. Modelling bulk density, porosity and shrinkage of quince during drying: The effect of drying method[J]. Journal of Food Engineering, 2008, 85(3): 340−349 doi: 10.1016/j.jfoodeng.2007.07.030 [28] 陈三强, 刘永忠, 程光旭, 等. 用压汞法计算冻干物料的表面分形维数[J]. 食品科学, 2004(7): 25−28 (in Chinese) doi: 10.3321/j.issn:1002-6630.2004.07.001 Chen S Q, Liu Y Z, Cheng G X, et al. Calculation of surface fractal dimension of freeze-dried materials by mercury intrusion porosimetry[J]. Food Science, 2004(7): 25−28 doi: 10.3321/j.issn:1002-6630.2004.07.001 [29] Purnama M, Yaghmaee P, Durance T D, et al. Porosity changes and retention of ginsenosides in North American ginseng root using different dehydration processes[J]. Journal of food science, 2010, 75(7): E487−E492 [30] Xu P, Jia X, Zhang Z, et al. Research on boiling heat transfer of aqueous extracts vacuum drying based on fractal theory[J]. Drying Technology, 2024: 1−13 [31] Xu Z, Pillai K M. Influence of pore-network microstructure on the isothermal-drying performance of porous media[J]. Drying Technology, 2022, 40(4): 767−780 doi: 10.1080/07373937.2021.2012786 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: