-
长期以来, 人们普遍认为金(Au)的催化活性远低于其他过渡金属. 宏观尺度的金由于其独特的电子结构和化学性质, 在常温常压下表现出极高的化学稳定性, 几乎不与大多数化学物质发生反应. 因此, 它并未被视为适用于催化氧化或氢化反应的理想材料. 然而, Haruta等[1]的研究改变了这一传统认知, 他们通过适当的制备方法和载体选择, 将金以高度分散的纳米颗粒形式负载于载体上, 如TiO2[2], SiO2[3], Fe2O3[4], Al2O3[5]等氧化物载体, 特别当这些金纳米颗粒负载于CeO2上时, Au/CeO2复合催化剂在多种重要反应中都展现出高效的催化性能, 例如CO氧化[6,7]和水气转换(WGS)[8]. Li等[6]的研究表明, Au/CeO2催化剂在低温下具有优异的活性, CeO2的氧空位不仅有助于氧分子的吸附和活化, 还可以与金颗粒发生协同作用来提高催化性能. Thompson等[8]通过不同负载量的Au/CeO2催化剂来探究其活性差异. 他们发现刻蚀前催化剂的反应速率明显高于刻蚀后的, 且TOF值也显著高于刻蚀后的. 最终得出金纳米颗粒在水气转换反应中的重要性.
随着对金催化活性及其背后机制的深入研究, Au/CeO2(111)界面上的相互作用成为了研究重点. 在理论计算方面, Chen等[9]利用密度泛函理论(DFT)研究了单个Au原子在CeO2(111)表面不同位置(如铈空位、氧空位及清洁表面)的稳定性, 提出了其稳定性的明确顺序, 由于氧空位留下了额外电子, Au原子与氧空位点的结合更稳定. Hernández等[10]通过 DFT计算揭示了单个Au原子在氧-氧桥位和氧顶位的吸附过程, CeO2表面的Ce4+还原为Ce3+, Au原子则发生部分电荷转移, 形成带正电的Au+. Zhang等[11]的研究则扩展了视野, 不仅探讨了单个金原子的吸附行为, 还关注了金团簇与CeO2(111)表面电荷转移现象, 发现与CeO2表面直接接触的金显示出正电荷. Engel等[12]对Au3吸附在MgO(001), C(0001)和CeO2(111)表面进行的研究也表明Au3团簇在CeO2(111)表面表现出稳定的三维结构和正电荷. Shu等[13]和Teng等[14]研究了部分还原的CeO2(111)表面上Aux (x = 1—10)团簇的结构, 表明CeO2(111)上的半球形Aux相比于大型金属团簇更稳定, 其电荷再分布增强了Aux团簇和CeO2表面之间的相互作用.
在实验研究方面, 关于负载型催化剂中金的氧化态仍然存在争论. Lu等[15]利用扫描隧道显微镜(STM)观察到金原子优先在点缺陷上吸附, 并从CeO2获得电子, 进而导致金原子带负电. 然而, Lustemberg等[16]的研究则通过STM观察发现单个金原子能稳定吸附于CeO2(111)表面非氧空位位置, 且Au与CeO2表面发生了电荷转移, 导致Au失去部分电子并带上正电荷. Fu等[17]基于X射线光电子能谱数据, 提出了金纳米颗粒不直接参与WGS反应, 而是金离子在起作用. 而Bezkrovnyi等[18]通过将X光电子能谱(XPS), 同步辐射光电子能谱 (SRPES)与DFT计算相结合, 探索CO吸附下Au与CeO2之间的相互作用. 研究发现, CeO2(111)表面与O原子接触的Au原子被氧化为Au+, 而其余Au原子保持中性. Tibiletti等[19]则报道, 在Au吸附CeO2表面上时, X射线吸收近边结构 (XANES)只能检测到金属金.
尽管对金的催化活性及其与CeO2(111)界面的相互作用已有不少研究, 但仍存在一些未触及的领域和误区. 当前研究主要集中于Au原子在CeO2(111)表面的吸附行为及电荷转移机制, 但对特定位置(如清洁表面、台阶等)单个Au原子[20]的吸附稳定性及电荷状态影响的理解仍然不足. 此外, 虽然已有研究揭示了Au原子在CeO2表面不同位点的稳定性排序及团簇与表面的相互作用, 但对于电荷转移及其对催化性能的影响仍然缺乏系统性地分析. 本研究旨在通过DFT, 结合Hubbard U校正以提升CeO2(111)表面及台阶模型计算的准确性, 突破只关注平面吸附的局限性, 探究Au原子在CeO2(111)表面及其复杂台阶结构上的吸附行为. 合理定义吸附能计算公式, 评估了Au原子在不同位点上的吸附稳定性. 进一步地, 利用差分电荷密度分析、Bader电荷分析及态密度计算等手段, 深入剖析Au原子吸附过程中涉及的电荷转移机制及电子结构变化, 为理解Au/CeO2(111)催化体系的活性起源提供新的视角.
-
本研究深入剖析了Au/CeO2(111)体系, 运用DFT的第一性原理, 结合Quantum Espresso软件包进行分析. 在模拟过程中, 采用了Perdew-Burke-Ernzerhof版本的广义梯度近似(GGA-PBE)作为交换关联泛函[21], 以捕捉电子间的复杂相互作用. 在模拟设置中, 选择了投影增强波(PAW)方法[21]来处理核价相互作用. 对于价电子态的展开, 采用了平面波基集, 并设置了36 Ry的截断能.
为了进一步准确描述CeO2中Ce-4f的局域特性, 引入了Hubbard U校正. 采用线性响应方法[22]计算CeO2参数U的值, 这一方法通过向单个原子施加一个外加的有效库仑和交换相互作用项, 使得Ce-4f轨道电荷密度(占据数)重新分配, 计算了Ce-4f轨道电荷占据数对外加的有效库仑和交换相互作用项的一阶偏导(线性响应系数)大小, 从而确定该体系中的U值大小.
通过计算得到U值为
其中,
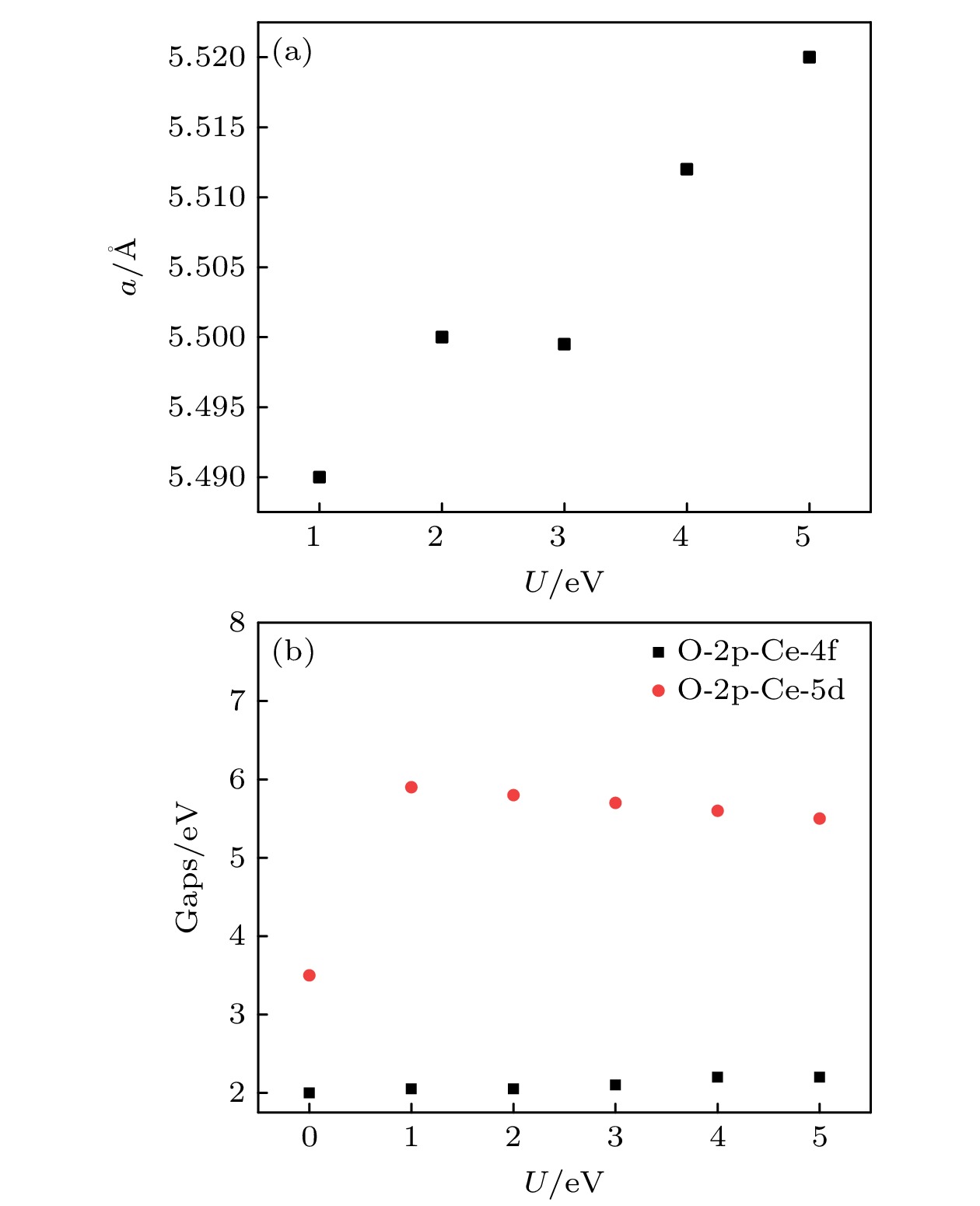
$X_{{\text{SCF}}}^{ - {1}}$ 和$X_{{\text{NSCF}}}^{ - 1}$ 分别为自洽和非自治计算得到的线性响应系数,$ \partial {N^{{\text{SCF/NSCF}}}} $ 为自恰和非自恰计算加U的Ce-4f轨道电荷占据数的变化量,$\partial V$ 为外加的有效库仑、交换相互作用项的变化量. 因此设置U值为5 eV[23].为了验证U值的准确性, 分析了不同U值对CeO2几何结构和电子结构的影响. 如图1(a)所示, 使用DFT+U得到的CeO2晶格常数与实验值相比相差较大(5.41 Å), 这源于GGA方法的本质特征, 在U = 0时, 晶格常数已经大于实验值, 并且随着U值的增大, 晶格常数基本呈线性增长, 但在0—5 eV内, 变化幅度较小(小于0.04 Å). 图1(b)展示了CeO2带隙随U值的变化规律. 当U = 0时, DFT+U回归为DFT方法, 此时O-2p—Ce-5d的带隙为3.5 eV, O-2p—Ce-4f的带隙为2 eV. 随着U值的增大, O-2p到Ce-4f的带隙逐渐增大, 在U = 4—5 eV时达到最大值2.2 eV. 同时, O-2p—Ce-5d的带隙在加U之后也明显增大, U = 1 eV时, 增大为5.9 eV, 然而, 随着U值的继续增大, 该带隙逐渐减小. 从U = 1—5 eV, 此带隙由5.9 eV 降低到5.5 eV. 尽管这两个带隙都比实验值小, 但是在U = 5 eV时得到最优值: 2.2和5.5 eV. 此外, CeO2的带隙等电子结构特征随U值的变化不明显. 因此, 本文所取的U = 5 eV对本文的定性结论不影响.
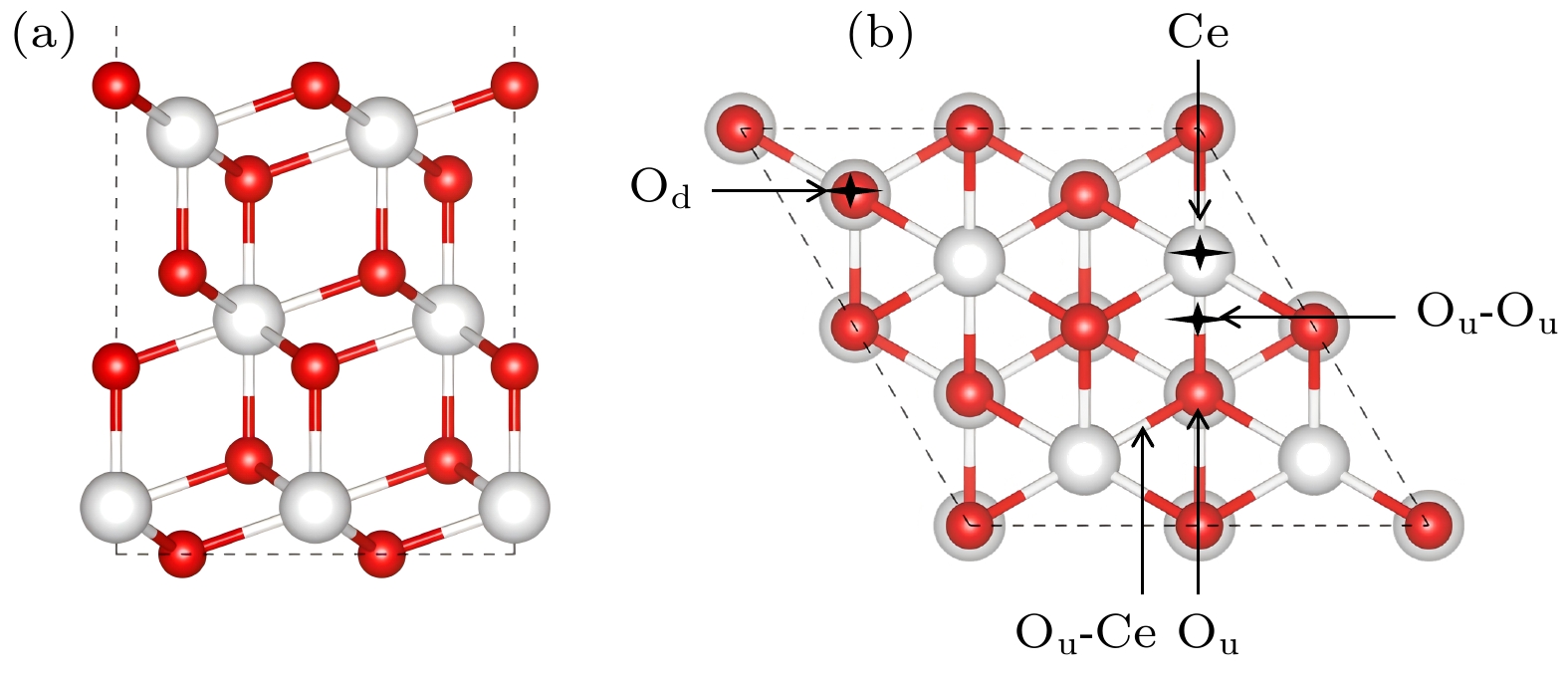
在构建模型的过程中, 采用了基于CeO2表面的周期性层板模型, 旨在精确模拟CeO2 (111)上所呈现的平面区域和4种典型台阶结构 (见图1和图4). 平面模型包含3个O-Ce-O层 (9个原子层), 其中底层 (1个O-Ce-O层)保持固定, 在计算过程中其他两层允许自然弛豫. 为了彻底消除模拟中可能存在的相邻层板间不必要的相互作用, 我们在模型垂直方向上设置了高达15 Å的真空层. 对于CeO2表面的计算, 由于相邻表面板的单元格相对较大, 使用(2×2×1) Monkhorst-Pack网格来平衡计算精度. 对于CeO2(111)表面上的4种台阶结构, 我们同样采用了与平面模型相同的参数设置, 关于4种台阶的详细结构在3.2节中描述.
在本项工作中, 采用了以下公式来计算吸附能:
其中
$ {E_{{\text{Ce}}{{\text{O}}_{2}}}} $ ,$ {E_{{\text{Au}}}} $ 和$ {E_{{\text{Au/Ce}}{{\text{O}}_{2}}}} $ 分别代表清洁CeO2表面、单个Au原子和Au原子吸附在CeO2表面时的总能. -
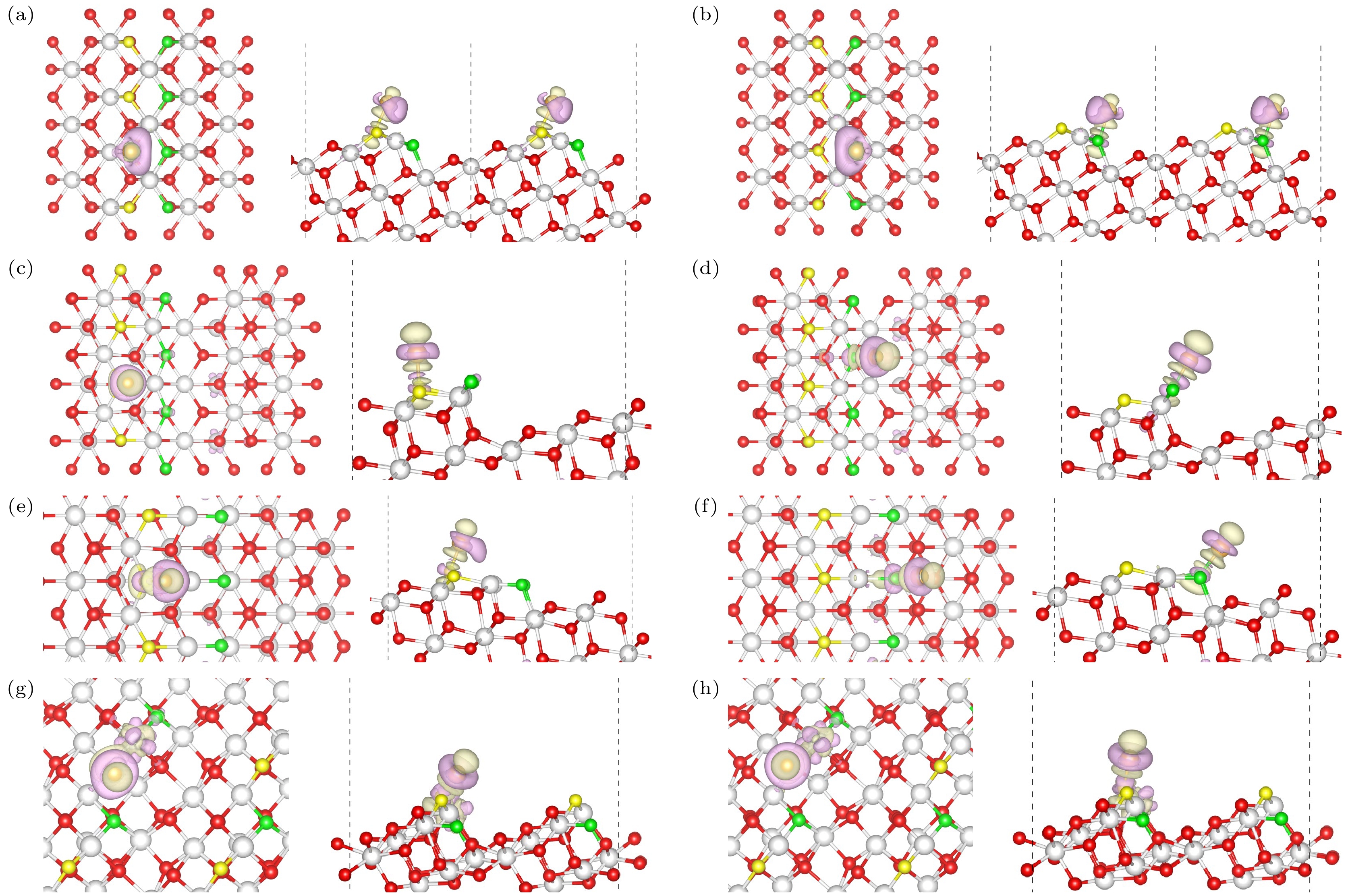
在无对称约束下, 我们搜索了CeO2(111)表面的稳定吸附构型, 不局限于传统的对称位点, 还研究了非对称位置[24,25]. 总共确定了5种独特吸附构型: 铈顶位(Ce), Au原子位于第2层Ce原子上方; 次氧位(Od), Au原子位于第3层O原子的正上方, 并与第1层的3个O原子配位; 顶氧-铈位(Ou–Ce), Au原子位于第2层的Ce原子和第1层的O原子或第3层的O原子之间; 氧顶位(Ou), Au原子位于第1层O氧原子上方; 氧-氧桥位(Ou–Ou): Au原子位于第1层两个O原子之间的桥梁位置, 如图2所示.
在Au/CeO2(111)这一体系中, Au原子的氧化态及其最稳定吸附构型一直是科研探索的热点, 关于Au/CeO2(111)表面最稳定的吸附位点研究一直都有争议[10,26]. 表1汇总了单个Au原子在CeO2(111)表面吸附能及相关键长的实验数据, 结果显示吸附能介于0.39—1.19 eV之间, 且吸附稳定性顺序为: Ou-Ou > Ou > Ou-Ce > Od > Ce, Ou-Ou为Au原子最稳定的吸附位置. 我们计算得出的Au在Ou-Ou上的吸附能为1.19 eV, Au—O键长为2.14 Å, 与Hernández等[10]采用GGA+U方法(U = 5.0 eV)的研究结果一致. 这不仅验证了我们模型的准确性, 也揭示了Ou-Ou位点对Au原子的较强吸引力. Au在Ou-Ou位点的Au—O键长显著缩短至2.14 Å, 而其他位点(如Ce, Od及Ou-Ce)的Au—O键长则较长, 在2.15—3.15 Å之间, 表明Au与Ou-Ou之间存在更紧密的相互 作用.
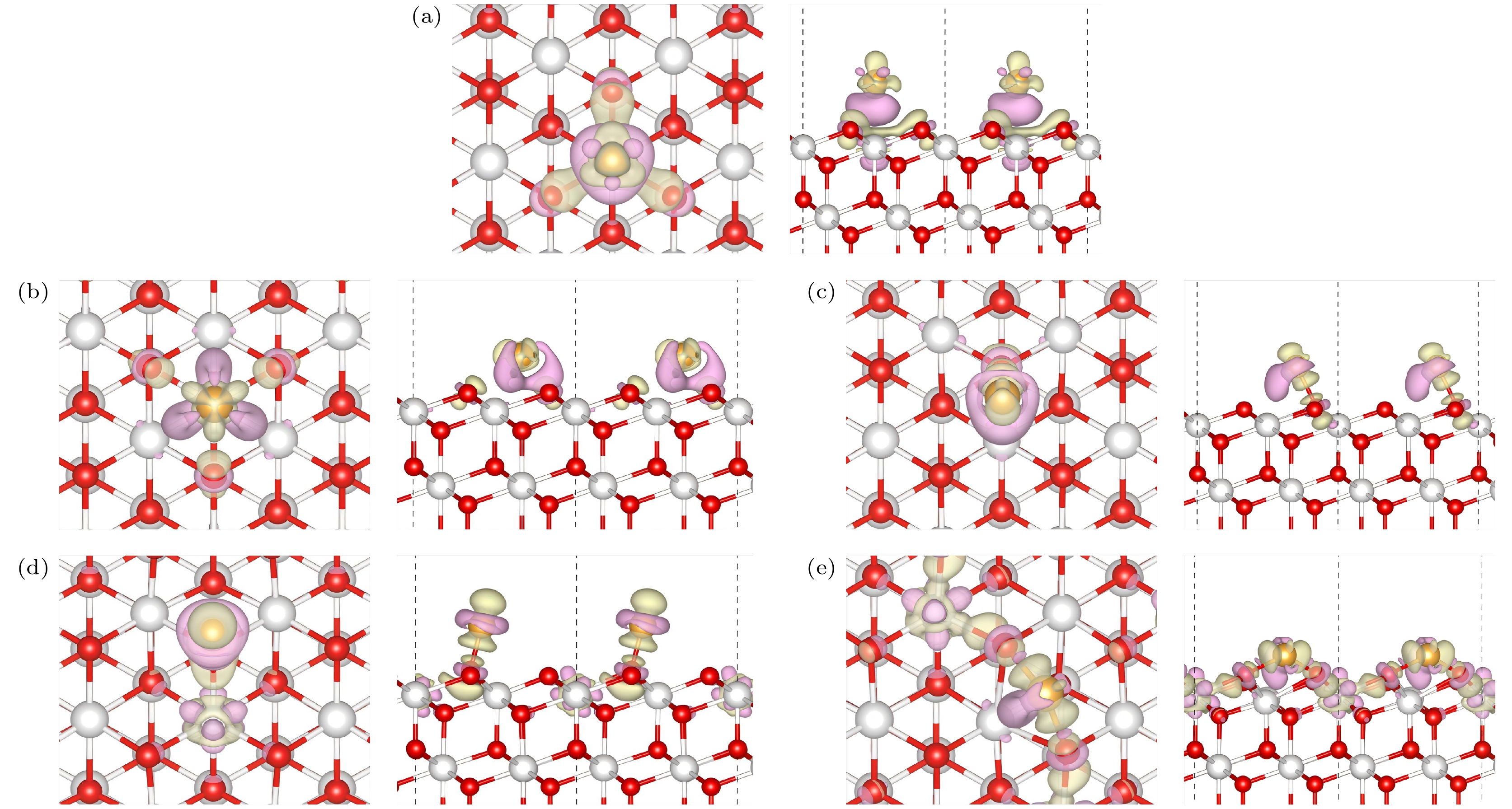
基于上述构型(图2), 在深入探讨了Au/CeO2(111)体系中Au原子的吸附能及其稳定吸附构型后, 进一步计算了Au/CeO2(111)表面在不同位点的差分电荷密度变化. 如图3(a)—(c)所示, Au原子吸附在Ce, Od和Ou-Ce位点时, 表面所有Ce原子均保持Ce4+状态, Ce—O键长的变化并不显著, 维持在2.34—2.39 Å范围内. 而在Ou和Ou-Ou位点(图3(d), (e))上, 结合Bader电荷分析可知, Ce原子的电荷从2.42|e|减至2.27|e|, 说明吸附过程Ce4+还原为Ce3+. 这种还原导致Ou和Ou-Ou位点的Ce—O键扩张至2.38—2.55 Å, 远超Ce4+在标准CeO2结构中的键长(2.34—2.38 Å), 并与Ce3+在立方和六方Ce2O3结构中的键长(分别为2.45 Å和2.54 Å)高度一致[27]. 这些电子并未占据与Au原子相邻的Ce位点, 而是分布在更远处的Ce原子上. 这可能是由于在这些位点上, Ce与Au之间的距离较短(分别为2.84 Å和3.68 Å), 若电子驻留于这些邻近Ce原子上, 可能会产生强烈的库仑排斥效应, 进而不利于稳定构型的形成[10]. 吸附位置附近剩余的Ce和O的电荷数几乎没有什么变化(< 0.06|e|).
Ce4+的还原是Au原子氧化的直接结果. 通过Bader电荷计算, 我们发现Au在Ou-Ou和Ou位点分别带有0.33|e|和0.26|e|的正电荷, 而在Ce, Od和Ou-Ce位点上, Au的电荷变化较小(分别为0.07|e|, 0.10|e|和0.13|e|), 几乎保持电中性. 研究发现, 伴随显著电荷转移的构型具有更高的稳定性, 其吸附能分布在0.95—1.19 eV之间, 明显高于未发生电荷转移的构型(吸附能范围为0.39—0.77 eV).
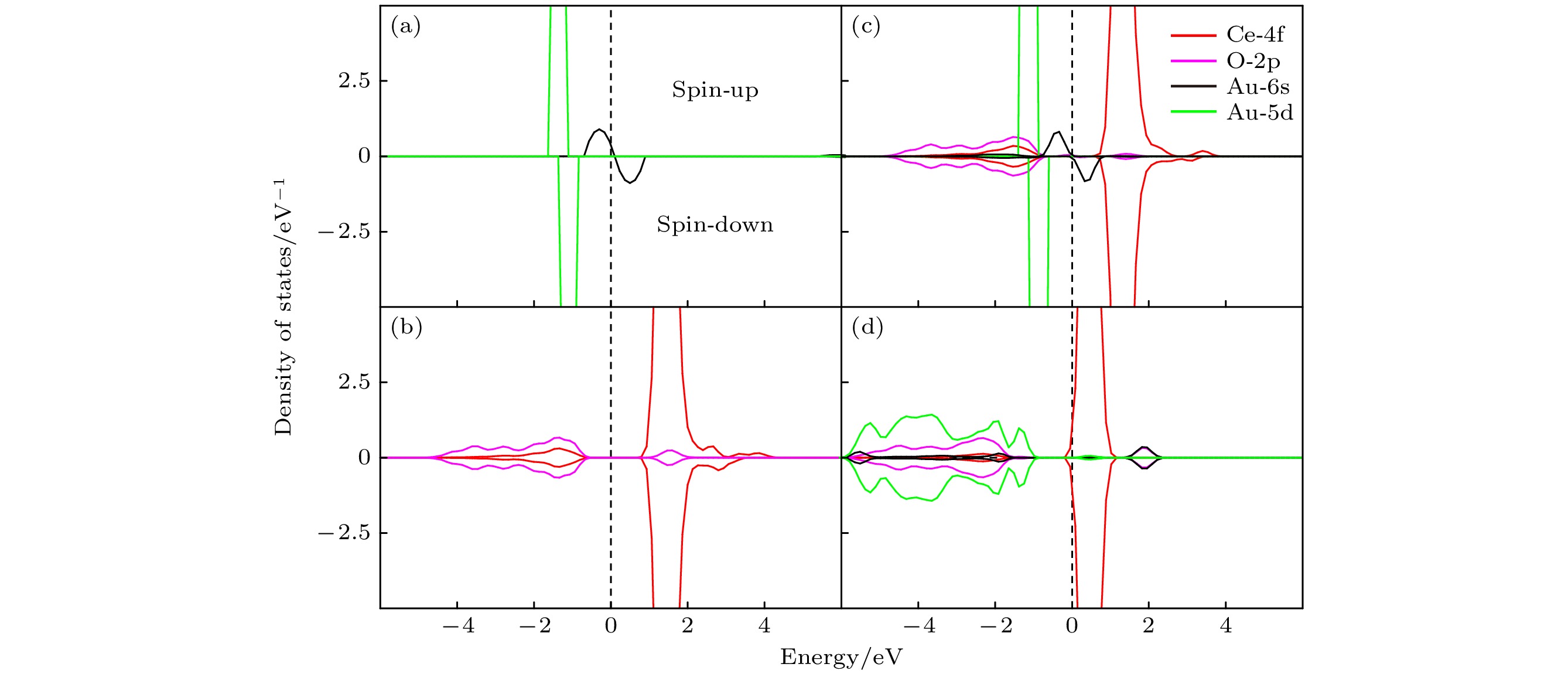
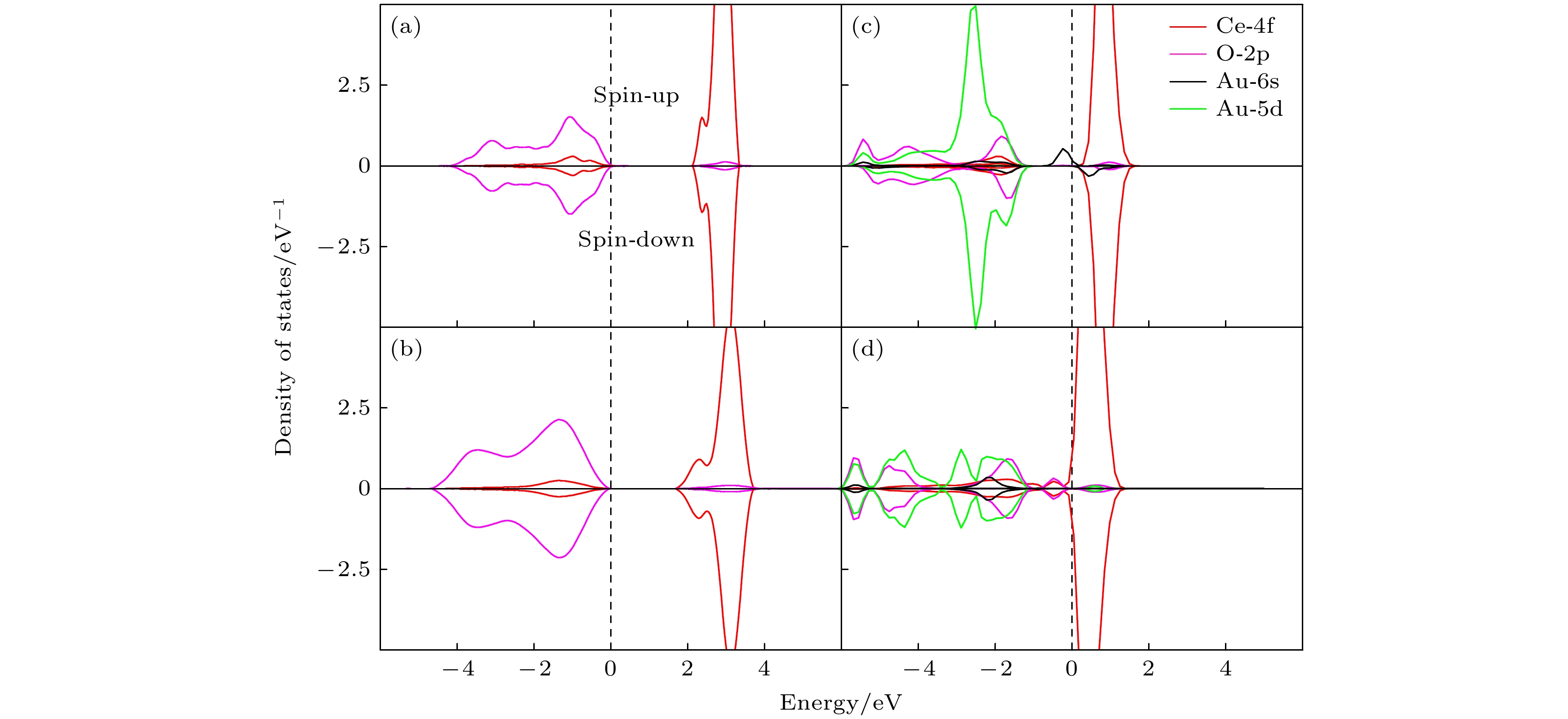
为了进一步探究Au原子与CeO2(111)表面之间的电荷转移机制, 我们对两种具有代表性的吸附构型进行了态密度(DOS)分析(O-2s, Ce-5s和Ce-5p电子位于比费米能级低10 eV以上, 因此没有描述): 一是电荷转移显著的氧-氧桥位 (Ou-Ou), 二是几乎没有电荷转移的铈顶位(Ce). 如图4(a)所示, 纯Au的态密度图中, 在费米能级的正下方和正上方分别存在已占用的自旋向上和未占用的自旋向下状态, 是Au-6s态, 其能量范围在–0.7—0.9 eV之间, 此外, 在–1.7 — –0.8 eV的能量范围内, 存在已占用的Au-5d态, 这些状态的能量位置相较Au-6s态更低. 图4(b)展示了纯净CeO2(111)表面的电子结构特征. 在–4.8 — 4.1 eV能量范围内, 该表面的电子态主要由O-2p和Ce-4f轨道共同构成. 进一步观察发现, 在–4.8 — –0.6 eV能量范围内, Ce-4f态与O-2p态之间存在显著的杂化现象. 这表明两者在这一能量区间内发生相互作用, 形成了混合的电子态. 在导带底附近, 即占据能量较高的部分, 主要由Ce-4f态构成, 其能量范围在0.8 — 4.1 eV之间, 说明此区域Ce-4f态对电子结构的影响占据主导地位, 同时, O-2p态也对导带底有所贡献, 但其能量范围相对较窄, 位于1.0 — 1.8 eV之间. 当Au原子吸附在铈顶位(Ce)(图4(c))时, 其6s态电子构型在–0.7 — 0.7 eV范围内保持稳定, 同时, Au-5d态在–1.4 — 0.6 eV范围内也未发生明显变化, 与纯Au相比无显著差异. 此外, Ce-4f态位于0.7 — 3.8 eV范围内, 且位于费米能级之上, 其电子占据状态与纯净CeO2(111)表面相比几乎无变化. 这与图3(a)中差分电荷密度相对应, 表明Au原子与Ce4+之间未发生电荷转移现象. 然而, 当Au原子吸附在Ou-Ou位(图4(d))时, 与铈顶位(Ce)(图4(c))相比, 原本稳定的Au-6s态电子被剥夺, 转变为未占据状态, 主要分布在1.4 —2.3 eV能量范围内. 同时, Ce-4f态跨越费米能级, 能量范围在–0.1 — 1.1 eV之间, 且轨道电子占据态数量相对于清洁表面(图4(b))有所减少. 这与图3(e)中差分电荷密度对应, 占据的Ce-4f态起 源于与Au吸附次邻近的Ce4+, 导致电子局域在次邻近Ce4+上, 进而Ce4+被还原为Ce3+, Au被氧化为Au+. 此外, 从能量分布的角度来看, O-2p态 主要分布在–5.8 — –1.6 eV范围内, 与清洁表面相比(图4(b)所示)能量向下移动1.0 eV, 同时, Au-5d态主要集中于–5.9 — –1.0 eV的低能区间, 仅有相对较少的Au-5d态出现在0.1—0.7 eV的高能区, 这一现象表明, O-2p与Au-5d存在显著的杂化作用. 这种杂化可归因于沿Au—O键轴形成的特殊O—Au—O键结构, 这种结构促进了O-2p轨道与Au-5d轨道之间的重叠, 增强了电子间的相互作用并缩短了Au—O键长, 增强了Au—O键的稳定性, 进一步印证Au在Ou-Ou上吸附更稳定.
-
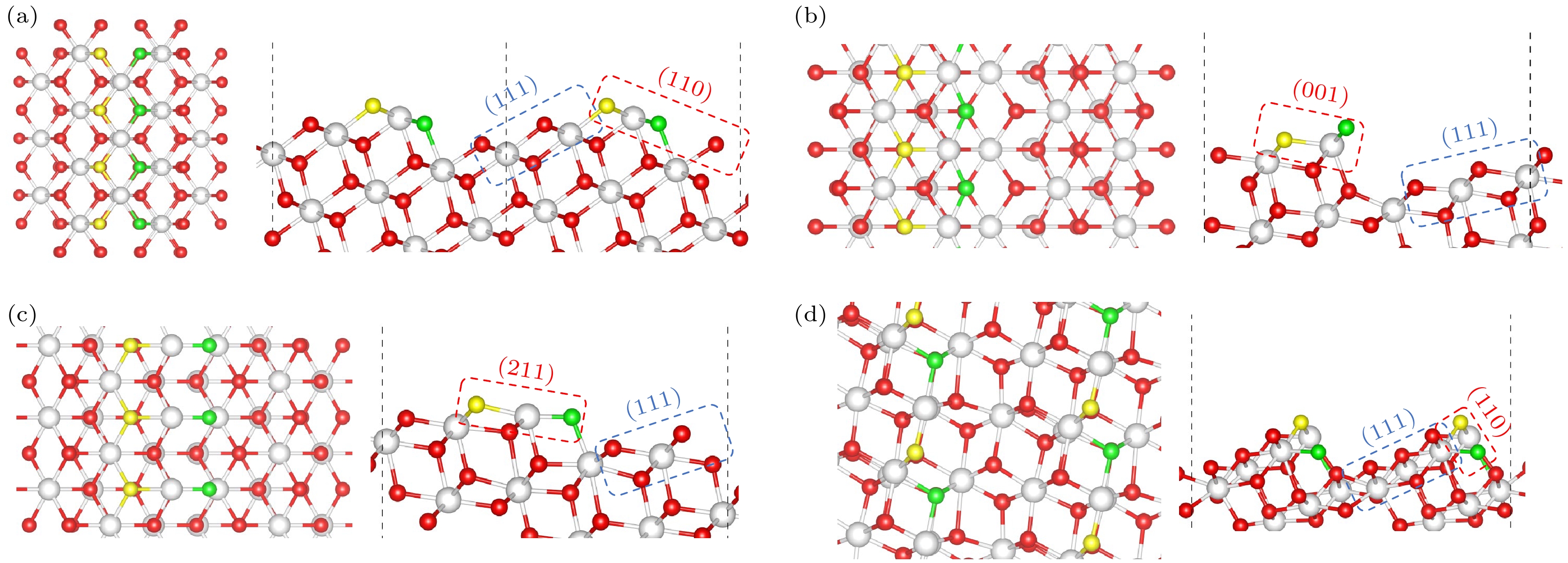
在深入分析了Au/CeO2(111)平面区域的吸附特性及其电子结构变化后, 接着研究更为复杂的台阶区域, CeO2(111)上存在4种独特台阶结构[28–32], 这些台阶结构在特定的退火条件下形成, 在1100 K退火条件下, 可以观察到Type I和Type II六角形岛状结构和凹坑的形成. 当退火温度升高到1200 K时, 发现带有台阶Type III边缘的不规则结构[32]. Kozlov等[33]的研究探讨了这些台阶结构的能量学特性, 并得出了它们相对稳定性的排序: Type I最为稳定, 其边缘结构在高温退火过程中能够稳定存在. 在Type II与Type III的稳定性相近, 而Type II*则相对最不稳定, 其在高温下更容易发生重构或转变. 这些台阶结构如图5所示. 图5(a)展示了Type I台阶, 其台阶边缘为{110}纳米面; 图5(b), (c)显示了Type II和Type II*台阶: Type II的台阶边缘以凸出的O原子作为标志, 表现出{001}纳米面的局部特性, 而Type II*台阶则通过移除一个CeO2单元实现了Ce端边缘的转变, 呈现出{211}纳米面的特征. 此外, Type III台阶以其独特的{110}纳米面边缘垂直连接上下CeO2(111)台阶, 具有显著的特殊性. 针对这些台阶结构, 我们特别关注了两种关键的吸附位点: 一种是位于 {111}台阶上边缘的OT位点(以黄色标记), 另一种是靠近{111}台阶下边缘的OE位点(以绿色标记)[34,35].
我们评估了CeO2(111)表面4种独特台阶结构(OT和OE位点)对Au原子的吸附能力. 如表2所示, 在Type I上, OT位点和OE位点的吸附能分别为1.0 eV和0.97 eV, 两者相近. 这主要是因为在这两种位点中, 氧(O)和铈(Ce)的配位数保持一致, 导致相似的吸附强度. 然而, 在Type II和Type II*中, 情况发生了变化, 在Type II中, OE位点的吸附能(1.32 eV)相较于OT位点(1.25 eV)更高; 类似地, 在Type II*中, OE位点的吸附能(1.74 eV)明显高于OT位点(1.36 eV); Type III中, OE和OT位点的吸附能分别为2.15 eV和2.14 eV, 两者再次接近, 但OT位吸附能略高. 由此可以得出结论, 低配位数(如O2c)的氧原子其活性高于高配位数(如O3c)的对应物.
Au原子在Type II*和Type III上展现出强烈的吸附特性. 其吸附能在1.36—2.15 eV之间, 高于Type I和Type II的0.97—1.32 eV. 这主要归因于Type II*和Type III边缘Ce的高度欠配位状态, 其Ce的配位数为5, 相比Type I和Type II的Ce的6配位, 使得Au原子更容易在Type II*和Type III 上吸附[36]. 与Au/CeO2(111)表面吸附类似, Type II*和Type III的Au—O键长缩短至1.93—1.97 Å, 远小于其他类型台阶上的键长(1.94—2.14 Å). 因此, Type II*和Type III因其独特的化学环境, 成为了Au原子更倾向的吸附位点.
当Au/CeO2(111)将台阶区域与平面区域(O原子配位数为3, Ce原子配位数为7)进行对比时, 平面区域的吸附能较弱, 范围在0.39—1.19 eV, 台阶边缘在Au原子吸附中更有优势. 台阶边缘因其原子配位数降低, 形成了不饱和键和悬挂键, 这种高度的欠配位状态改变了台阶边缘的局部结构和化学环境, 削弱了马德隆势, 促进了共价相互作用的增强[37]. 实验数据[38]也与我们的理论推断相吻合, 证实了Au原子与台阶边缘的相互作用强于平面区域的相互作用.
在深入研究Au/CeO2(111)台阶区域时, 对比了Au在多种台阶类型(Type I, Type II, Type II*及Type III)上的吸附行为特性, 进一步计算了它们各自的差分电荷密度变化, 如图6所示, 图6(a)—(f)展示了在Type I, Type II型和Type II*上, Au原子与邻近的氧原子之间的电荷转移现象. 表面Ce原子均稳定维持在Ce4+, 这一现象在OT和OE吸附位点上均得到了明确验证. 然而, 对于Type III(图6(g), (h)), 情况出现了不同, 根据Bader电荷分析, 我们发现Ce原子的电荷状态发生了变化, 从初始的2.40|e|减至2.11|e|, Ce4+还原为Ce3+. 尽管Au原子与某些Ce原子距离较近(如3.73 Å和3.79 Å), 但还原过程中释放的电子并未直接占据这些紧邻的Ce位点. 它们更倾向于分布在距离稍远的Ce原子上(如3.94 Å和4.00 Å). 与在Au/CeO2(111)表面的吸附类似, 附近其余的Ce和O的电荷数几乎没有什么变化(<0.06|e|).
Au原子在Type III时携带的正电荷增大至+0.35|e|. 当Au原子在Type I, Type II和Type II*时, 无论在OT或OE位, 电荷变化仅为0.13|e|—0.16|e|, 表明电荷转移较为有限. 结合之前关于Au原子在台阶结构上吸附能的数据(如表2所示), 可以推断, 伴随强烈电荷转移的吸附构型展现出了更高的稳定性.
尽管Type II*和Type III型具有相同的Ce配位数, 但通过差分电荷密度和巴德电荷(Bader)分析, 由此揭示了它们在电荷转移机制上的不同. 为了深入探讨这一现象背后的电子结构, 我们选取了也具有相同的O配位数Type II*的OE位点和Type III的OT位点, 及其对应的无Au吸附状态下的台阶结构, 进行电子DOS分析. 如图7(a)所示, Type II*表面的占据态主要由O-2p和Ce-4f轨道贡献. 在–4.2 — –0.1 eV能量范围内, 占据态主要由O-2p轨道贡献, 伴有少量的Ce-4f态; 而在2.2 —3.4 eV能量范围内, 主要由Ce-4f轨道所贡献, 形成2.3 eV的宽带能隙. 相比之下, 图7(b)中的Type III在–4.7 — 3.8 eV能量范围内展现出更宽的轨道能量分布. 类似地, 其占据态在–4.7 — –0.1 eV区间主要由O-2p贡献, 而在1.8 — 3.8 eV区间则主要由Ce-4f贡献, 形成约1.9 eV的宽带能隙[33]. 这一数据与先前文献报道的数据相吻合, 证实了计算的准确性. 通过对比图7(a)和图7(b), 我们发现Type III型台阶在–4.2 — –0.1 eV能量范围内的价带边缘略高于Type II*型台阶, 且Type III相对O-2p与Ce-4f强度也相对大于Type II*; 此外, Type III具有更窄的宽带能隙, 使得电子跃迁更为容易, 因此更容易与Au发生相互作用. 这一发现解释了为何Au原子在Type III上的吸附能更高. 进一步分析Au/ CeO2(111)体系在Type II* OE位点(图7(c))的DOS发现, 在–0.6 — 0.8 eV的能量范围内, Au原子的6s轨道跨越费米能级, 同时, Au-5d轨道主要分布在–5.5 — –1.1 eV范围内, 而O-2p轨道则占据了更宽的能量范围, 即–5.8 — –1.0 eV范围内, 这比Type II*(图7(a))轨道分布能量低约1.0 eV. Ce的4f轨道主要分布在0.3 — 1.6 eV范围内, 与Type II*(图7(a))相比, Ce的4f轨道能量降低了约2.0 eV. 综合以上分析可以得出, 在Au/CeO2(111)体系中, Type II* OE位点的电子结构受到Au原子的影响程度相对较小. 在图7(d)中, 当Au吸附在Type III OT位点时, Ce-4f能量范围在–0.2 —1.4 eV内, 且Ce-4f轨道跨越费米能级, 相较于与Type III(图7(b))能级大幅变动, 引起了显著的电子结构变化, 同时Ce-4f电子的占据态数量也略有减少. 这一现象与图6(h)中展示的差分电荷密度相吻合, 表明Ce4+被还原为Ce3+. Au的6s电子占据状态在–2.9 — –1.7 eV范围内与Type II*(图7(c))相比未跨越费米能级, 表明Au原子被氧化为Au+, Au-5d电子主要分布在–2.9 — 1.1 eV能量范围内, 少量分布在0.3 — 0.8 eV范围内; 与Type III(图7(b))相比, 在–6 — –0.2 eV范围内, O-2p态向能量更低处转移, 这一变化不仅显示了O原子电子结构的调整, 还伴随着Au-5d与O-2p之间的杂化现象, 这种杂化可归因于沿Au—O键轴形成的特殊O—Au—O键结构, 进而促进O-2p轨道与Au-5d轨道之间的重叠, 增强了电子间的相互作用.
此外, 本研究与Janssen等[39]的研究一致. Janssen等[39]明确指出, Au原子的5dz²轨道与6s轨道的杂化在决定其氧化状态方面起到了关键作用. Au通过杂化这两个轨道, 形成了有利于Au+稳定的电子结构. 具体来说, 杂化后形成的两个新轨道中, 一个主要局域在金原子和配体之间的z方向上, 而另一个则局域在xy平面上, 远离配体. 这种轨道排列使得只有后者的杂化轨道被占据, 而前者由于配体电子的排斥而保持空置, 从而有利于Au+的稳定[38]. 换句话说, 是因为这种氧化状态能够优化电子分布, 减小金原子与配体间电子云的排斥力. 本研究的实验结果(如图4(d)和图7(d)所示)验证了上述观点, 显示Au发生了的s-d杂化, 且其费米能级以上的Au具有的5d贡献, 这与上述电子结构论点相一致.
-
综上所述, 本研究通过对不同吸附位点的电荷转移机制进行深入分析, 阐明了Au/CeO2(111)体系中Au原子的稳定性及其氧化态的形成过程. 所建立的吸附模型打破了只关注平面吸附的传统局限, 揭示了台阶边缘在Au/CeO2催化过程中的关键作用, 尤其是低配位氧原子的高活性. 然后通过系统的计算, 在平面区域识别出了5种吸附构型, 其中氧-氧桥位(Ou-Ou)表现出最稳定的吸附特性, 其吸附能为1.19 eV, 且Au—O键长显著缩短, 展示了Au与该位点的紧密相互作用. 差分电荷密度和Bader分析进一步证实, Au原子在吸附过程中带有0.33|e|的正电荷, 而Ce原子的电荷则从2.42|e|减至2.27|e|, 表明存在电荷转移现象. DOS分析揭示, 原本稳定的Au 6s态电子被部分剥夺, Au原子被氧化为Au+, Ce-4f轨道跨越费米能级, Ce4+被还原为Ce3+, 从而增强了Au在Ou-Ou位点上的吸附. 此外, 由于台阶边缘的原子配位数较低, 形成了高度欠配位状态, 从而增强了台阶边缘对Au原子的吸附能力. 特别是Type III位点(吸附能范围为1.36—2.15 eV), 其吸附能高于其他位点. 在Type III位点上, Au原子的电荷量增加至 +0.35|e|, 而Ce原子的电荷状态也发生变化, 从2.40|e|减至2.11|e|, 发生了Au/Ce4+→Au+/Ce3+的反应. DOS分析显示, Au的6s电子被大量剥夺, 同时促进了Ce-4f轨道跨越费米能级, 实现了电子从Au向Ce4+的转移, 这与平面Ou-Ou位点上的机制相似. 这些发现加深了对Au/CeO2(111)界面吸附机制理解, 也为稀土氧化物在催化及其他相关领域的应用提供了新颖的理论依据.
Au/CeO2(111)表面吸附的电荷转移特性
Charge transfer characteristics of Au adsorption on CeO2(111) surface
-
摘要: Au/CeO2(111)作为一种重要的催化剂体系, 在催化氧化、水气转换反应等多个领域展现出优异的催化性能. 为了深入揭示其催化机理, 特别是在原子尺度上理解活性组分的相互作用. 本文采用密度泛函理论(DFT+U)计算方法, 构建了Au/CeO2(111)体系的原子尺度模型, 通过计算该模型的吸附能、差分电荷密度、巴德电荷以及态密度, 揭示了Au/CeO2(111)的表面吸附行为. 在CeO2(111)的平面区域内, 经过结构弛豫与优化, 确定了5个Au吸附位点. 其中最为稳定的吸附位点并非传统上认为的氧顶位, 而是氧-氧桥位. 在这种吸附构型下, 电荷从Au向Ce4+转移, 导致Ce4+被还原为Ce3+, 伴随着显著的电荷转移现象. 过去的研究更多地关注了平面区域的吸附行为, 而忽视了台阶边缘区域在催化过程中的重要性. 因此, 本研究进一步扩展了研究范围, 深入探讨了4种不同台阶结构对Au吸附的影响, 其中, Type II*和Type III台阶因高度欠配位的Ce原子增强了对Au原子的吸附, 特别是Type III台阶通过显著的电荷转移成为Au的首选吸附位点. 本研究通过构建更全面的Au/CeO2模型, 突破了以往仅关注平面吸附的局限性, 揭示了Au/CeO2在台阶边缘的吸附机制, 为深入理解Au/CeO2(111)的催化机理提供了新的视角.
-
关键词:
- Au/CeO2(111) /
- 电荷转移 /
- 吸附能 /
- 第一性原理计算
Abstract: Au/CeO2(111), as an important catalyst system, has demonstrated excellent catalytic performances in a variety of fields such as the catalytic oxidation and the water-gas shift reactions. In order to reveal in depth the Au/CeO2(111) catalytic mechanism, especially to understand the interaction of the active components on an atomic scale, in this work, the adsorption properties on the Au/CeO2(111) surface are investigated by calculating the adsorption energy, differential charge density, Bader charge, and the density of states by using density functional theory (DFT+U). First, five adsorption sites of Au/CeO2(111) are identified in the planar region of CeO2(111), and the most stable adsorption configuration is found to be located at the bridging position between surface oxygen atoms (the oxygen-oxygen bridging site), which suggests that Au interacts more closely with the oxygen-oxygen bridging sites. Further, the differential charge density and Bader charge reveal the charge transfer mechanism in the adsorption process. Specifically, the Au atoms are oxidized into Au+, while the Ce4+ ions in the second nearest neighbor of Au are reduced to Ce3+, and the adsorption process is accompanied by a charge transfer phenomenon. Au also exhibits a unique adsorption behavior in the CeO2(111) step-edge region, where a highly under-allocated environment is formed due to the decrease in the coordination number of atoms in the step edge, which enhances the adsorption of Au in a highly under-allocated environment. The adsorption of Au at the step edge is enhanced by the lower coordinated environment due to the reduced coordination number of the atoms at the step edge. By comparing four different types of step structures (Type I, Type II, Type II*, and Type III), it is found that the higher adsorption energy of Au at Type II* site and that at Type III site are both mainly due to the lower coordinated state of Ce atoms at these sites. Charge transfer is also particularly pronounced at the Type III sites. It is also accompanied by electron transferring from Au to Ce4+ ions, making Type III the preferred adsorption site for Au atoms. By constructing a more comprehensive Au/CeO2 model, this study breaks through the previous limitation of focusing only on planar adsorption and reveals the adsorption mechanism of Au/CeO2 at the edge of the step, which provides a new perspective for understanding in depth the catalytic mechanism of Au/CeO2(111).-
Key words:
- Au/CeO2(111) /
- charge transfer /
- adsorption energy /
- first principles calculations .
-

-
图 4 (a)纯金(Au)的态密度; (b)纯净的CeO2(111) 表面的态密度; (c) Au/CeO2(111) 表面铈顶位的态密度; (d) Au/CeO2(111) 表面氧-氧桥位的态密度, spin-up 和 spin-down 分别代表自旋向上和自旋向下的电子态
Figure 4. Presents the DOS for various systems: (a) pure gold (Au); (b) pristine CeO2(111) surface; (c) Au/CeO2(111) surface at the cerium top site; (d) Au/CeO2(111) surface at the oxygen-oxygen bridge site, within each plot, spin-up and spin-down represent the electronic states with spin aligned upwards and downwards.
图 3 Au/CeO2(111)表面上的差分电荷密度 (a)铈顶位(Ce); (b)次氧位(Od); (c)顶氧-铈位(Ou-Ce); (d)氧顶位(Ou); (e)氧-氧桥位(Ou-Ou), 图中紫色部分表示该位置电荷减少, 绿色部分表示电荷的增加
Figure 3. Differential charge density on the Au/CeO2(111) surface: (a) Cerium top site (Ce); (b) sub-oxygen site (Od); (c) top oxygen-cerium site (Ou-Ce); (d) oxygen top site (Ou); (e) oxygen-oxygen bridge site (Ou-Ou), the purple regions in the figure indicate a decrease in charge at that location, while the green regions indicate an increase in charge.
图 5 (a) I型台阶, (b) II型台阶, (c) II*型台阶, (d) III型台阶构建的化学计量CeO2表面. 台阶上边缘的氧(OT)和靠近台阶下边缘的氧(OE)分别用黄色和绿色代表(左: 俯视图; 右: 侧视图)
Figure 5. Calculated structures of stoichiometric CeO2 vicinal surfaces built for (a) Type I steps, (b) Type II steps, (c) Type II* steps, (d) Type III steps. The oxygen at the border of the upper (111) terrace (OT) and the oxygen at the edge close to the lower (111) terrace (OE) are highlighted in yellow and green, respectively (Left: Top view; Right: Side view).
图 6 Au/CeO2(111)台阶上的差分电荷密度(左: 俯视图; 右: 侧视图) (a) Type I OT位点, (b) Type I OE位点; (c) Type II OT位点, (d) Type II OE位点; (e) Type II* OT位点, (f) Type II* OE位点; (g) Type III OT位点, (h) Type III OE位点; 图中紫色部分表示该位置电荷减少, 绿色部分表示电荷的增加
Figure 6. Differential charge density on stepped Au/CeO2(111) surfaces (Left: Top view; Right: Side view): (a) OT of Type I, (b) OE of Type I; (c) OT of Type II, (d) OE of Type II; (e) OT of Type II*, (f) OE of Type II*; (g) OT of Type III, (h) OE of Type III; the purple regions indicate charge depletion, while the green regions indicate charge accumulation at those locations.
图 7 CeO2(111)表面上的 (a) Type II*, (b) Type III; (c) Au吸附Type II* OE位点; (d) Au吸附Type III OT位点DOS. spin-up 和 spin-down 分别代表自旋向上和自旋向下的电子态
Figure 7. DOS for (a) Type II* on CeO2 (111) surface, (b) Type III on CeO2 (111) surface; (c) Au adsorbed at OE site of Type II*; (d) Au adsorbed at OT site of Type III; spin-up and spin-down represent the electronic states with spin directed upwards and downwards, respectively.
表 1 Au/CeO2(111)表面吸附构型的能量和几何性质, Eads是吸附能, d[Au-O]和d[Au-Ce]是附着原子到表面原子的距离, d[Ce-O]是铈原子到氧原子的距离
Table 1. Energy and geometric properties of adsorption configurations on the Au/CeO2(111) surface, Eads is the adsorption energy, d[Au–O] and d[Au–Ce] are distances from the adsorbed atoms to surface atoms, and d[Ce-O] is the distance between the cerium atom and the oxygen atom.
Site Eads/eV $ d_\text{[Au-O]}$ /Å$ d_\text{[Au-Ce]} $ /Å$ d_\text{[Ce-O]} $ /ÅCe 0.39 2×3.15
1×3.101×2.99
2×4.86
1×4.913×2.36
3×2.39Od 0.61 1×2.73
1×2.75
1×2.791×3.26
1×3.28
1×3.29
1×5.099×2.38 Ou-Ce 0.77 2.15 1×3.17
1×3.98
1×4.01
1×4.971×2.34
1×2.35
3×2.36
1×2.37Ou 0.95 1.97 1×3.68
1×3.70
1×4.07
1×5.631×2.38
2×2.42
2×2.45
1×2.53Ou-Ou 1.19 2×2.14 1×2.84
2×3.31
1×4.611×2.41
2×2.42
1×2.46
2×2.55表 2 Au/CeO2(111)台阶吸附构型的能量和几何性质, Eads是吸附能, d[Au-O] 和d[Au-Ce]是附着原子到表面原子的距离, d[Ce-O]是铈原子到氧原子的距离, 及不同配位数O和Ce原子
Table 2. Energy and geometric properties of adsorption configurations on stepped Au/CeO2(111) surfaces. Eads is the adsorption energy, d[Au-O] and d[Au-Ce] are the distances from the adsorbed atom to the surface atoms, d[Ce-O] is the distance between the cerium atom and the oxygen atom, along with the coordination numbers of different O and Ce atoms.
Step type Eads/eV $ d_\text{[Au-O]}$ /Å$ d_\text{[Au-Ce]}$ /Å$ d_\text{[Ce-O]}$ /ÅOcoordination Cecoordination OT of TypeⅠ 1.00 1×2.14 1×3.30
1×3.361×2.31
1×2.51
1×2.533 6 OE of TypeⅠ 0.97 1×2.16 1×3.31
1×3.291×2.38
1×2.39
1×2.473 6 OT of TypeⅡ 1.25 1×1.95 1×3.59
2×3.951×2.51
2×2.563 6 OE of TypeⅡ 1.32 1×1.94 1×3.82
1×3.86
1×5.952×2.42 2 6 OT of TypeⅡ* 1.36 1×1.97 1×3.40
1×3.94
1×3.982×2.46 3 5 OE of TypeⅡ* 1.74 1×1.93 1×3.79
1×5.21
1×5.381×2.21
1×2.692 5 OT of Type Ⅲ 2.15 1×1.94 1×3.73
1×3.94
1×4.331×2.42
1×2.472 5 OE of Type Ⅲ 2.14 1×1.93 1×3.79
1×4.00
1×4.791×2.41
1×2.493 5 -
[1] Haruta M, Kobayashi T, Sano H, Yamada N 1987 Chem. Lett. 16 405 doi: 10.1246/cl.1987.405 [2] Li Y J, Wen H, Zhang Q, Adachi Y, Arima E, Kinoshita Y, Nomura H, Ma Z M, Kou L, Tsukuda Y, Naitoh Y, Sugawara Y, Xu R, Cheng Z 2018 Ultramicroscopy 191 51 doi: 10.1016/j.ultramic.2018.04.003 [3] Zielinski M, Juszczyk W, Kaszkur Z 2022 RSC Adv. 12 5312 doi: 10.1039/D1RA09434C [4] Berrichi A, Bailiche Z, Bachir R 2022 Res. Chem. Intermed. 48 4119 doi: 10.1007/s11164-022-04796-5 [5] Megías-Sayago C, Lolli A, Ivanova S, Albonetti S, Cavani F, Odriozola J A 2019 Catal. Today 333 169 doi: 10.1016/j.cattod.2018.04.024 [6] Li Q L, Xie W, Chen G Q, Li Y F, Huang Y J, Chen X D 2015 Nano Res. 8 3075 doi: 10.1007/s12274-015-0813-z [7] Liu H P, Cao Z L, Yang S Y, Ren Q Y, Dong Z J, Liu W, Li Z A, Chen X, Luo L L 2024 Nano Res. 17 4986 doi: 10.1007/s12274-024-6508-6 [8] Kim C, Thompson L 2006 J. Catal. 244 248 doi: 10.1016/j.jcat.2006.08.018 [9] Chen Y, Hu P, Lee M H, Wang H 2008 Surf. Sci. 602 1736 doi: 10.1016/j.susc.2008.02.036 [10] Hernández N C, Grau-Crespo R, De Leeuw N H, Sanz J Fdez 2009 Phys. Chem. Chem. Phys. 11 5246 doi: 10.1039/b820373c [11] Zhang C, Michaelides A, King D A, Jenkins S J 2010 J. Am. Chem. Soc. 132 2175 doi: 10.1021/ja906687f [12] Engel J, Francis S, Roldan A 2019 Phys. Chem. Chem. Phys. 21 19011 doi: 10.1039/C9CP03066B [13] Shu P L, Tian X, Guo Q, Ren X, Zhao B, Wen H F, Tang J, Li Y J, Yasuhiro S, Ma Z M, Liu J 2024 Phys. Scr. 99 105990 doi: 10.1088/1402-4896/ad77f9 [14] Teng B T, Wu F M, Huang W X, Wen X D, Zhao L H, Luo M F 2012 ChemPhysChem 13 1261 doi: 10.1002/cphc.201101007 [15] Lu Y, Quardokus R, Lent C S, Justaud F, Lapinte C, Kandel S A 2010 J. Am. Chem. Soc. 132 13519 doi: 10.1021/ja105958p [16] Lustemberg P G, Pan Y, Shaw B J, Grinter D, Pang C, Thornton G, Pérez R, Ganduglia-Pirovano M V, Nilius N 2016 Phys. ReV. Lett. 116 236101 doi: 10.1103/PhysRevLett.116.236101 [17] Fu Q, Saltsburg H, Flytzani-Stephanopoulos M 2003 Science 301 935 doi: 10.1126/science.1085721 [18] Bezkrovnyi O, Bruix A, Blaumeiser D, Piliai L, Schötz S, Bauer T, Khalakhan I, Skála T, Matvija P, Kraszkiewicz P, Pawlyta M, Vorokhta M, Matolínová I, Libuda J, Neyman K M, Kȩpiński L 2022 Chem. Mater. 34 7916 doi: 10.1021/acs.chemmater.2c01659 [19] Tibiletti D, Amieiro-Fonseca A, Burch R, Chen Y, Fisher J M, Goguet A, Hardacre C, Hu P, Thompsett D 2005 J. Phys. Chem. B 109 22553 doi: 10.1021/jp054576s [20] 冯婕, 郭强, 舒鹏丽, 温阳, 温焕飞, 马宗敏, 李艳君, 刘俊, 伊戈尔·弗拉基米罗维奇·雅明斯基 2023 物理学报 72 110701 doi: 10.7498/aps.72.20230051 Feng J, Guo Q, Shu P L, Wen Y, Wen H F, Ma Z M, Li Y J, Liu J 2023 Acta Phys. Sin. 72 110701 doi: 10.7498/aps.72.20230051 [21] Perdew J P, Burke K, Ernzerhof M 1996 Phys. ReV. Lett. 77 3865 doi: 10.1103/PhysRevLett.77.3865 [22] Cococcioni M, De Gironcoli S 2005 Phys. Rev. B 71 035105 doi: 10.1103/PhysRevB.71.035105 [23] Zheng Z Y, Wang D, Zhang Y, Yang F, Gong X Q 2020 Chin. J. Cata. 41 1360 doi: 10.1016/S1872-2067(20)63564-1 [24] Wilson E L, Grau-Crespo R, Pang C L, Cabailh G, Chen Q, Purton J A, Catlow C R A, Brown W A, De Leeuw N H, Thornton G 2008 J. Phys. Chem. C 112 10918 doi: 10.1021/jp8004103 [25] Ma Z M, Shi Y B, Mu J L, Qu Z, Zhang X M, Li Q, Liu J 2017 Appl. Surf. Sci. 394 472 doi: 10.1016/j.apsusc.2016.10.140 [26] Owen C J, Jenkins S J 2021 J. Chem. Phys. 154 164703 doi: 10.1063/5.0048953 [27] Chen L J, Tang Y, Cui L, Ouyang C, Shi S 2013 J. of Power Sources 234 69 doi: 10.1016/j.jpowsour.2013.01.121 [28] Kim H Y, Henkelman G 2013 J. Phys. Chem. Lett. 4 216 doi: 10.1021/jz301778b [29] Kozlov S M, Neyman K M 2014 Phys. Chem. Chem. Phys. 16 7823 doi: 10.1039/c4cp00136b [30] Olbrich R, Pieper H H, Oelke R, Wilkens H, Wollschläger J, Zoellner M H, Schroeder T, Reichling M 2014 Appl. Phys. Lett. 104 081910 doi: 10.1063/1.4866667 [31] Barth C, Laffon C, Olbrich R, Ranguis A, Parent Ph, Reichling M 2016 Sci Rep. 6 21165 doi: 10.1038/srep21165 [32] Shu P L, Guo Q, Tian X, Wei J, Qu Z, Ren X, Wen H F, Tang J, Li Y J, Sugawara Y, Ma Z M, Liu J 2024 Surf. Interfaces 51 104738 doi: 10.1016/j.surfin.2024.104738 [33] Kozlov S M, Viñes F, Nilius N, Shaikhutdinov S, Neyman K M 2012 J. Phys. Chem. Lett. 3 1956 doi: 10.1021/jz3006942 [34] Chu D R, Wang Z Q, Gong X Q 2022 Surf. Sci 722 122096 doi: 10.1016/j.susc.2022.122096 [35] 温焕飞, 菅原康弘, 李艳君 2020 物理学报 69 210701 doi: 10.7498/aps.69.20200773 Wen H F, Sugawara Y, Li Y J 2020 Acta Phys. Sin. 69 210701 doi: 10.7498/aps.69.20200773 [36] Zhou H, Wang D, Gong X Q 2020 Phys. Chem. Chem. Phys. 22 7738 doi: 10.1039/D0CP00204F [37] Zhou C Y, Wang D, Gong X Q 2019 Phys. Chem. Chem. Phys. 21 19987 doi: 10.1039/C9CP03408K [38] Piliai L, Matvija P, Dinhová T N, Khalakhan I, Skála T, Doležal Z, Bezkrovnyi O, Kepinski L, Vorokhta M, Matolínová I 2022 ACS Appl. Mater. Interfaces 14 56280 doi: 10.1021/acsami.2c15792 [39] Janssen E M W, Wiegers G A 1978 J. Less-Common Met. 57 47 doi: 10.1016/0022-5088(78)90248-5 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: