-
视网膜血氧饱和度(oxygen saturation, SO2)是衡量视网膜局部代谢状态和微循环健康的重要指标, 对多种眼部疾病, 如糖尿病视网膜病变[1,2]、青光眼[3,4]及视网膜静脉阻塞[5,6]等疾病具有重要的诊断和监测价值. 在全身氧饱和度正常的情况下, 局部视网膜疾病往往会引起显著的视网膜血氧水平变化[7]. 因此一个可靠的视网膜血氧饱和度测量方法对于这些疾病的研究、监测和管理至关重要.
目前视网膜血氧饱和度的测量是基于氧合血红蛋白(oxyhemoglobin, HbO2)和脱氧血红蛋白(deoxyhemoglobin, Hb)的吸收光谱的差异[8,9]. 在可见光波段, 血红蛋白的吸收较强, 结合HbO2和Hb在520—600 nm波段的吸收特征以及光学相干层析成像(optical coherence tomography, OCT)的深度分辨能力, 可见光OCT通过光谱拟合可以直接获取视网膜血氧饱和度[10–12]. 然而, 可见光可能导致受试者的不适, 并且其诱发的视网膜生理变化会影响测量的准确性[8,13]. 相比之下, 近红外一区对眼部的刺激较少, 是OCT眼科成像的标准波段. 尽管在该波段, HbO2和Hb的散射效应远远超过吸收效应, 难以提取出血液吸收光谱来直接实现血氧饱和度测量. 但研究表明, 血液的散射系数也与SO2存在关联, 综合吸收和散射的效应能够更精确地量化SO2[14]. 因此在近红外波段可以通过提取血液的衰减(吸收和散射)来进行血氧饱和度的量化. 已有研究利用近红外OCT, 通过计算氧敏感波长(855 nm)与氧等消光波长(805 nm)之间的光衰减的比值, 即光密度比(ratio of optical density, ODR), 标定实现了视网膜血氧饱和度的测量[15–17]. 此方法充分发挥了OCT深度分辨的优势[18,19], 克服了传统眼底相机双波长技术二维成像的局限性, 避免了视网膜和脉络膜色素沉着、血管大小以及视网膜神经纤维层厚度等因素对测量结果的影响[8]. 然而, 仅依赖视网膜OCT结构图难以精确定位血管的三维位置, 而手动选取血管区域的方式易受人为主观因素的影响, 不仅降低了测量效率, 还削弱了结果的客观性和重复性[15–17].
作为OCT技术的扩展, 光学相干血流造影(optical coherence tomography angiography, OCTA)可以实现单根毛细血管分辨能力的三维血流成像[20–23]. 本研究基于近红外OCT系统提出了一种OCTA引导的视网膜血氧测量算法. 在OCTA生成的三维血流图的引导下, 全自动化实现了血管以及周围组织区域的三维位置的精确定位, 不仅消除了主观干扰, 还显著提高了测量效率以及结果的客观性. 结合氧敏感波长(855 nm)与氧等消光波长(805 nm)的ODR计算, 本文在动物模型小鼠上验证了动脉和静脉分类的可行性, 并通过标定实现了视网膜血氧的测量. 本研究开发的OCTA引导的近红外一区视网膜血氧测量方法有望应用于眼科疾病的早期诊断、病情评估及疗效监测等方面.
-
血液中的光强变化可用修正的朗伯比尔定律进行描述[15]:
其中, I为光强, I0为初始光强, ε为衰减系数, d为传输距离, c为血红蛋白含量. 光在血液传输过程中产生的衰减定义为光学密度(optical density, OD), 其是由HbO2和Hb共同作用产生的, 表达式如下所示:
其中
$ {\varepsilon _{{\text{Hb}}{{\text{O}}_{2}}}} $ ,$ {\varepsilon _{{\text{Hb}}}} $ 分别为HbO2和Hb的光学衰减系数, [HbO2]和[Hb]分别代表血液中HbO2和Hb的含量. 将血氧饱和度SO2 = [HbO2]/[HbO2]+[Hb]代入(3)式, 可得OD与SO2的关系:式中,
$ {\varepsilon _{{\text{Hb}}{{\text{O}}_{2}}}} $ 和$ {\varepsilon _{{\text{Hb}}}} $ 随着波长的变化而不同, 当两者相等时为氧等消光波长, 不相等时为氧敏感波长. 通过计算氧等消光波长和氧敏感波长处的ODR[16], 可以得到ODR与SO2之间的线性关系:其中
$ {\text{O}}{{\text{D}}_{{\lambda _{\text{s}}}}} $ ,$ {\text{O}}{{\text{D}}_{{\lambda _{\text{i}}}}} $ 分别代表氧敏感波长和氧等消光波长处的OD,$ {\varepsilon _{{\lambda _{\text{i}}}}} $ 代表HbO2和Hb在氧等消光波长处的衰减系数,$ \varepsilon _{{\lambda _{\text{s}}}}^{{\text{Hb}}{{\text{O}}_{2}}} $ ,$ \varepsilon _{{\lambda _{\text{s}}}}^{{\text{Hb}}} $ 则为HbO2和Hb在氧敏感波长处的衰减系数. 根据推导得出的ODR与SO2之间的理论线性关系, 可通过计算血液的ODR值来实现血氧饱和度的测量. -
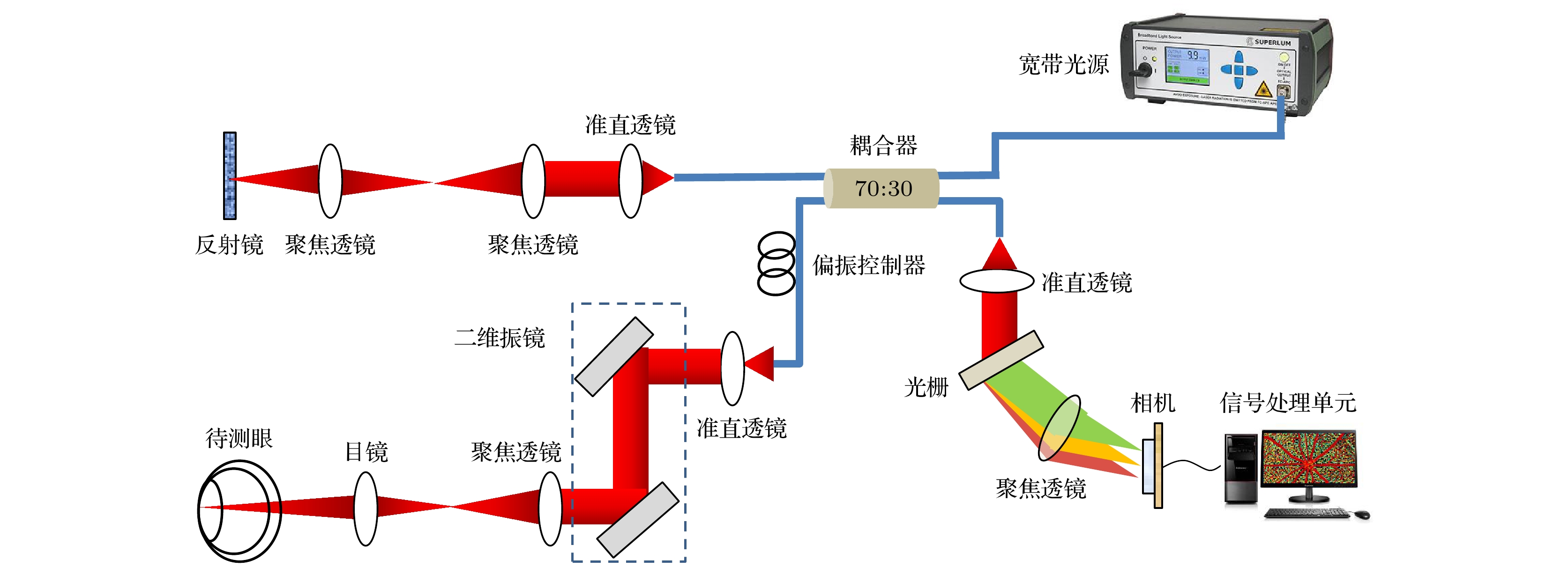
本实验使用的谱域OCT系统如图1所示, 系统的核心部件包括光源、参考臂、样品臂、光谱仪和相机. 光源为中心波长840 nm, 半高全宽100 nm的超辐射发光二极管宽带光源. 宽带光源的光通过耦合器分光后分别进入参考臂和样品臂; 参考臂中的光束经过反射镜反射返回, 而样品臂的光束在进入样品表面后携带样品信息返回. 两束光在耦合器处相遇形成干涉信号, 最终由光谱仪的线阵相机接收. 此外结合实验中被测眼的特点和光安全要求, 目镜选取焦距11 mm, 工作距离7 mm的透镜, 入瞳光功率约为1.2 mW. 关于本系统的其他详细描述可参考我们之前的工作[13].
系统采用步进式光栅扫描方案进行三维OCT体数据采集. 每组OCT体数据包含400个慢扫描位置(B-scan, Y方向), 每个位置重复扫描3次, 每个B-scan包含400个快扫描位置(A-scan, X方向). 数据采集过程耗时6 s, 对应视场为以视网膜视乳头为中心的2 mm × 2 mm区域.
-
研究选用10—12周龄的健康雄性C57BL/6J小鼠进行视网膜OCT成像实验, 动物购自浙江医学科学研究院. 在进行OCT扫描前, 采用腹腔注射1%戊巴比妥钠(0.01 mL/g)对小鼠进行麻醉, 并将其固定在定制的动物支架中, 以尽量减少因心跳和呼吸造成的成像干扰. 通过滴注2%托吡卡胺和2%盐酸苯肾上腺素扩瞳. 实验期间, 室温保持在约25 ℃, 并使用加热垫维持小鼠体温. 本研究所有实验流程均通过浙江大学实验动物管理与使用委员会批准(ZJU20220134).
-
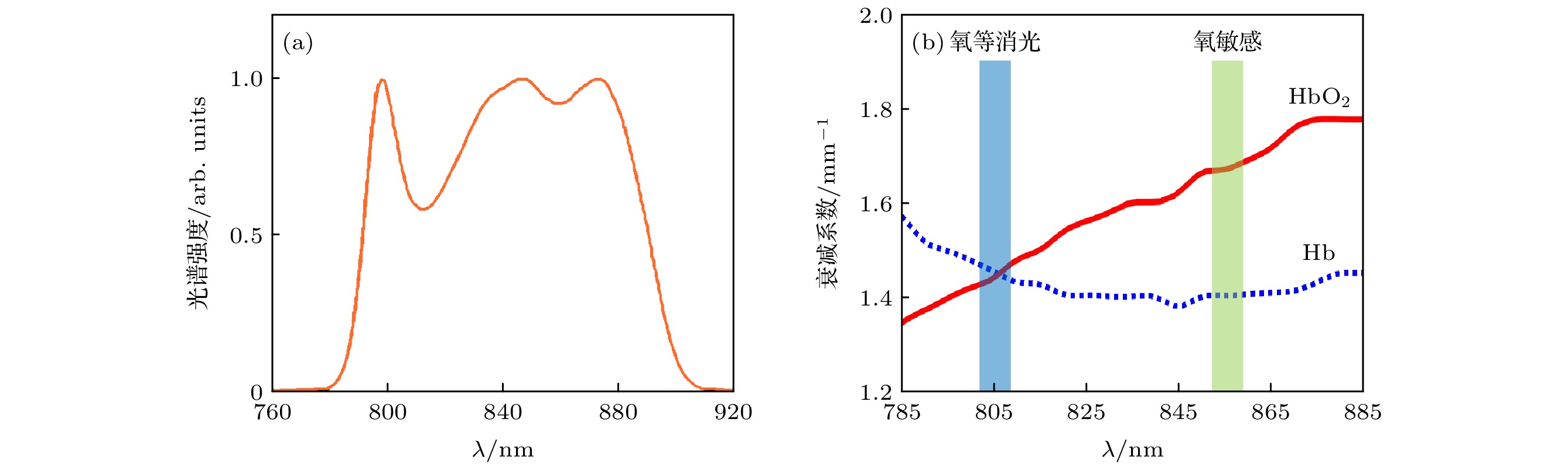
本研究采用的OCT光源中心波长为840 nm, 带宽为100 nm, 其光谱分布如图2(a)所示. 根据HbO2和Hb的衰减光谱(图2(b))以及光源的工作波段, 因HbO2和Hb在805 nm处具有相同的衰减系数故将805 nm(蓝色)选为氧等消光波长. 此外在光源工作波段内, 综合光源光谱强度与HbO2和Hb之间的衰减系数差异最终选取855 nm作为氧敏感波长.
-
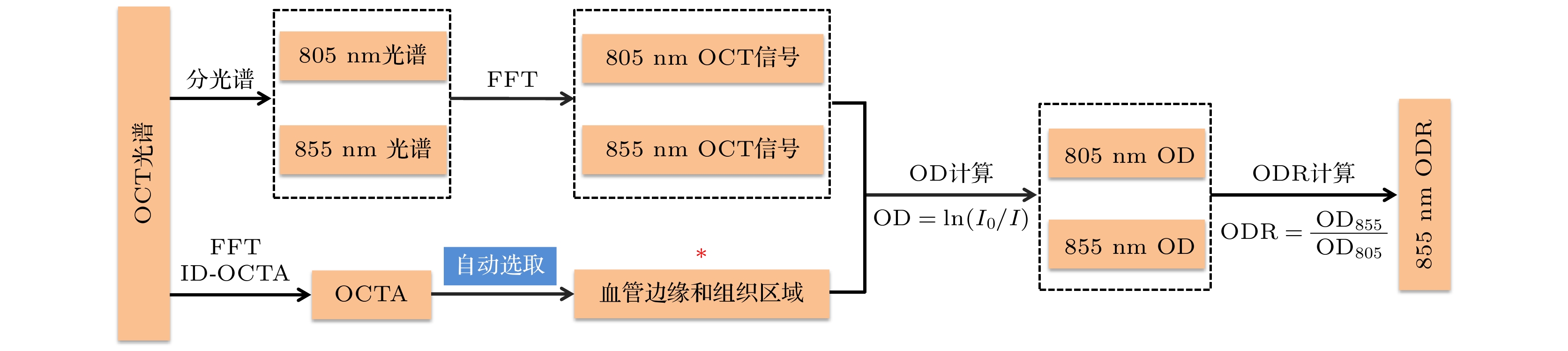
为了获取氧敏感波长(855 nm)和氧等消光波长(805 nm)处的光谱, 首先对OCT光源进行光谱校准, 确定每个波长对应的像素位置, 并在855 nm和805 nm的10 nm范围内进行分光谱. 随后依次对采样的光谱数据进行快速傅里叶变换(fast Fourier transform, FFT)得到对应波长的三维OCT强度, 流程如图3所示.
-
血氧饱和度的测量需要量化血管内血液对光的吸收或散射量, 在视网膜中表现为血管相对于周围无血管组织的光衰减度. 为了避免血管中心强反射的干扰, 选择血管边缘区域作为血管处的平均光强. 本研究利用OCTA毛细血管分辨能力的优越特性, 开发了自动识别血管边缘及相邻组织区域三维位置的算法, 其流程如图4所示. 在X-Y平面上(图4(a)), 首先利用基于逆信噪比和退相关的OCTA算法(OCTA based on inverse SNR and decorrelation features, ID-OCTA)[21]生成的表层(superficial vessel plexus, SVP)血管造影图(I), 通过大津法进行二值化处理, 得到的血管掩模图(II). 随后, 将该掩模与退相关值相映射, 生成SVP层的退相关映射图(III). 通过设置合适的阈值去除退相关值较低的毛细血管后生成大血管掩模(IV), 并通过边缘检测获取血管边缘(V). 血管周围组织区域(VIII)则通过对大血管掩模进行不同程度的膨胀后相减(VII)获得. 为了避免不同动静脉之间相互干扰以及信号质量对测量的影响, 仅选取以视乳头为中心, 内环和外环直径分别为0.6和1.8 mm的圆环区域内的血管边缘和组织区域(VI, IX)用于血氧测量. 在深度方向(Z方向)上, 选取血管上边界以下20 pixel的深度即SVP层用于ODR的计算, 如图4(b)所示. 以上全部流程可在Matlab平台通过自主编写的算法实现, 有效避免了人为主观干预, 实现了从输入视网膜结构图到输出血管和周围组织区域三维位置的全自动处理, 保证了识别过程的客观性和高效性.
-
根据自动识别的每根血管的边缘和组织区域在OCT三维结构中的位置, 计算血管和组织区域处的平均光强, 可以得到视网膜内每根大血管在805 nm和855 nm处的OD以及对应的ODR. 值得说明的是, 紧邻视网膜动静脉的组织区域毛细血管覆盖显著降低, 再结合HbO2和Hb在近红外一区较低的衰减特性, 可显著减少毛细血管对组织光强测定的干扰.
-
血氧饱和度SO2与ODR呈线性关系, 具体表示为
其中a和b为常数. 为了将ODR转换为血氧饱和度, 采用类似于Hardarson等[25]所用的标定方法, 基于动脉(96%)和静脉(54%)的平均氧饱和度, 选用两组研究对象中所有动脉和静脉的平均ODR值用于求解(6)式中的a和b值, 并将其用于ODR转换血氧饱和度中.
-
动静脉的平均ODR值以及平均血氧饱和度均以均值±标准差表示. 使用双尾配对样本t检验对动静脉的ODR值进行比较, P<0.05表示具有统计学显著性差异.
-
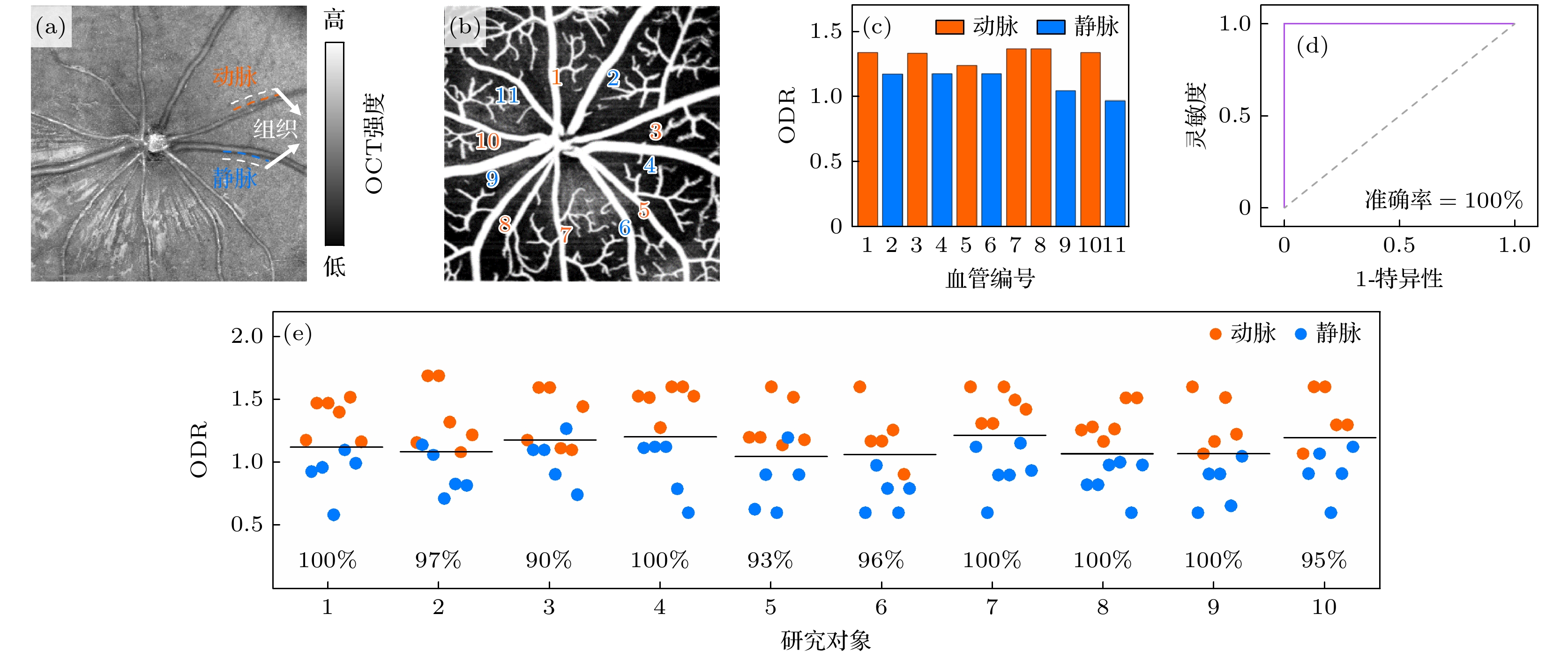
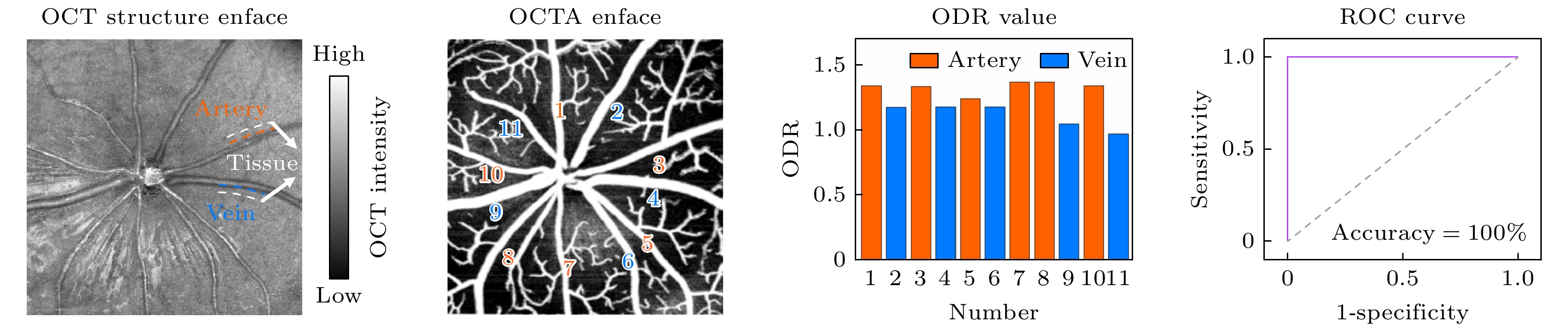
在小鼠视网膜SVP层OCTA图(图5(b))的引导下, 分别在氧等消光波长(805 nm)和氧敏感波长(855 nm)处计算了血管相对于周围组织区域的OD(图5(a)), 得到每根大血管的ODR (图5(c)). 结果表明, 动脉的ODR值(1.33±0.05)一致高于静脉的ODR值(1.11±0.09), P < 0.01. 基于血管的ODR值进行动静脉分类, ROC分析的分类准确率达100% (图5(d)). 本研究通过统计22组研究对象的血管ODR数据, 也进一步验证了这一结果(动脉(n = 129): 1.41±0.27, 静脉(n = 112): 0.92±0.17). 动脉和静脉的ODR值具有显著性统计差异(P < 0.01), 基于ODR值进行动静脉分类的平均准确率可达96.7%. 其中代表性的10组视网膜动静脉ODR值以及对应的动静脉分类准确率依次在图5(e)中展现. 综上所述, 基于ODR的自动化分析在小鼠视网膜动静脉分类中表现出了较高的准确性, 验证了近红外OCT对于视网膜动脉和静脉分类的可行性.
-
基于血氧饱和度与ODR之间的线性关系, 利用两组动静脉的ODR值进行标定, 标定系数
$ a = 79.2 $ ,$ b = - 17.3 $ , 血氧饱和度SO2的转换方程为$ \text{S}\text{O}_2=79.2\times\text{ODR}-17.3 $ . 根据标定结果, 计算22组数据中所有动静脉的血氧饱和度(动脉: n = 129, 静脉: n = 112), 动静脉平均血氧饱和度分别为94%±21%, 56%±13%, 符合正常的视网膜动静脉血氧饱和度范围. 代表性的10组视网膜的平均动脉血氧饱和度, 静脉血氧饱和度见表1. -
视网膜是代谢最活跃的组织之一, 充足的氧气供应对于维持其功能和健康至关重要. 精确测量视网膜的血氧饱和度对多种眼部疾病的研究、早期诊断及治疗监测具有重要意义. 本研究提出了一种基于OCTA引导的近红外一区视网膜血氧饱和度自动测量技术. 该方法利用OCTA生成的三维血流图自动识别血流区域和周边组织区域的三维位置, 并选用近红外波段805 nm和855 nm作为氧等消光波长和氧敏感波长. 基于855 nm/805 nm光密度比值与血氧饱和度的线性关系, 实现了视网膜动脉和静脉的精确分类以及血氧饱和度的测量.
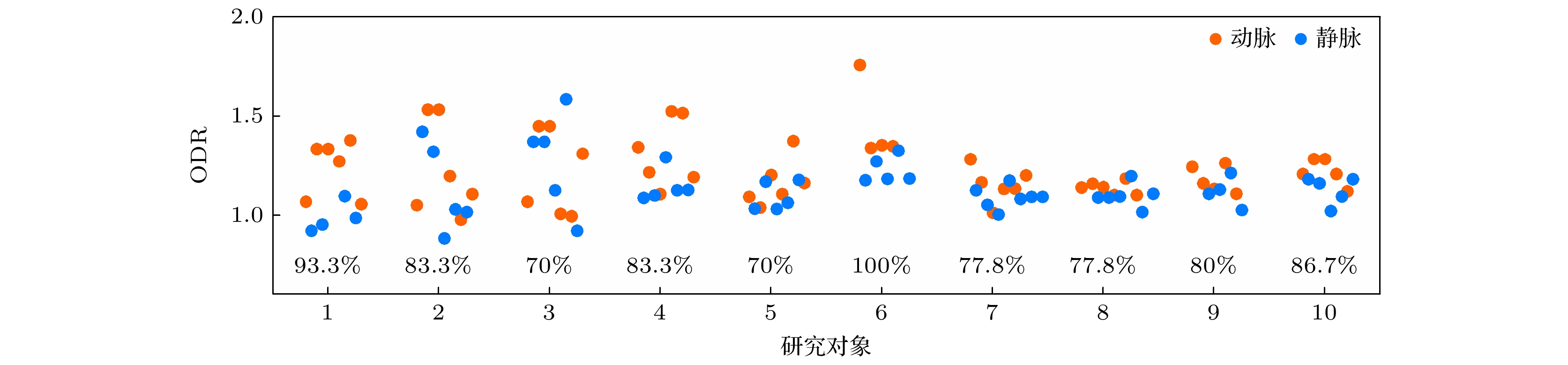
与现有的视网膜血氧测量方法相比, 本文开发的技术具有明显优势. 首先, 利用OCTA单根毛细血管的高分辨率特点, 实现了血管和周边组织区域三维位置的自动提取. 这种自动化方法相较于传统手动选取方式[15,17], 不仅消除了主观因素和中深层毛细血管的干扰, 还显著提高了处理效率和分类准确性. 因此, 视网膜动静脉分类准确率由82.1%提升至96.7%, 成功实现了动静脉分类的高效自动化处理, 其中代表性的手动选取计算结果如图6所示. 其次, 近红外光对对眼部的刺激较少, 减小了因血管直径、血流速度及血氧波动对测量结果产生的干扰[13], 提高了测量的稳定性. 另外, 近红外OCT以其穿透深度深, 成像清晰等优点已广泛应用于临床, 基于该波段的视网膜血氧测量更便于系统集成和临床推广.
然而, 本研究提出的视网膜血氧测量方法仍然存在一定的局限性. 在理论方面, OD的计算是基于朗伯比尔定律来计算的, 该定律主要适用于光的透射[26]. 而视网膜内血液及周围组织的散射特性未被充分考虑. 因此需要进一步研究更准确地光密度估算方法, 以适合血液在OCT低相干超辐射二极管照射下的光背向散射情景. 另外, 使用该方法进行血氧测量是基于光衰减的间接估计, 需要经过校准才能实现准确测量. 然而, 设备光路设计和传感器灵敏度的差异可能导致校准不一致, 影响结果的可重复性和跨设备比较[8].
尽管面临挑战, 近红外OCT血氧测量具有无创、高信噪比和深度分辨的优点, 特别适合用于视网膜相关疾病的早期诊断和监测. 随着技术的进一步发展和算法的优化, 近红外OCT血氧测量在眼科疾病诊断和管理中的应用前景广阔.
-
本研究提出了一种基于近红外OCT系统的自动视网膜血氧测量算法, 利用OCTA生成的三维血流图自动识别血管以及周围组织区域的三维位置, 通过855 nm/805 nm 波长处的ODR计算, 实现了小鼠视网膜动脉和静脉的分类, 平均准确率为96.7%. 该方法还通过标定实现了视网膜血氧的测量, 平均动脉血氧饱和度, 静脉血氧饱和度均符合正常的血氧饱和度范围. 近红外OCT视网膜血氧测量在眼科疾病的早期诊断、病情评估及疗效监测中具有广阔的应用前景.
基于光学相干血流造影引导的近红外一区视网膜血氧饱和度测量
Near-infrared band I retinal oximetry guided by optical coherence tomography angiography
-
摘要: 精确测量视网膜血氧饱和度(oxygen saturation, SO2)可为糖尿病视网膜病变、青光眼及视网膜静脉阻塞等眼部疾病提供有价值的早期指示. 虽然可见光光学相干层析成像能够通过光谱拟合直接获取SO2, 但受限于可见光的刺激性及其对视网膜生理状态的影响. 近红外一区对眼部的刺激较小, 尽管血红蛋白在此波段的吸收效应较弱, 但其散射特性也与SO2相关. 基于此, 本研究提出了一种光学相干血流造影(optical coherence tomography angiography, OCTA)引导的近红外一区视网膜血氧饱和度测量技术, 利用氧敏感波长(855 nm)与氧等消光波长(805 nm)光衰减的比值结合标定实现了SO2的测量. 该方法利用OCTA生成的三维血流图自动识别血管以及周围组织区域的三维位置, 避免了手动选取区域引起的测量误差, 将视网膜动静脉分类的平均准确率由82.1%提高到96.7%. 测量结果显示, 动脉和静脉的平均血氧饱和度分别为94% ± 21%, 56% ± 13%, 符合正常视网膜血氧饱和度范围. 该方法有效提升了测量的准确性和效率, 为眼科疾病的早期诊断、病情评估及疗效监测提供了可靠的工具, 具有广阔的应用前景.Abstract: Accurate measurement of retinal blood oxygen saturation (SO2) provides valuable early insights into the pathophysiology of ocular diseases such as diabetic retinopathy, glaucoma, and retinal vein occlusion. Visible-light optical coherence tomography (OCT) can directly measure SO2 through spectral fitting, but its application is limited due to the irritability of visible light and its influence on the physiological state of the retina. Near-infrared band I (NIR-I) causes less ocular stimulation. Even though the hemoglobin absorption effect is weaker in this region, its scattering property is also related to SO2. According to this principle, we propose a novel optical coherence tomography (OCTA) guided NIR-I technique for retinal blood oxygen saturation measurement. This method is used to calculate SO2 through calibrating the optical density ratio (ODR) of oxygen-sensitive wavelength (855 nm) to isosbestic wavelength (805 nm). By utilizing the three-dimensional (3D) blood flow maps generated by the OCTA, this technique can automatically identify retinal vessels and surrounding tissue regions, thereby minimizing the errors caused by manual selection. Consequently, the classification accuracy of arteries and veins increases from 82.1% to 96.7%. The calibrated average retinal blood oxygen saturation is 94%±21% for arteries and 56%±13% for veins, which aligns with normal physiological range. The representative result of artery-vein classification is presented in the following figure. This method greatly improves the accuracy and efficiency of measurement, and provides a reliable tool for early diagnosis, disease assessment, and treatment monitoring of ophthalmic diseases, which has broad application prospects.
-

-
图 2 (a)近红外宽带光源光谱强度图; (b) HbO2和Hb在近红外波段的衰减光谱, 数据来源于Nienke等[24]的研究. 蓝色和绿色矩形分别代表氧等消光波长805 nm, 氧敏感波长855 nm
Figure 2. (a) Spectral intensity of the near-infrared (NIR) SLD light source; (b) extinction spectra of HbO2 and Hb at NIR band, and the data from the study of Nienke et al.[24]. The blue and green rectangles represent the oxygen-isosbestic wavelength (around 805 nm) and oxygen-sensitive wavelength (around 855 nm), respectively.
图 4 自动识别血管边缘和组织区域三维位置算法流程 (a)自动识别血管边缘和组织区域X-Y平面上位置, 其中(I), (II), (III)分别为小鼠视网膜SVP层血管的造影图, 掩模图和退相关系数图, (IV), (V)分别为小鼠视网膜SVP层大血管的掩模图和轮廓图, (VI)代表了用于ODR计算的血管区域, (VII), (VIII)分别为不同膨胀系数(10, 8)的大血管膨胀图和大血管周围组织区域图, (IX) 代表了用于ODR计算的组织区域. (b)小鼠视网膜血流断层示意图, 其位置由(I)中白色虚线示意, 黄色虚线表示深度方向上用于ODR计算的区域
Figure 4. Workflow of the algorithm for automatically identifying the 3D locations of vascular edges and adjacent tissues: (a) Automatic identification of vessel edges and tissue regions in the x-y plane, where (I)—(III) show the OCTA image, vascular mask, and decorrelation map of the mouse retina SVP, respectively, (IV) and (V) depict the mask and edge map of large vessels in the SVP, respectively, (VI) represents the vascular region used for ODR calculation. (VII) and (VIII) display images of the dilated large vessels with different dilation coefficients (10, 8) and the surrounding tissue region, (IX) shows the tissue region used for ODR calculation. (b) Representative tomogram of mouse retinal blood flow, with its position indicated by the white dashed line in (I), the yellow dashed lines in panel (b) represent the depth range used for the ODR calculation.
图 5 小鼠视网膜动静脉分类结果 (a) OCT均值投影图, 白色虚线为血管周围组织区域示意; (b) SVP层OCTA图; (c)图(a), (b)中大血管对应的ODR值; (d) ODR动静脉分类的ROC分析曲线; (e)代表性的10组研究对象的所有大血管的ODR值, 黑色实线表示该组中所有大血管ODR值的平均值, 图中百分比数据代表各组相应的动静脉ROC分类准确率, 所有图中红色代表动脉, 蓝色代表静脉
Figure 5. Classification results of arteries and veins in mouse retina: (a) Mean projection of OCT, with the white dashed lines indicating the tissue regions around vessels; (b) SVP OCTA image; (c) ODR values of large vessels shown in panels (a) and (b); (d) ROC analysis curve of the ability of ODR index to classify the arteries and veins; (e) ODR values of all large vessels in the representative ten subjects, with the black solid line representing the average ODR value for each subject, the percentage data in the figure represents the classification accuracy of the corresponding arteriovenous ROC in each group, red represents arteries, and blue represents veins in all panels.
图 6 手动选取血管和组织区域得到的小鼠视网膜动静脉分类代表性结果. 图中百分比数据代表各组相应的动静脉ROC分类准确率
Figure 6. Representative arteriovenous classification results in mouse retina based on manual selection of vascular and tissue regions. the percentage data in the figure represents the classification accuracy of the corresponding arteriovenous ROC in each group.
表 1 近红外OCT视网膜血氧测量代表性结果
Table 1. Representative results of NIR OCT retinal oximetry.
研究对象 #1 #2 #3 #4 #5 #6 #7 #8 #9 #10 动脉血氧/% 91±12 90±21 92±18 99±9 91±16 90±20 98±10 91±11 90±18 91±18 静脉血氧/% 57±7 51±14 54±15 58±19 50±19 42±12 57±16 51±12 43±13 57±15 -
[1] Hammer M, Vilser W, Riemer T, et al. 2009 Graefes. Arch. Clin. Exp. Ophthalmol. 247 1025 doi: 10.1007/s00417-009-1078-6 [2] Hardarson S H, Stefánsson E 2012 Br. J. Ophthalmol. 96 560 doi: 10.1136/bjophthalmol-2011-300640 [3] Olafsdottir O B, Hardarson S H, Gottfredsdottir M S, Harris A, Stefánsson E 2011 Invest. Ophthalmol. Vis. Sci. 52 6409 doi: 10.1167/iovs.10-6985 [4] Hardarson S H, Gottfredsdottir M S, Halldorsson G H, et al. 2009 Invest. Ophthalmol. Vis. Sci. 50 5247 doi: 10.1167/iovs.08-3117 [5] Hardarson S H, Stefánsson E 2012 Acta Ophthalmol. 90 466 doi: 10.1111/j.1755-3768.2011.02109.x [6] Hardarson S H, Stefánsson E 2010 Am. J. Ophthalmol. 150 871 doi: 10.1016/j.ajo.2010.06.020 [7] Eliasdottir T S 2018 Acta Ophthalmol. 96 1 doi: 10.1111/aos.13932 [8] Garg A K, Knight D, Lando L, Chao D L 2021 Transl. Vis. Sci. Technol. 10 5 doi: 10.1167/tvst.10.2.5 [9] 高椿明, 先永利, 戴云 2017 激光与光电子学进展 54 45 Gao C M, Xian Y L, Dai Y 2017 Laser Optoelectron. Prog. 54 45 [10] Yi J, Wei Q, Liu W Z, Backman V, Zhang H F 2013 Opt. Lett. 38 1796 doi: 10.1364/OL.38.001796 [11] Chen S Y, Shu X, Nesper P L, Liu W Z, Fawzi A A, Zhang H F 2017 Biomed. Opt. Express 8 1415 doi: 10.1364/BOE.8.001415 [12] Pi S H, Camino A, Cepurna W, Wei X, Zhang M, Huang D, Morrison J, Jia Y L 2018 Biomed. Opt. Express 9 2056 doi: 10.1364/BOE.9.002056 [13] Liu K Y, Zhu T P, Gao M Q, Yin X T, Zheng R, Yan Y, Gao L, Ding Z H, Ye J, Li P 2023 Biomed. Opt. Express 14 1670 doi: 10.1364/BOE.485940 [14] Faber D J, Aalders M C G, Mik E G, et al. 2004 Phys. Rev. Lett. 93 028102 doi: 10.1103/PhysRevLett.93.028102 [15] Kagemann L, Wollstein G, Wojtkowski M, et al. 2007 J. Biomed. Opt. 12 041212 doi: 10.1117/1.2772655 [16] Ye Y F, Jiang H, Shen M X, Lam B L, Debuc D C, Ge L L, Sehi M, Wang J H 2012 Clin. Ophthalmol. 6 2085 doi: 10.2147/OPTH.S37774 [17] Son T, Alam M, Kim T H, Liu C G, Toslak D, Yao X C 2019 Exp. Biol. Med. 244 813 doi: 10.1177/1535370219850791 [18] Huang D, Swanson E A, Lin C P, et al. 1991 Science 254 1178 doi: 10.1126/science.1957169 [19] 唐弢, 赵晨, 陈志彦, 李鹏, 丁志华 2015 物理学报 64 174202 doi: 10.7498/aps.64.174202 Tang T, Zhao C, Chen Z Y, Li P, Ding Z H 2015 Acta Phys. Sin. 64 174202 doi: 10.7498/aps.64.174202 [20] Deng X F, Liu K Y, Zhu T P, Guo D Y, Yin X T, Yao L, Ding Z H, Ye J, Li P 2022 Biomed. Opt. Express 13 3615 doi: 10.1364/BOE.459632 [21] Huang L Z, Fu Y M, Chen R X, et al. 2019 IEEE Trans. Med. Imaging 38 2695 doi: 10.1109/TMI.2019.2910871 [22] Li H K, Liu K Y, Yao L, Deng X F, Zhang Z Y, Li P 2021 J. Innov. Opt. Health. Sci. 14 2130001 doi: 10.1142/S1793545821300019 [23] Zhang Y M, Li H K, Cao T T, Chen R X, Qiu H X, Gu Y, Li P 2021 Quant. Imaging Med. Surg. 11 895 doi: 10.21037/qims-20-868 [24] Bosschaart N, Edelman G J, Aalders M C G, van Leeuwen T G, Faber D J 2014 Lasers Med. Sci. 29 453 doi: 10.1007/s10103-013-1446-7 [25] Hardarson S H, Harris A, Karlsson R A, et al. 2006 Invest. Ophthalmol. Vis. Sci. 47 5011 doi: 10.1167/iovs.06-0039 [26] Delori F C 1988 Appl. Opt. 27 1113 doi: 10.1364/AO.27.001113 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: