-
离子迁移谱(ion mobility spectrometry, MS)是20世纪70年代出现的一种痕量物质检测技术,具有响应速度快、灵敏度高、操作简单等特点,广泛应用于爆炸物[1]、毒品[2]和化学毒剂的快速现场检测[3]及生物医学[4-5]、食品安全[6-7]等领域。
IMS是利用大气压下带电粒子在电场中迁移速度的差异来实现物质表征的一种痕量检测技术。根据带电粒子的电荷极性,分为正、负离子检测模式。含有硝基官能团的爆炸物,如三硝基甲苯(TNT),由于硝基基团的高电负性,易发生负电荷转移生成负离子产物,因此通常采用负离子模式检测[8-10];常见毒品,如甲基苯丙胺(methamphetamine,MA),由于具有高质子亲和势,易发生质子转移生成正离子产物,通常采用正离子模式检测[11]。此外,部分化学毒剂(如芥子气)在正、负离子模式下检测均有响应[3],同时检测正、负离子可进一步提高检测的准确性,减少误检或漏检。
目前,IMS同时检测正、负离子的技术方案有2种[12]。一种是通过快速电场切换来实现。2022年,Li等[13]和Hitzemann等[14]开发了正、负极性切换时间分别为10 、12 ms的IMS检测仪,采用单迁移管和单检测系统,通过电场快速切换可实现正、负离子的循环检测,属于一种“伪”正、负离子同时检测。另一种是利用双迁移管来实现。2020年,Lippmann等[15]研制了一种双场开关IMS仪,将2个迁移管轴向放置,共用1个X射线电离源,使用2套独立的控制和检测系统分别检测正、负离子信号,从而实现正、负离子同时检测。然而,双迁移管轴向放置时,离子源方向需要与迁移管方向正交,反应区的体积较小,样品离子化的距离和时间都会弱于传统的轴向放置电离源。
本研究拟提出一种双迁移管平行放置方案,使用非放射性电晕放电电离源产生反应离子,结合开发的小型双路离子门脉冲模块,研制一种电晕放电双迁移管离子迁移谱仪(dual-drift tube ion mobility spectrometer, DDT-IMS),通过调节电晕放电电压,产生更多的反应离子,从而弥补因样品分流导致的灵敏度损失。同时,优化DDT-IMS气路单元的气体流速、迁移管温度和热解吸温度等关键参数,并利用MA、黑索金(RDX)和2,4-二氨基-6-硝基甲苯(2,4-DANT)考察设备的检测性能。
-
DDT-IMS仪含有2个独立的迁移管,分别用于检测正、负离子。迁移管电离源各自产生的正、负离子在电场作用下迁移到反应区。当气态样品被引入到反应区时,会与这些反应离子碰撞发生离子-分子反应。
正离子模式下,常见的反应离子为
$ {{\mathrm{H}}}^{+}{\left({{\mathrm{H}}}_{2}{\mathrm{O}}\right)}_{n} $ ,反应方程式示于式(1)、(2):其中,M为待测物分子,其质子亲和势(proton affinity, PA)大于水分子,因此,可以发生质子转移反应生成产物离子
$ {\mathrm{M}}{{\mathrm{H}}}^{+}{\left({{\mathrm{H}}}_{2}{\mathrm{O}}\right)}_{n-x} $ 。负离子模式下,反应主要涉及负电荷转移。以负反应离子
$ {{\mathrm{O}}}_{2}^{-}{\left({{\mathrm{H}}}_{2}{\mathrm{O}}\right)}_{n} $ 为例,反应方程式示于式(3):式中,M为电负性高于O2分子的待测物,产物离子为
$ {{\mathrm{MO}}}_{2}^{-}{\left({{\mathrm{H}}}_{2}{\mathrm{O}}\right)}_{n-x} $ 。产物离子在离子门脉冲作用下进入迁移区,并沿着电场方向迁移,离子的迁移速度示于式(4):
其中,Vd为离子迁移速度,K为离子迁移率,E为电场强度。K与分子的结构、质量、碰撞截面、环境湿度等因素有关,可以进一步归一化为约化迁移率K0:
式中,P和T分别为实验过程中的大气压强和温度;P0和T0分别为标准大气压强和标准温度;K0是与离子质荷比和碰撞截面相关的函数,根据K0的差异,可实现物质的分析鉴定。
-
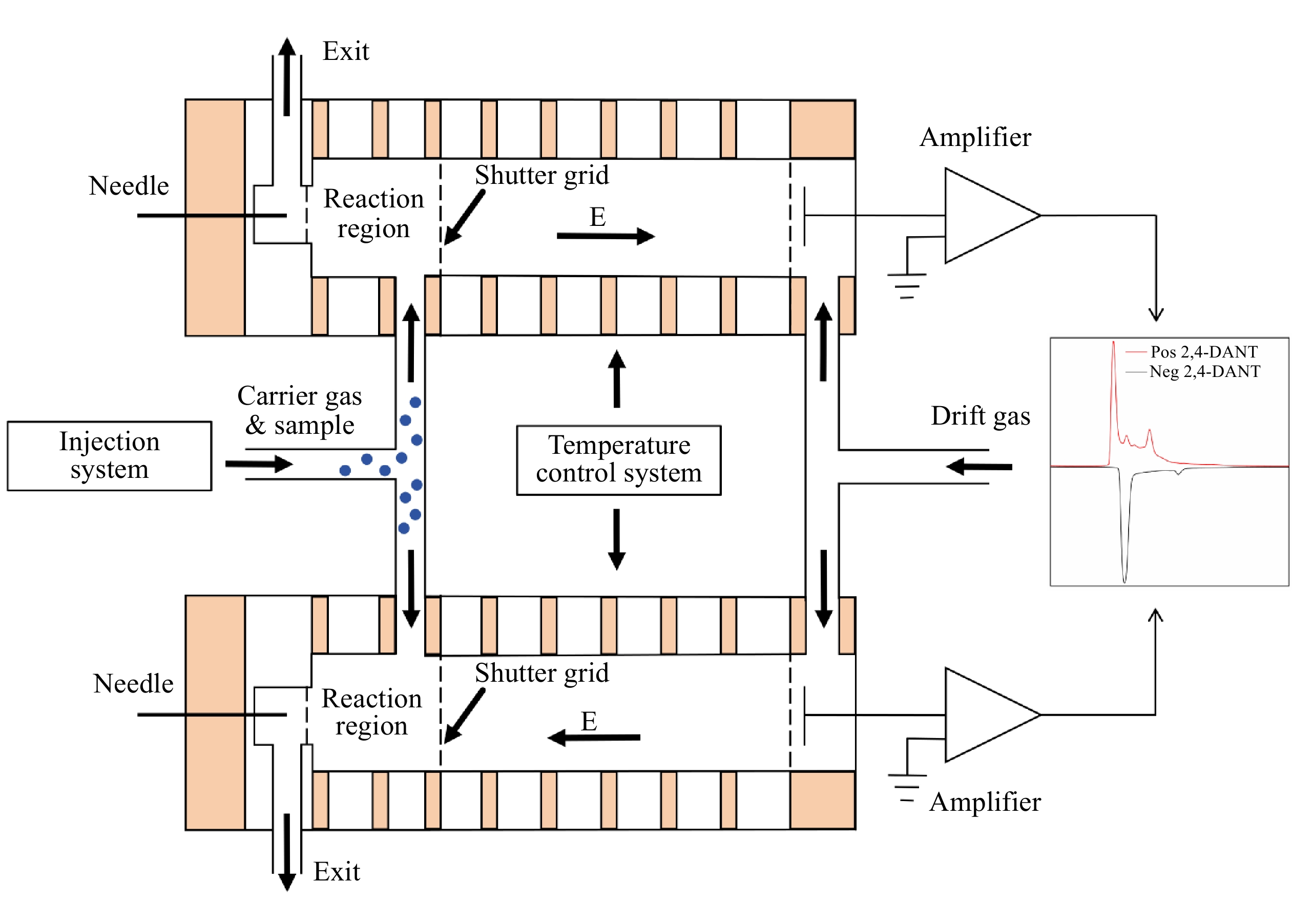
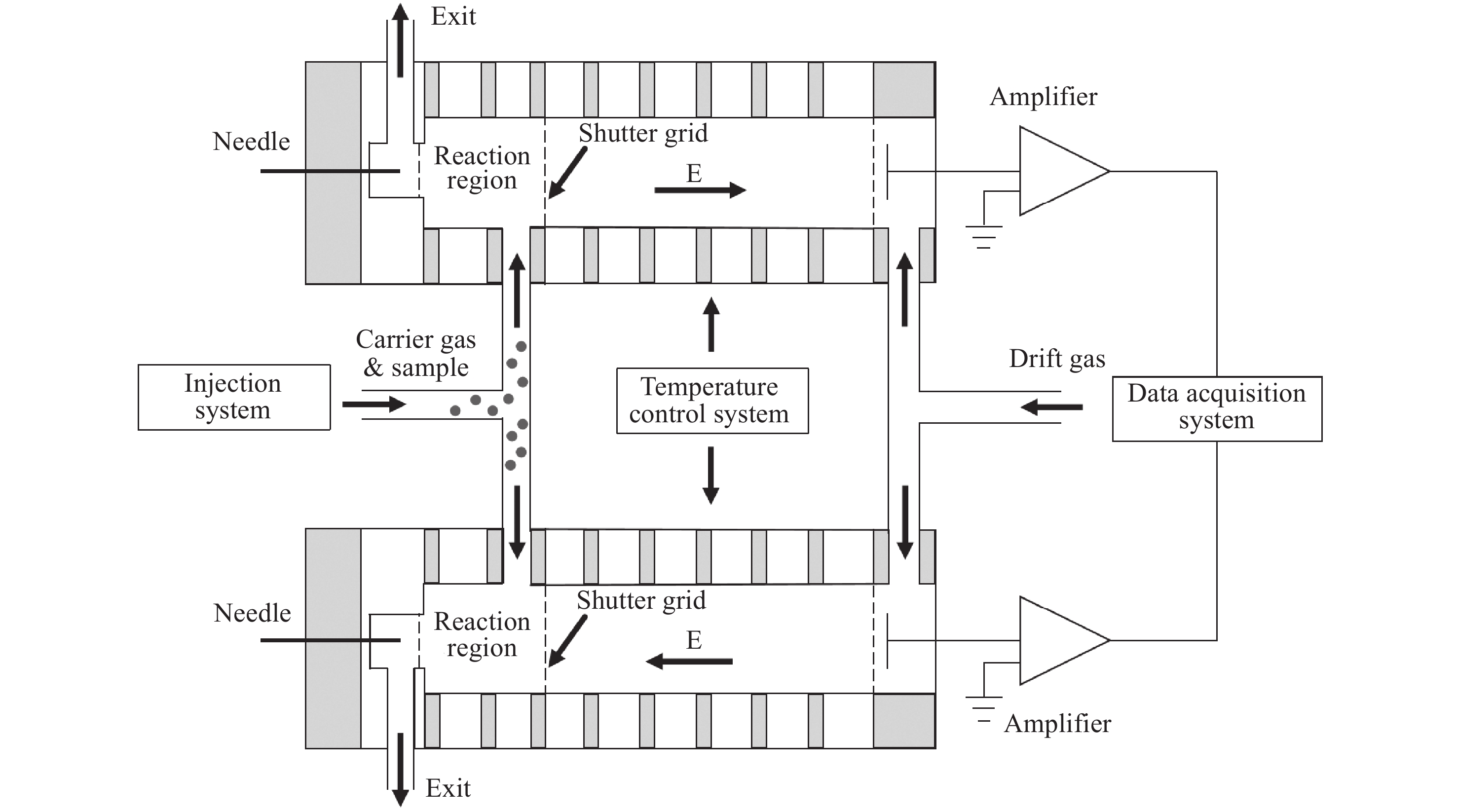
DDT-IMS仪结构示意图示于图1,由2个平行放置的迁移管组成,每个迁移管包括电离区、反应区、离子门、漂移区和数据采集系统。
DDT-IMS仪采用电晕放电电离源,该电离源利用阳极与阴极之间的电势差,使阳极附近空气发生电离产生极性不同的反应离子[16-17]。反应区和迁移区由金属电极环和绝缘环依次堆叠构成,金属环上采用高精度电阻分压的方式产生均匀电场。反应区和迁移区之间安装有Bradbury-Nielson (BN)型离子门,在离子门控制脉冲作用下周期性打开和关闭。离子门开启时,反应离子和产物离子在均匀电场作用下进入迁移区,并向法拉第板迁移。法拉第板收集到的电流信号经电流放大器放大后,转化成相应幅值的电压信号进入数据采集系统处理。为使迁移管稳定工作,设计了一套温度控制范围为25~150 ℃的加热保温装置。经保温处理后的迁移管置于金属盒中,以屏蔽环境中的电磁干扰。
DDT-IMS仪的迁移气和载气均采用经分子筛和活性炭干燥净化的洁净空气。在空气泵的驱动下,迁移气从末端进入迁移管,产生反流碰撞气体。载气导入到进样系统,携带样品经三通阀分2路分别送入2个迁移管的反应区。每条气路均配有独立的流量调节阀门和流量传感器,以实时监测和调节气体流速。
DDT-IMS仪实物图示于图2,2个迁移管平行并排放置,分别在正、负离子模式下检测。热解吸装置放置在迁移管下方,并通过聚四氟三通阀与迁移管相连。检测爆炸物或毒品的具体步骤为:首先将样品放置于采样布上,随后通过滑轨将采样布推入热解吸装置中,当检测到采样布完全进入热解吸装置后,载气电磁阀关闭,高温加热板开始加热采样布,将附着在采样布上的爆炸物或毒品样品转化为气态中性分子。当热解吸时间达到设定阈值后,载气电磁阀打开,气态样品分子在载气作用下通过三通阀分别进入2个迁移管,在反应区完成与反应离子的反应。除热解吸装置外,离子门控模块、温控电路和数据采集电路均放置在迁移管下方,以减小仪器体积,实现DDT-IMS仪的小型化和集成化。
-
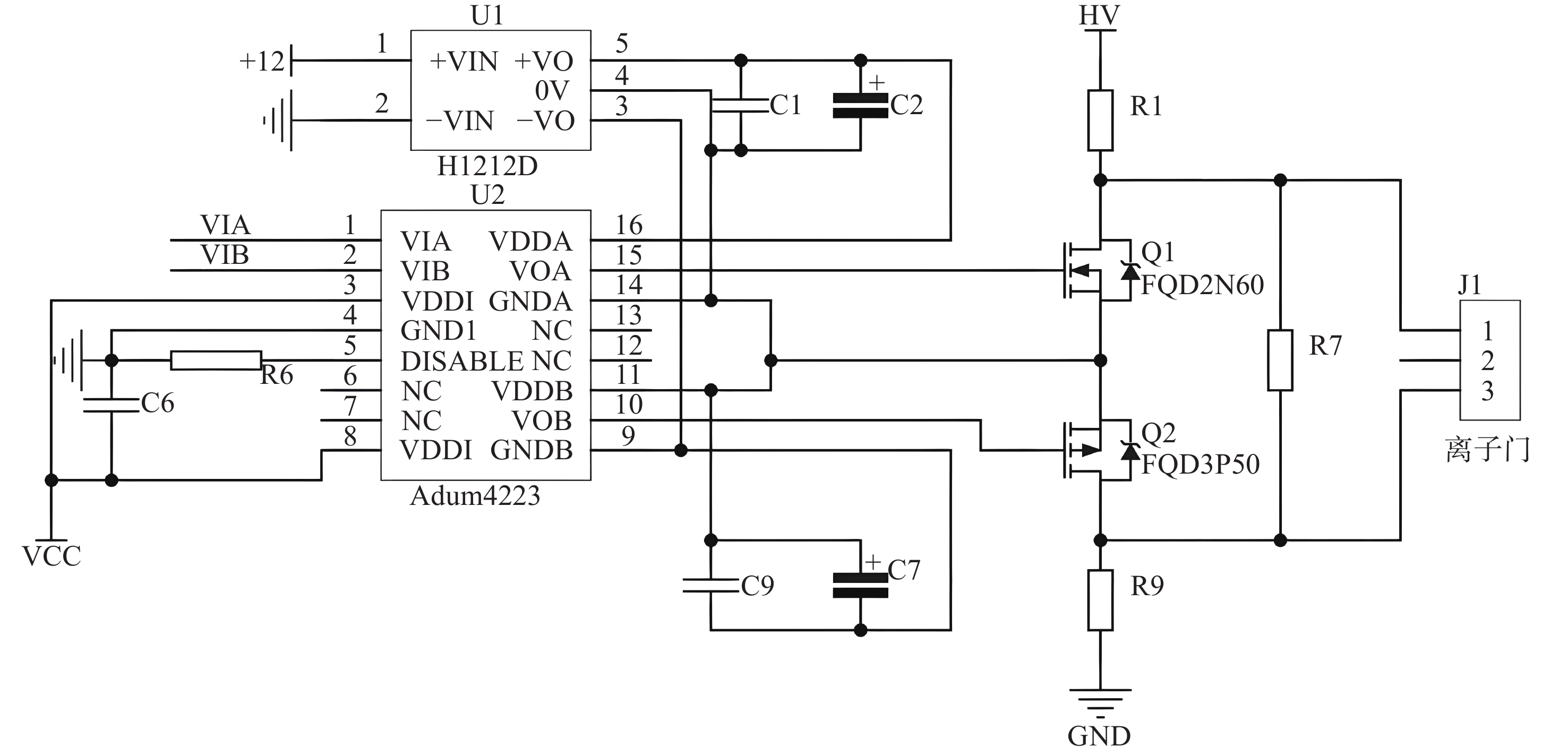
BN型离子门由2组平行的金属丝相间绕制而成,通过施加在金属丝上的脉冲电压来控制离子门的通断:当2组金属丝上的电势相同时,离子门打开,离子可以通过;当金属丝上的电势不同时,离子门关闭,离子被截止。因此,离子门控的脉冲电压需要较快的上升沿和下降沿,避免上升沿和下降沿过宽导致离子谱峰出现拖尾现象。由于离子门在迁移管中所处的电势较高,约为3 000 V,该脉冲电源需具备高压浮置和隔离保护功能,但常规商业化脉冲电源往往难以满足需求。基于此,本研究开发了小型化离子门控制模块,为DDT-IMS提供双路脉冲控制电压。
离子门控制模块选用LM555芯片与外围电路组成多谐振荡器来产生固定频率的脉冲信号,信号宽度可由单稳态触发器74HC123芯片调节。调节后的信号通过半桥电路控制金属-氧化物半导体场效应管(MOSFET)的通断,产生2路离子门高压脉冲控制信号。半桥电路主要由隔离式半桥驱动器和2个MOSFET组成,原理图示于图3。其中,MOSFET为N沟道场效应管FQD2N60和P沟道场效应管FQD3P50,其栅极驱动电压需大于10 V,触发器输出的5 V电压信号不足以驱动MOSFET,因而需要半桥驱动器来匹配触发器74HC123的输出电压与MOSFET栅极驱动电压。半桥驱动器选用亚德诺半导体公司生产的ADUM4223芯片,芯片输入端与触发器输出的5 V电压信号兼容,输出电压范围为4.5~18 V,能够驱动MOSFET的导通。经测试,该模块输出脉冲幅值为200 V,脉冲频率和宽度可调。当离子门开启时间为200 μs时,离子门脉冲下降沿宽度为80 ns,占离子门打开时间的0.04%;上升沿时间较长,为2.88 μs,占开门时间的1.44%,可满足DDT-IMS的使用需求。
-
0.1 g/L 2,4-DANT、RDX:溶于乙腈溶液,美国AccuStandard公司产品;0.1 g/L MA:溶于甲醇溶液,美国Cerilliant公司产品;甲醇:分析纯,上海阿拉丁公司产品;利用甲醇为溶剂对样品进行逐级稀释,得到不同浓度的实验样品。
-
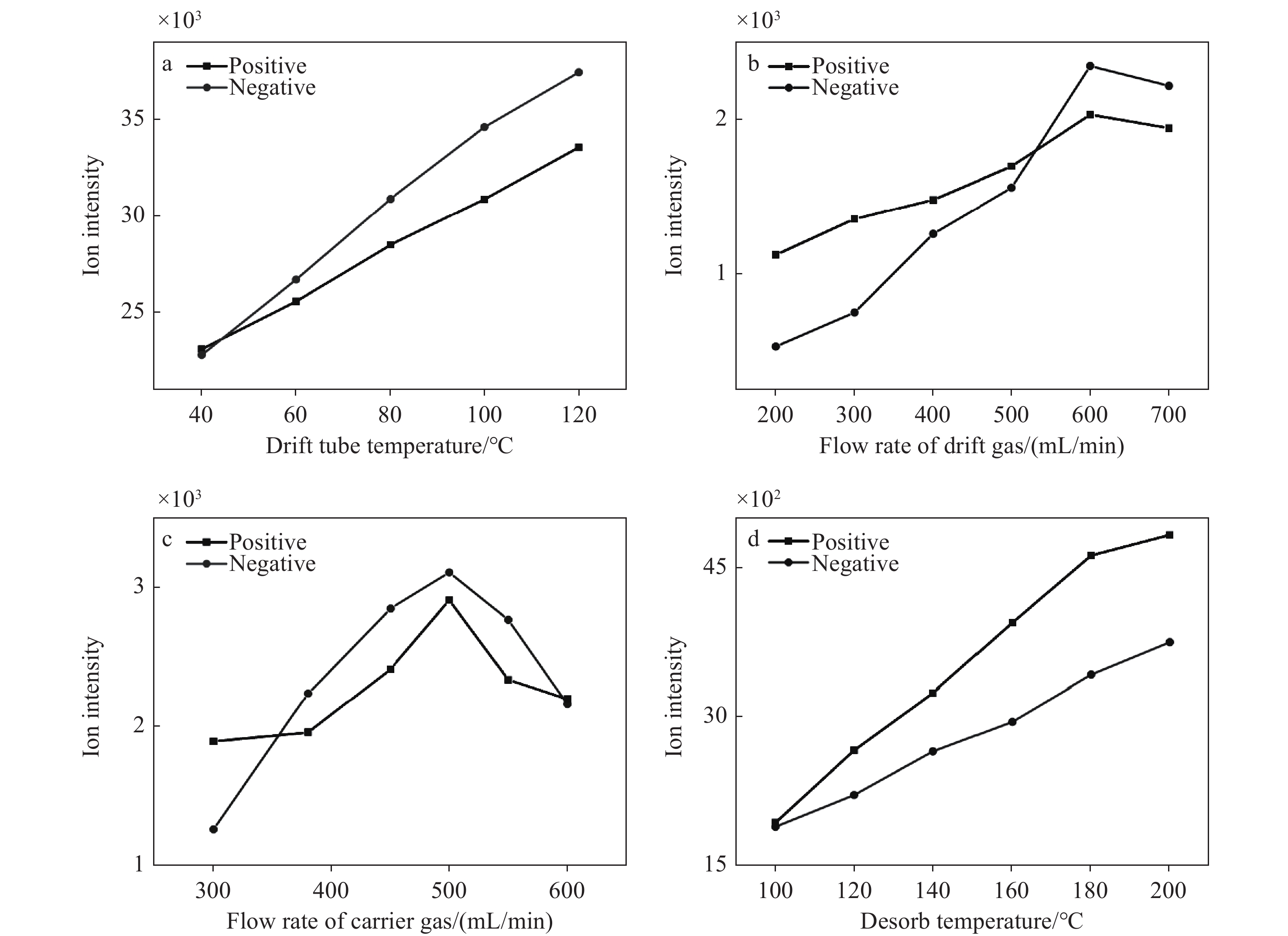
在IMS检测过程中,迁移管温度会影响检测分辨率[18]、离子迁移率和探测灵敏度[19-20],本实验考察了40~120 ℃迁移管温度下反应离子信号强度的变化情况,示于图4a。随着迁移管温度的升高,反应离子峰强度逐渐增加。当迁移管温度为120 ℃时,反应离子峰信号最强。然而,受限于迁移管的材料,仪器无法长时间在超过100 ℃的条件下稳定工作,因此,选择100 ℃作为迁移管最优实验温度。
-
DDT-IMS所使用的迁移气和载气均为洁净空气,迁移气流速会影响分子之间的碰撞,载气流速会影响进入迁移管中样品的量,从而影响仪器的检测灵敏度。迁移气和载气流速对反应离子的影响较小,因此,利用样品检测对它们进行优化。
当载气流速为400 mL/min时,将迁移气流速从200 mL/min增加到700 mL/min,10 ng 2,4-DANT的检测结果示于图4b,产物离子强度先增强后减弱,当迁移气流速为600 mL/min时,信号最强。随后,将迁移气流速设置为600 mL/min,改变载气流速,产物离子信号强度变化示于图4c,当载气流速为500 mL/min时,产物离子信号最强。这可能是由于当载气流速较小时,热解吸产生的样品不易被吹扫进入迁移管中;而当载气流速过大时,进入迁移管中的样品浓度降低,使产物离子信号强度减弱。基于此,设置迁移气、载气流速分别为600、500 mL/min。
-
热解吸温度会直接影响待测样品的气化过程,从而影响仪器的检测灵敏度。在100~200 ℃解吸温度时,2,4-DANT产物离子信号强度的变化情况示于图4d。可见,产物离子信号强度随解吸温度升高而增强,200 ℃时达到最大。由此推测,解吸温度继续升高,产物离子信号强度会进一步提高。但考虑到仪器的耐高温性能,并且过高的解吸温度可能会导致物质裂解,因此选择200 ℃解吸温度。
-
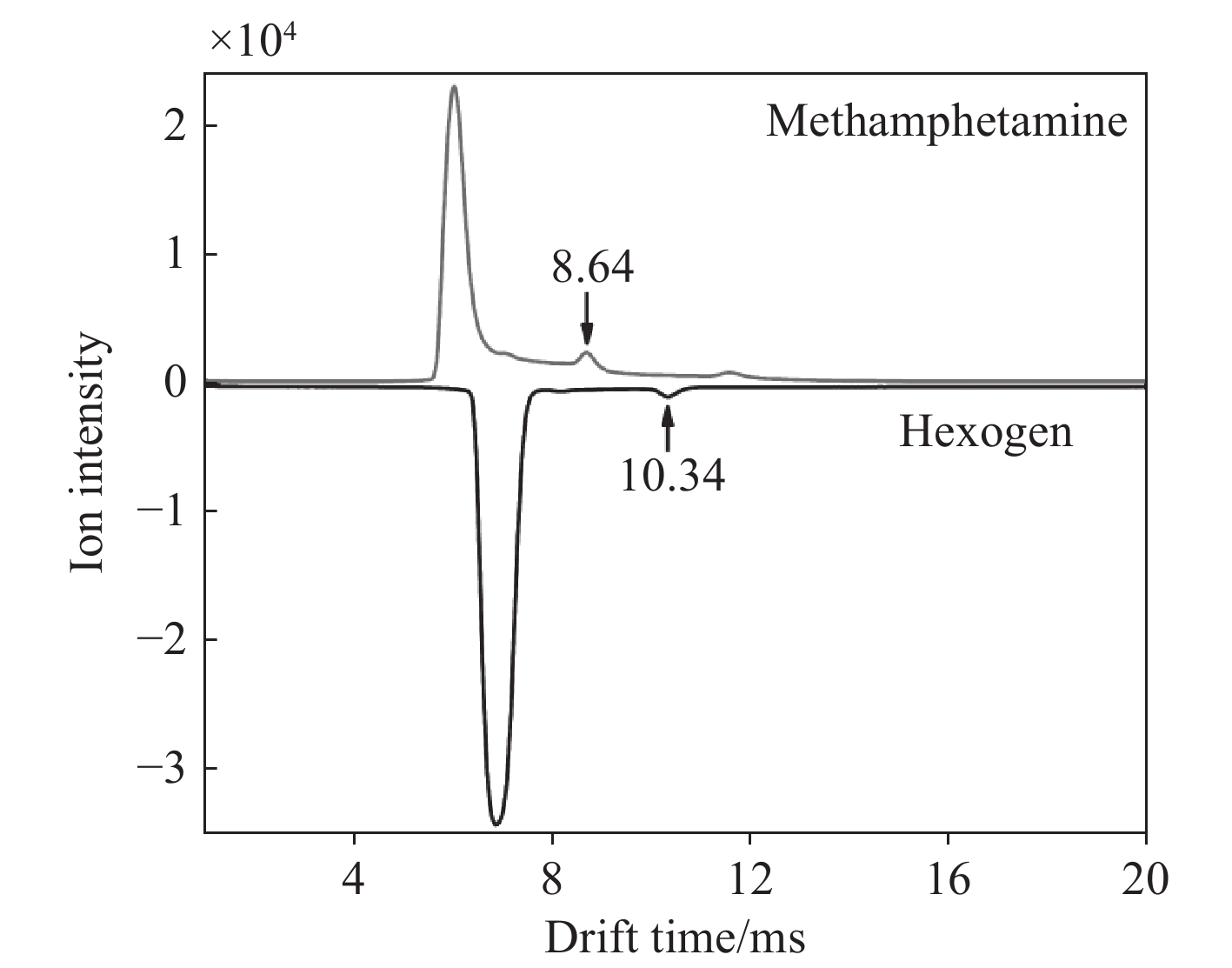
为验证DDT-IMS对混合物的检测能力,各取1 μL 5 mg/L MA和1 mg/L RDX样品,混合后检测,结果示于图5。MA和RDX分别在正、负离子模式下被检测到,根据迁移时间计算得到约化迁移率分别为1.72、1.44 cm2/V·s,与文献[10, 21]报道一致。表明DDT-IMS的2种检测模式能够对混合物实现准确检测。
-
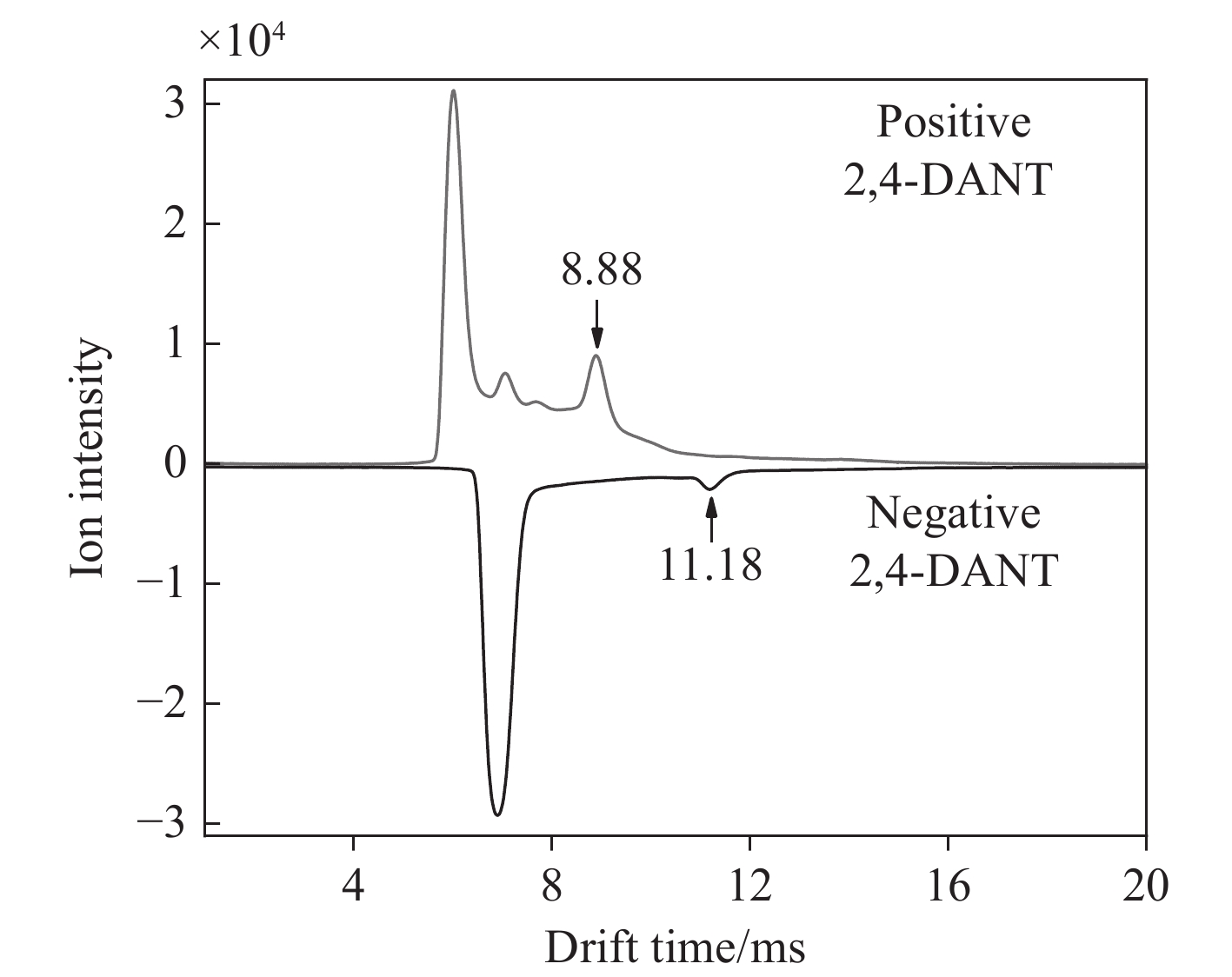
2,4-DANT是TNT中2个硝基被氨基取代后的产物,由于同时具有硝基和氨基,其可与正、负反应离子分别发生质子转移反应和电荷转移反应。因此,利用2,4-DANT验证DDT-IMS对单一样品正、负离子同时检测的能力。
20 ng 2,4-DANT样品的检测结果示于图6。负离子模式下,产物离子迁移时间为11.18 ms,约化迁移率为1.33 cm2/V·s。正离子模式下,除反应离子峰外,还观察到3个离子峰,其中靠近反应离子的2个离子峰来源于溶剂乙腈,2,4-DANT的产物离子迁移时间为8.88 ms,约化迁移率为1.67 cm2/V·s。结果表明,DDT-IMS能够实现对正、负离子模式均有响应的物质的同时检测。
-
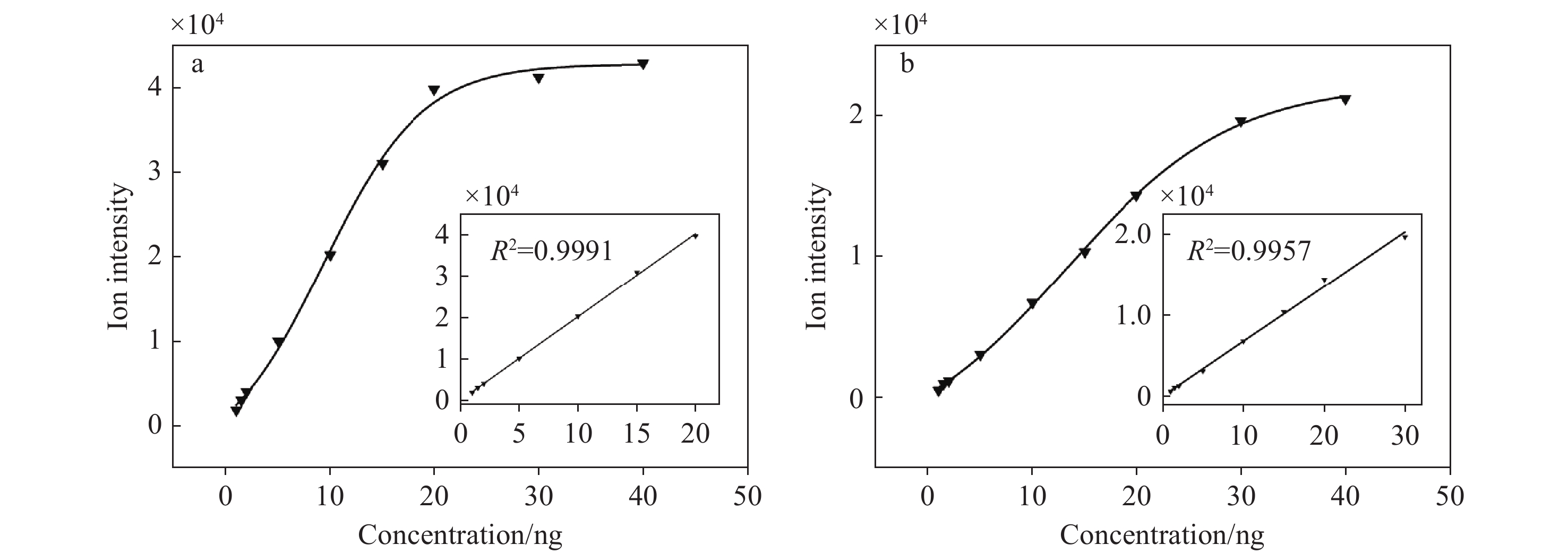
IMS检出限是指信号强度高于背景噪声3倍时分析物的浓度,是衡量仪器检测能力的重要指标,常用质量单位来定义,其检测限大都介于纳克(ng)至皮克(pg)量级[22]。DDT-IMS对不同浓度的2,4-DANT检测结果示于图7。以信噪比(S/N)为3得到正、负离子模式下的检出限分别为200、260 pg,表明DDT-IMS进样系统虽然将样品分为2部分分别检测,但并没有明显弱化仪器的检出能力。
-
本研究基于开发的小型双路离子门控脉冲控制电路,研制了以电晕放电为电离源,具备同时检测正、负离子功能的双迁移管IMS检测仪。双迁移管平行放置,分别进行正、负离子检测,检测过程中,载气携带热解吸后的样品分别进入2个迁移管中。小型离子门脉冲电路能够同时输出2路高压脉冲,为DDT-IMS提供离子门控制信号。实验还对仪器的工作温度和气体流速等参数进行优化。通过检测MA和RDX混合物,计算得到的约化迁移率分别为1.72、1.44 cm2/V·s。以2,4-DANT考察仪器性能,该仪器可检测正、负离子模式下均有响应的物质,检出限可达pg量级。
基于电晕放电电离源的双迁移管离子迁移谱检测仪
Dual-drift Tube Ion Mobility Spectrometry Based on Corona Discharge Ionization Source
-
摘要: 离子迁移谱(IMS)在单一正、负离子模式下检测时易出现漏检或误检。本研究通过开发小型双路离子门控脉冲控制电路,研制了一台以电晕放电为电离源,具备同时检测正、负离子功能的双迁移管IMS检测仪。通过优化气体流速、迁移管温度和热解吸温度等关键参数,检测了黑索金、甲基苯丙胺及三硝基甲苯(TNT)的取代产物2,4-二氨基-6-硝基甲苯。结果表明,该仪器能够同时检测正、负离子,在正、负离子模式下对2,4-二氨基-6-硝基甲苯的检出限分别为200、260 pg。
-
关键词:
- 离子迁移谱(IMS) /
- 电晕放电 /
- 离子门 /
- 双迁移管 /
- 正负同时检测
Abstract: Ion mobility spectrometry (IMS) is a trace detection technique operating at atmospheric pressure. It is widely utilized in various fields, such as explosives and drug detection, chemical warfare agent detection, and biomedical applications, due to its fast response time and high sensitivity. The various of substances can be identified through analyzing the discrepancies in the drift time of charged particles in an electric field. Depending on the polarity of the charged particles, it can operate under either positive or negative ion mode. Currently, the majority of IMS operate in only one detection mode. For example, explosives detection operates under negative ion mode, while drug detection operates under positive ion mode. However, single detection mode system is prone to miss detections because some substances may differentially respond to positive and negative detection modes. Simultaneous detection under both positive and negative ion modes can further enhance detection accuracy. In this study, a dual-drift tube ion mobility spectrometry capable of simultaneously detecting positive and negative ions was constructed using corona discharge ionization source technology and a compact dual ion-gated pulse control circuit. The instrument parameters of IMS were optimized, while simultaneously determined hexogen, methamphetamine and the metabolite of trinitrotoluene (TNT), 2,4-diamino-6-nitrotoluene (2,4-DANT). The optimal experimental conditions were selected as follows: a drift gas flow rate of 600 mL/min, a carrier gas flow rate of 500 mL/min, a drift tube temperature of 100 ℃, and a thermal desorption temperature of 200 ℃. The reduced mobility values of 1.72 cm2/V·s and 1.44 cm2/V·s are obtained through the detection of explosive hexogen (RDX) and drug methamphetamine (MA), respectively. These values agree well with the reported values, thereby proving the reliability of the instrument’s detection. Finally, the performance of the developed instrument was evaluated using 2,4-DANT, this substance that can be detected under both positive and negative ion modes. Production peaks are observed in both modes, and the normalized mobility values for 2,4-DANT are reported as approximately 1.67 cm2/V·s and 1.33 cm2/V·s under positive and negative ion modes, respectively. Through exploring the detection limits for both positive and negative ions, it was revealed that the homemade dual ion mobility spectrometer is capable of simultaneous detection of both positive and negative ions, achieves the lowest detection limits of 200 pg and 260 pg for 2,4-DANT, respectively. Importantly, these detection limits are not significantly compromised by sample division, which underscores the broad applicability and value of the instrument, highlighting its potential in various fields. -

-
-
[1] MAKINEN M, NOUSIAINEN M, SILLANPAA M. Ion spectrometric detection technologies for ultra-traces of explosives: a review[J]. Mass Spectrometry Reviews, 2011, 30(5): 940 -973 . doi: 10.1002/mas.20308[2] VERKOUTEREN J R, STAYMATES J L. Reliability of ion mobility spectrometry for qualitative analysis of complex, multicomponent illicit drug samples[J]. Forensic Science International, 2011, 206(1/2/3): 190 -196 . doi: 10.1016/j.forsciint.2010.08.005[3] YAMAGUCHI S, ASADA R, KISHI S, SEKIOKA R, KITAGAWA N, TOKITA K, YAMAMOTO S, SETO Y. Detection performance of a portable ion mobility spectrometer with 63Ni radioactive ionization for chemical warfare agents[J]. Forensic Toxicology, 2010, 28(2): 84 -95 . doi: 10.1007/s11419-010-0092-z[4] KREBS M D, ZAPATA A M, NAZAROV E G, MILLER R A, COSTA I S, SONENSHEIN A L, DAVIS C E. Detection of biological and chemical agents using differential mobility spectrometry (DMS) technology[J]. Ieee Sensors Journal, 2005, 5(4): 696 -703 . doi: 10.1109/JSEN.2005.845515[5] LOKHNAUTH J K, SNOW N H. Solid phase micro-extraction coupled with ion mobility spectrometry for the analysis of ephedrine in urine[J]. Journal of Separation Science, 2005, 28(7): 612 -618 . doi: 10.1002/jssc.200401924[6] VAUTZ W, ZIMMERMANN D, HARTMANN M, BAUMBACH J I, NOLTE J, JUNG J. Ion mobility spectrometry for food quality and safety[J]. Food Additives and Contaminants, 2006, 23(11): 1 064-1 073. [7] KARPAS Z. Applications of ion mobility spectrometry (IMS) in the field of foodomics[J]. Food Research International, 2013, 54(1): 1 146-1 151. [8] LEE J, PARK S, CHO S G, GOH E M, LEE S, KOH S S, KIM J. Analysis of explosives using corona discharge ionization combined with ion mobility spectrometry-mass spectrometry[J]. Talanta, 2014, 120: 64 -70 . doi: 10.1016/j.talanta.2013.11.059[9] SABO M, MICHALCZUK B, LICHVANOVA Z, KAVICKY V, RADJENOVIC B, MATEJCIK S. Interactions of multiple reactant ions with 2,4,6-trinitrotoluene studied by corona discharge ion mobility-mass spectrometry[J]. International Journal of Mass Spectrometry, 2015, 380: 12 -20 . doi: 10.1016/j.ijms.2015.03.002[10] EWING R G, ATKINSON D A, EICEMAN G A, EWING G J. A critical review of ion mobility spectrometry for the detection of explosives and explosive related compounds[J]. Talanta, 2001, 54(3): 515 -529 . doi: 10.1016/S0039-9140(00)00565-8[11] LU Y, ZHU X, ZHENG J, CHEN Y. Application of ion mobility spectrometer for rapid drug detection[J]. Nuclear Techniques, 2007, 30(10): 818 -822 .[12] SHALTAEVA Y R, GOLOVIN A V, VASILYEV V K, GROMOV E A, MATUSKO M A, MALKIN E K, IVANOV I A, BELYAKOV V V, PERSHENKOV V S. The review of bipolar ion mobility spectrometers[M]//IFMBE Proceedings. Cham: Springer International Publishing, 2019: 639-644. [13] LI L, GU H, LV Y, ZHANG Y, HE X, LI P. Ultra-fast polarity switching, non-radioactive drift tube for the miniaturization of drift-time ion mobility spectrometer[J]. Sensors, 2022, 22(13): 4 866. [14] HITZEMANN M, KIRK A T, LIPPMANN M, BOHNHORST A, ZIMMERMANN S. Miniaturized drift tube ion mobility spectrometer with ultra-fast polarity switching[J]. Analytical Chemistry, 2022, 94(2): 777 -786 . doi: 10.1021/acs.analchem.1c03268[15] LIPPMANN M, KIRK A T, HITZEMANN M, ZIMMERMANN S. Compact and sensitive dual drift tube ion mobility spectrometer with a new dual field switching ion shutter for simultaneous detection of both ion polarities[J]. Analytical Chemistry, 2020, 92(17): 11 834-11 841. [16] HONG Y, HUANG C, LIU S, XIA L, SHEN C, CHU Y. Normal-inverse bimodule operation Hadamard transform ion mobility spectrometry[J]. Analytica Chimica Acta, 2018, 1 029: 44-49. [17] LIU S, HUANG C, SHEN C, JIANG H, CHU Y. A novel driving mode for ion shutter based on alternating current superposition and its application to ion mobility spectrometry[J]. Sensors and Actuators B: Chemical, 2015, 211: 102 -110 . doi: 10.1016/j.snb.2015.01.061[18] BORSDORF H, MAYER T. Temperature dependence of ion mobility signals of halogenated compounds[J]. Talanta, 2012, 101: 17 -23 . doi: 10.1016/j.talanta.2012.08.049[19] TABRIZCHI M, ROUHOLAHNEJAD F. Comparing the effect of pressure and temperature on ion mobilities[J]. Journal of Physics D: Applied Physics, 2005, 38(6): 857 -862 . doi: 10.1088/0022-3727/38/6/012[20] ABEDI A, SATTAR L, GHARIBI M, VIEHLAND L A. Investigation of temperature, electric field and drift-gas composition effects on the mobility of ${ {{\mathrm{NH}}_4^+ }}$ ions in He, Ar, N2, and CO2[J]. International Journal of Mass Spectrometry, 2014, 370: 101 -106 . doi: 10.1016/j.ijms.2014.06.014[21] OCHOA M L, HARRINGTON P B. Detection of methamphetamine in the presence of nicotine using in situ chemical derivatization and ion mobility spectrometry[J]. Analytical Chemistry, 2004, 76(4): 985 -991 . doi: 10.1021/ac035123r[22] ARMENTA S, ESTEVE-TURRILLAS F A, ALCALÀ M. Analysis of hazardous chemicals by “stand alone” drift tube ion mobility spectrometry: a review[J]. Analytical Methods, 2020, 12(9): 1 163-1 181. -


 首页
首页 登录
登录 注册
注册



 下载:
下载: