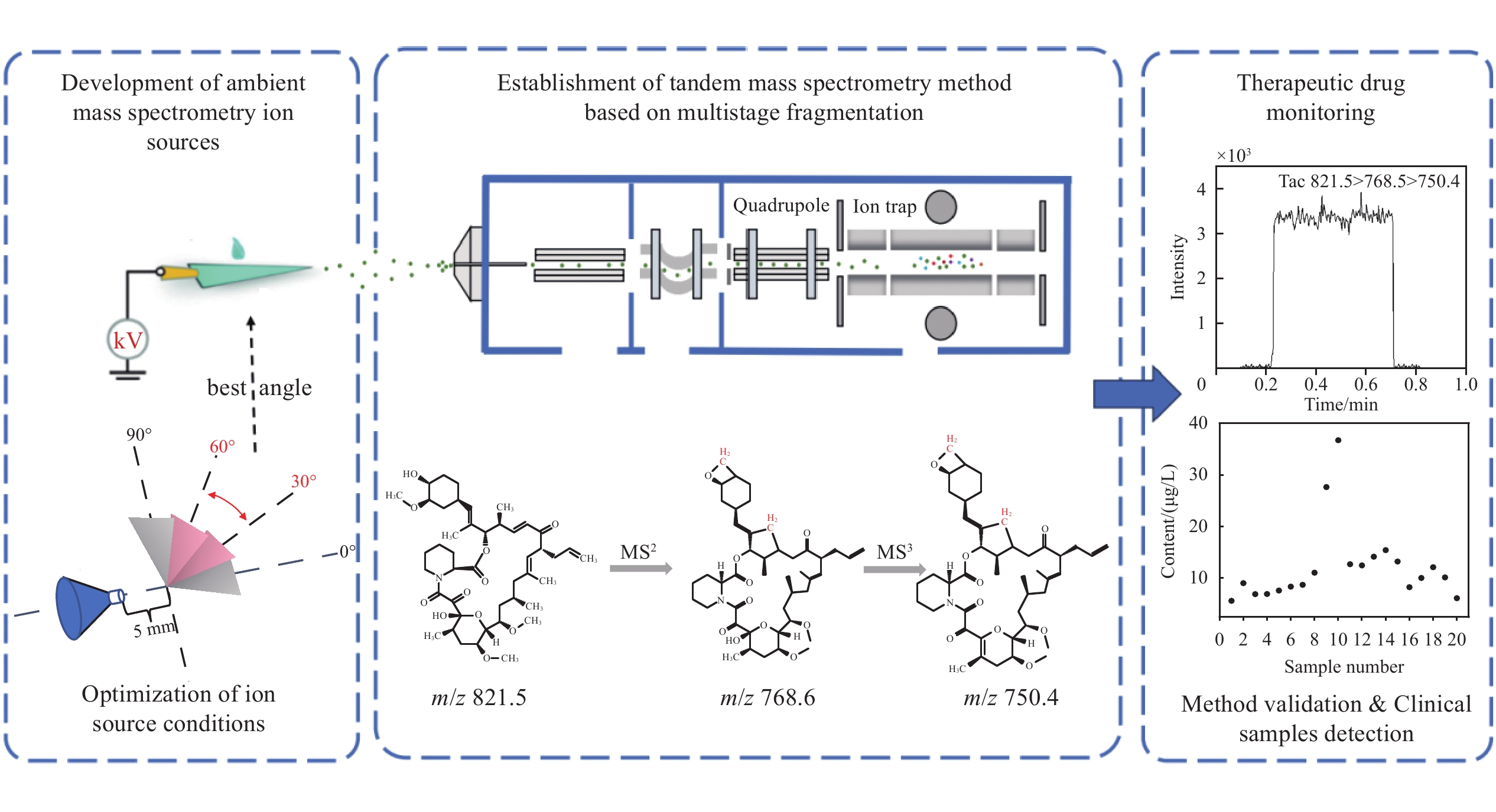
-
他克莫司是一种从链霉菌中分离得到的免疫抑制剂,主要通过干扰T细胞活化发挥其免疫抑制作用[1-2]。他克莫司进入T细胞后与亲免素的细胞内蛋白结合,形成的药物-亲免蛋白复合物抑制钙调磷酸酶,而钙调磷酸酶是一种参与活化T细胞核因子(nuclear factor of activated T-cells,NF-AT)的酶,NF-AT是T细胞中细胞因子基因表达所需的转录因子。因此,他克莫司对钙调磷酸酶的抑制导致T细胞衍生的细胞因子(如起始因子2和γ干扰素(interferon-gamma,IFN-g))的产生完全阻断,从而发挥药理作用[3]。目前,国际指南均推荐他克莫司作为肾脏移植患者术后长期使用的首选钙调磷酸酶抑制剂[4]。他克莫司治疗窗口窄,浓度过高会引起药物毒性,因此,他克莫司的免疫抑制程度及不良反应与其血药浓度密切相关[5-10]。临床上一般会将他克莫司血药浓度控制在5~15 μg/L,若浓度低于5 μg/L,则免疫排斥反应增加;若浓度大于15 μg/L,肾毒性和神经毒性会增加[11]。即使血药浓度在治疗窗范围内,患者也常会发生肾毒性、消化系统不适等不良反应。
目前,血液中免疫抑制剂的检测方法有免疫分析法[12]、高效液相色谱(high-performance liquid chromatography,HPLC)法[13]以及质谱法,质谱法包括液相色谱-串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)法和原位质谱法。其中,免疫分析法快速、简单、价格低廉,但在进行血液药物浓度检测时,由于目标药物会与结构相似的药物或药物代谢产物发生交叉反应,导致药物浓度测定结果出现正偏倚,缺乏特异性和准确性[14]。其次,当他克莫司与其他药物联合使用时,对多种免疫抑制剂的同时检测存在成本高、通量低的问题。与免疫分析法相比,HPLC法提高了对药物检测的灵敏度和特异性。但在分析前,需从血液样品中提取药物,样本制备时间和分析时间均较长。此外,由于结构相似的化合物会共存,分析时可能存在干扰问题[15]。与前两者相比,质谱法具有高灵敏度、高选择性、高特异性、低检测限和高通量等优点,已成为临床免疫抑制剂药物监测(therapeutic drug monitoring,TDM)的金标准[16-17]。相比于单级质谱,串联质谱具有更高的选择性、分辨率和灵敏度,能够更好地应对复杂样本中目标物质的精准检测[18]。
纸喷雾电离(paper spray ionization,PSI)是一种原位电离技术[19]。其使用切割成尖锐角度的纸基材料,先将待测样品加载在纸基上,然后将喷雾溶剂滴加到纸基上,随后在纸基上施加高压,促使目标物的分离和电离,从而在纸尖端处产生电喷雾,最后进入质谱锥孔进行检测。纸基主要由压缩的纤维组成,当形成片材时,在其结构内产生一系列无定形的多孔通道,能够通过毛细管作用充分吸收和运输溶剂,不同分析物由于极性、分子质量等差异,会在纸基上发生一定程度的分离。纸基的纤维结构和表面特性也会影响分离效果,这种无定形通道结构是纸基的重要组成部分[20]。此外,这种纤维结构还能够通过物理或化学手段进行修饰,以改变纸基的表面性质和相互作用能力,进而有效增强对待测物的分离效果,提高分析的灵敏度和选择性,使其更适用于复杂样品的分析。纸喷雾分析能够将干扰检测结果的样品基质保留在其多孔结构内,因此可以直接分析干血斑(dried blood spots,DBS),省去了从DBS中提取目标物的繁琐冗长的步骤[21]。与传统的LC-MS/MS法相比,纸喷雾技术大大减少了溶剂用量,简化了前处理步骤,提高了分析效率。
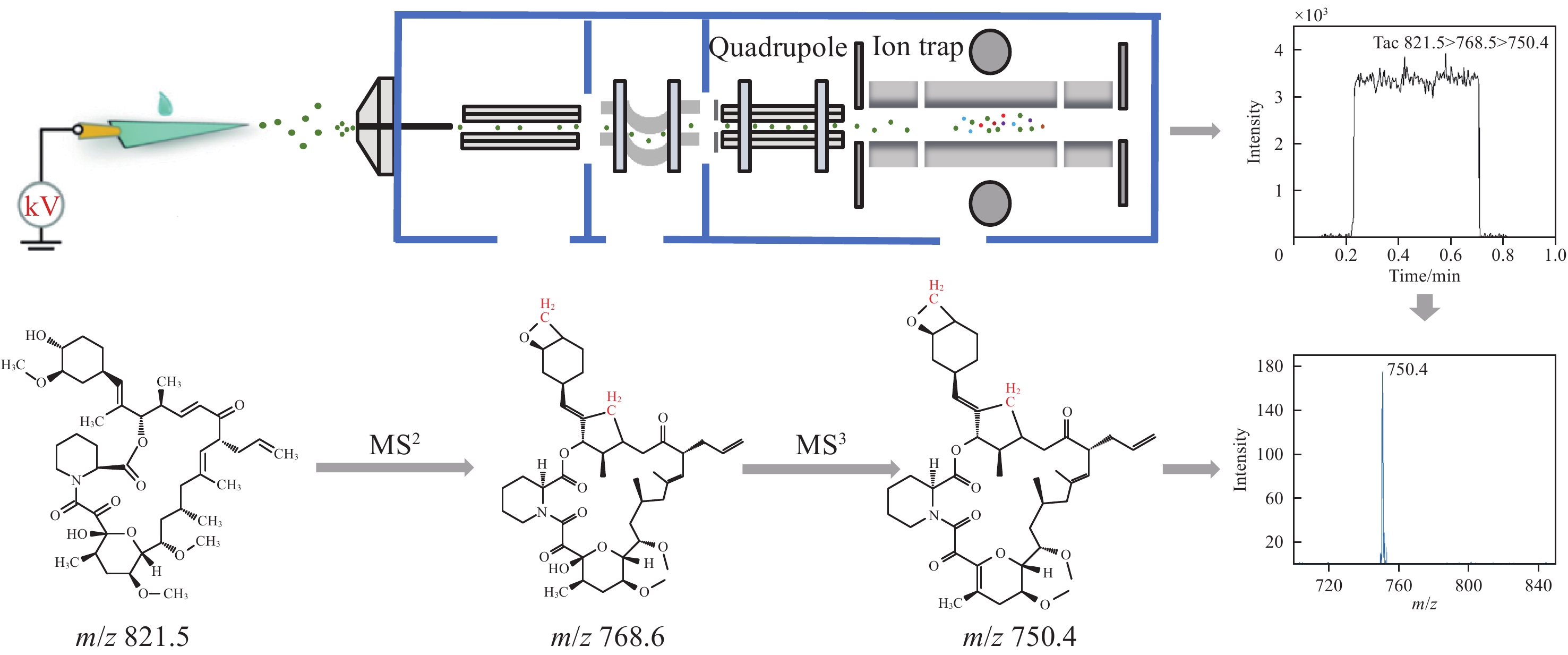
本研究拟采用基于多级碎裂的纸喷雾质谱,建立一种快速、准确检测血浆中他克莫司的方法,使用含有内标物的有机溶剂从全血中提取分析物,将该提取物沉积在纸三角上,然后向纸上施加高压,实验流程示于图1。在纸喷雾质谱分析过程中,由于样品基质复杂,目标物的二级离子信号可能受到基质效应的影响,导致灵敏度降低。为了解决这一问题,本研究利用中国计量科学研究院自主研发的四极杆-线形离子阱液相色谱-质谱联用仪(QLIT-6610MD)中离子阱的结构特点,对目标物进行多级碎裂,采用三级碎裂离子对他克莫司进行定量分析。
-
四极杆-线形离子阱串联质谱仪:中国计量科学研究院自主研制;XPR250/A电子分析天平:瑞士MettLer ToLedo公司产品;5804R高速冷冻离心机、微量可调移液器、ThermoMixerC混匀仪:德国Eppendorf公司产品;MIX-25涡旋仪:杭州米欧仪器有限公司产品;PM4-1300TD超声仪:英国PRIMA公司产品;TS302/TS304精密光学平台:北京北光世纪仪器有限公司产品;WB129237 FTA采血卡、1 CHR层析滤纸、3 MM色谱纸:英国Whatman公司产品;慢速、中速、快速定量滤纸,慢速、中速、快速定性滤纸:杭州富阳特种纸业有限公司产品。
他克莫司、他克莫司-13C,d2标准品:上海甄准生物科技有限公司产品;甲酸、甲酸铵、乙酸铵:均为质谱级,美国Sigma Aldrich公司产品;甲醇、乙腈:均为色谱级,美国Thermo Fisher公司产品。
-
样本来自兰州市第一人民医院,经该院医学伦理委员会批准(伦理编号为2024A-23),储存于−80 ℃。
-
准确称取1.00 mg他克莫司标准品,加入1 mL 90%甲醇水溶解,再用甲醇稀释成浓度为100、200、500、1 000、2 000、10 000、20 000 μg/L标准品工作溶液,储存于−20 ℃。
-
准确称取1.00 mg他克莫司-13C,d2标准品,加入1 mL 90%甲醇水-2 mmol/L甲酸铵溶液溶解,振荡摇匀;用10 mL 90%甲醇水-2 mmol/L甲酸铵溶液将内标溶液稀释至1 000 μg/L,储存于−20 ℃。
-
分别取10 μL上述配制的溶液置于离心管中,向其中加入190 μL人空白血浆,得到浓度为5、10、25、50、100、500、1 000 μg/L标准溶液。用相同方法配制质控品溶液,浓度为10、100、500 μg/L。
-
将200 μL 1 000 μg/L他克莫司-13C,d2的90%甲醇水-2 mol/L甲酸铵溶液添加到200 μL加标他克莫司的待测血浆样本中,上述样品在1.5 mL离心管中涡旋振荡摇匀5 min以沉淀蛋白质;取30 μL上清液,置于3 mm三角形滤纸底部,纸基大小为底8 mm、高8 mm的等腰三角形,底部用铜夹固定,控制滤纸尖端距离质谱锥孔口为5 mm。在0.2 min时向固定三角形滤纸的铜夹施加4 500 V电压,在0.8 min时关闭电压,整个流程持续1 min。最终,样品进入质谱仪进行实时检测。
-
电喷雾离子源正离子模式,多级子离子扫描(QTPISn);电喷雾电压4 500 V,离子源温度50 ℃,大气压接口温度250 ℃,鞘气压强34.5 kPa,辅助气压强6.9 kPa,反吹气压强1.4 kPa。其他质谱参数列于表1。
-
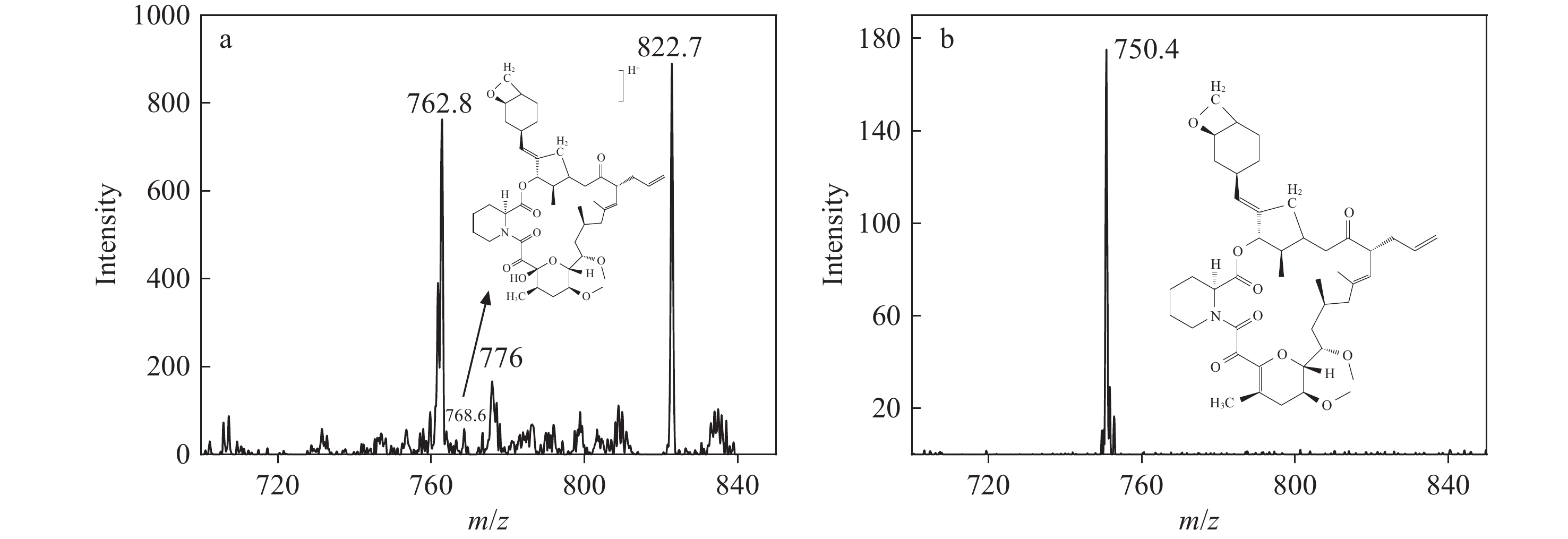
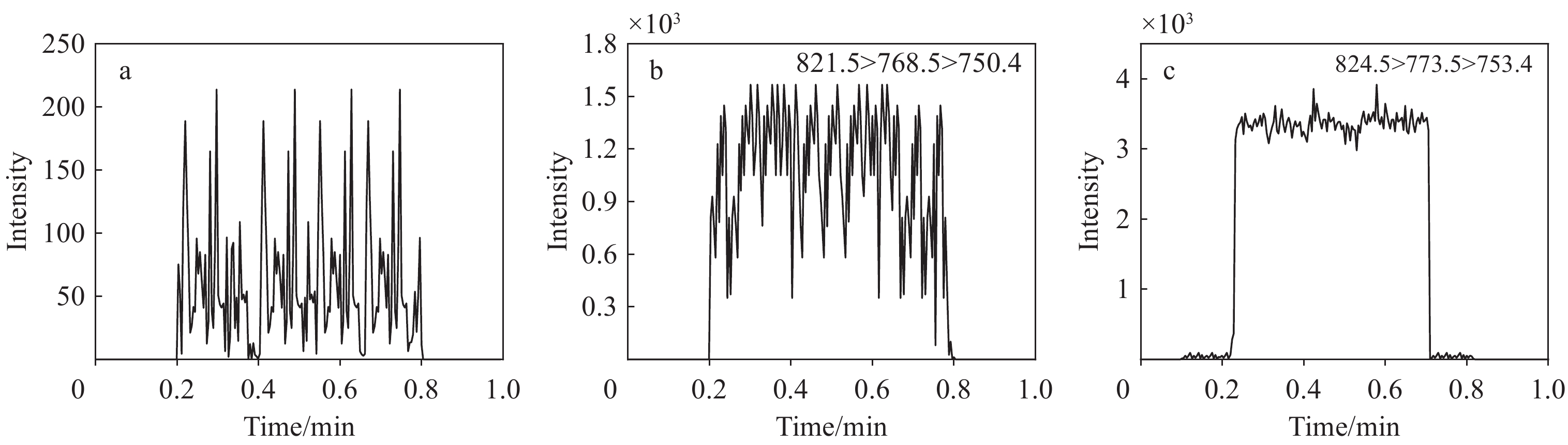
在进行二级离子定量分析时,由于样品基质复杂,质谱中存在杂质离子m/z 762.8和822.7的干扰,示于图2a。可以发现,目标二级离子m/z 768.6的强度相对较低,且信噪比低。为了降低基质干扰并提高信噪比,对m/z 762.8进行再次碎裂,得到三级离子m/z 750.4和718.4。由于m/z 750.4的响应强度优于m/z 718.4,故选择m/z 750.4作为定量离子,m/z 718.4作为定性离子,结果示于图2b。
-
为了使分析物渗透纸基,在纸喷雾质谱分析中,通常将样品置于纸上一段时间后进行检测。在本研究中,使用有机溶剂对血浆样本进行沉淀,然后吸取上清液进行检测。有机溶剂在纸基上能够快速渗透,显著减少了分析所需的时间。同时,沉淀溶剂可以溶解他克莫司内标物,简化操作流程并提高分析效率。此外,本研究采用1 000 μg/L血浆加标样本,分别对纸基材料、洗脱溶剂、纸基尖端角度和纸基大小、纸基尖端与质谱口距离、喷雾电压及上清液滴加量等条件进行优化,以提高分析性能。
-
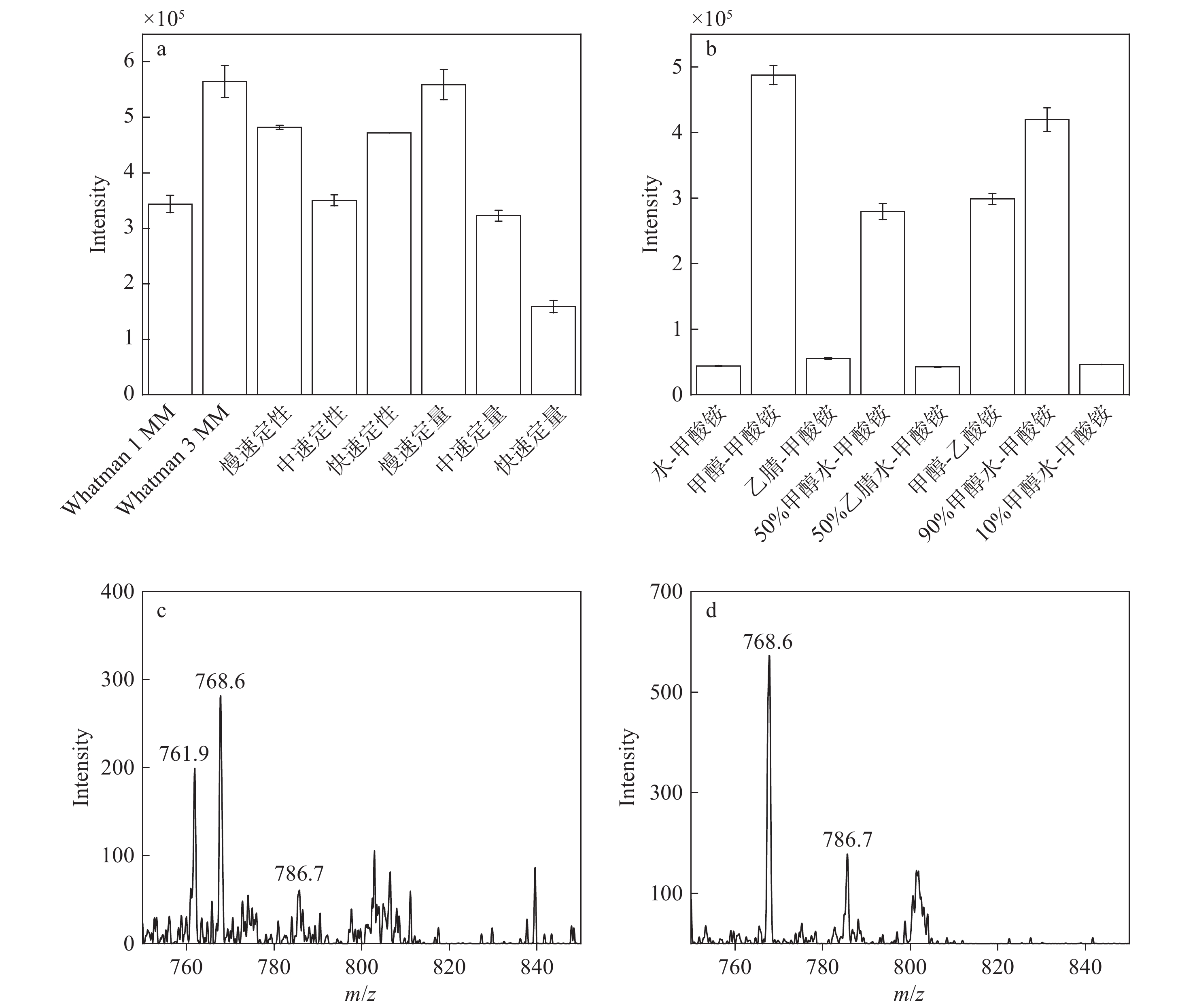
纸的表面性质对洗脱和电离效率具有决定性影响,进而影响目标物的响应强度。基于9种不同纸基材料进行纸喷雾质谱分析,以筛选最适用于他克莫司检测的纸基,各类纸基的响应强度示于图3a。结果表明,使用Whatman 3 MM色谱纸和慢速定量滤纸作为纸喷雾基底时,目标物响应强度均较高,但Whatman 3 MM色谱纸厚度略大于慢速定量滤纸,在滴加相同体积溶剂时,Whatman 3 MM纸基更容易保持其尖端直挺的状态,满足纸喷雾实验要求。在图3a中没有列举FTA 906号采血卡纸,其纸张厚度为500 μm,由于纸张较厚,所需的溶剂量比其他纸基更多,在相同的电压驱动下,喷雾溶剂在纸片表面的延展速度极慢,导致在质谱扫描时间内未能检测到信号。因此,选择Whatman 3 MM色谱纸作为纸喷雾基底。
-
本实验选择8种不同溶剂作为洗脱溶剂进行分析,各溶剂的响应强度示于图3b。将水-2 mmol/L甲酸铵、甲醇-2 mmol/L甲酸铵和乙腈-2 mmol/L甲酸铵洗脱溶剂进行对比,可以得出,甲醇-2 mmol/L甲酸铵作为洗脱溶剂对目标物的响应最优,这可能是因为溶剂的极性应与目标物匹配,以确保目标物充分溶解并迁移到纸尖端。极性溶剂适合分析极性化合物,而非极性溶剂适合非极性化合物。他克莫司是非极性物质,3种溶剂的极性由高到低分别为水、乙腈、甲醇,因此,甲醇作为洗脱溶剂时,目标物响应强度最高。进一步对比甲醇-2 mmol/L甲酸铵和甲醇-2 mmol/L乙酸铵对目标物响应强度的影响,可以发现2 mmol/L甲酸铵的效果更好,其原因可能是甲酸根的质子亲和力较强,有助于他克莫司的质子化。甲酸铵的挥发性强于乙酸铵,有助于在纸喷雾过程中形成更细小的带电液滴,从而提高离子化效率和信号强度。混合溶剂(如甲醇-水、乙腈-水)能兼顾目标物的溶解性和离子化效率,通常比单一溶剂更有效。在不同甲醇、水比例的溶剂中,90%甲醇水对目标物响应强度的影响最大。因此,选择90%甲醇水-2 mmoL/L甲酸铵溶液作为洗脱溶剂。
在本研究中,还对比了加入甲酸和不加入甲酸溶剂对质谱分析的影响,示于图3c、3d。结果表明,加入甲酸溶剂显著增加了背景噪声,导致信噪比降低,而不加入甲酸溶剂的背景噪声较低。因此,本研究选择不向溶剂中添加甲酸。
-
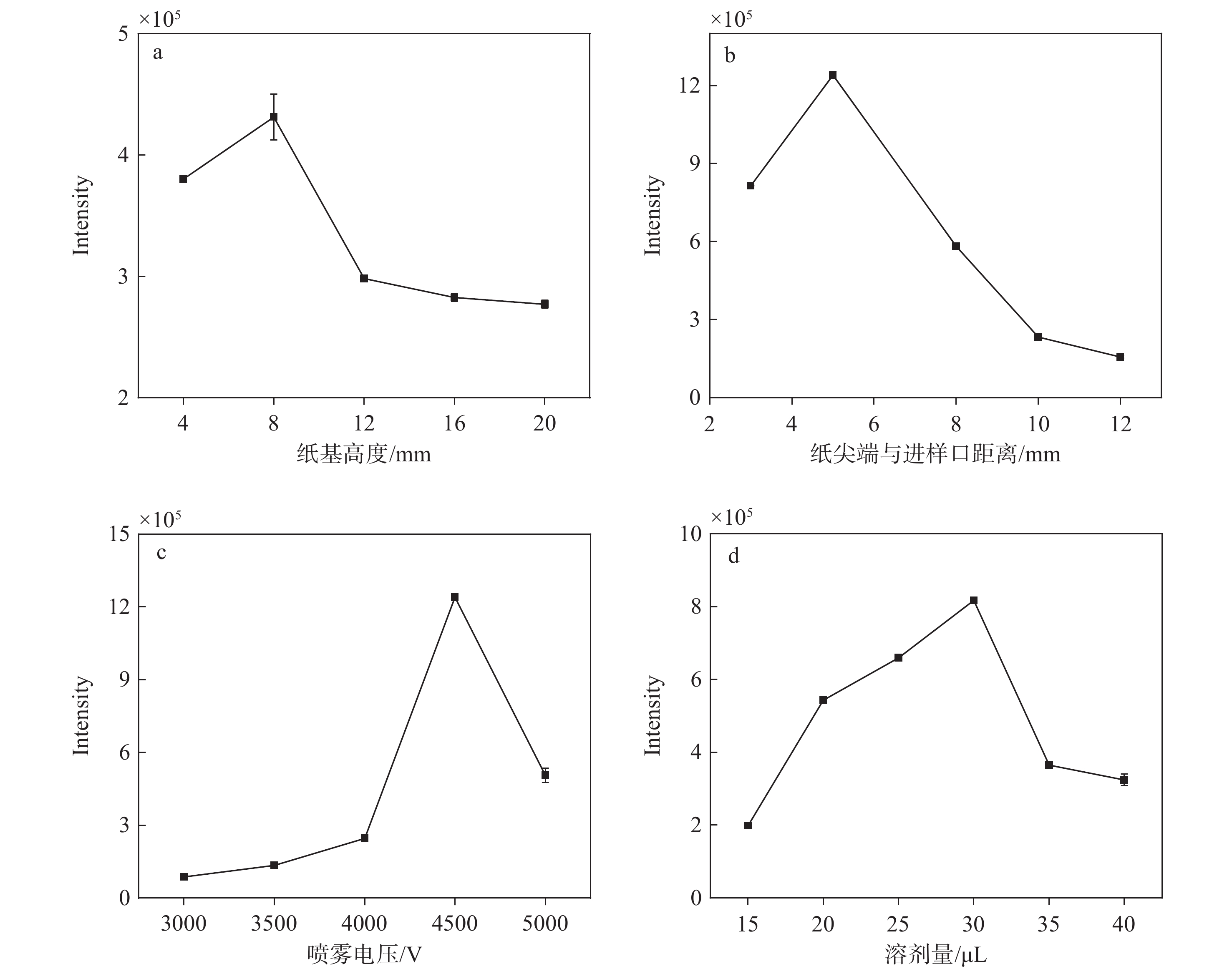
控制纸片底长8 mm,通过改变三角形高度来改变纸基的尖端角度和纸基大小,各高度对应的响应强度示于图4a。当纸基高度为4 mm时,纸基过小,将相同溶剂量滴加在纸片上会使目标物堆积,堆积的样品可能与纸基发生更多的相互作用,增加背景信号,掩盖目标物信号而导致离子化效率降低;当纸基高度为8 mm时,质谱响应达到峰值;当纸基高度大于8 mm时,由于纸片面积过大,目标物未均匀分布在纸基上,使离子化效率降低。在纸基高度8 mm时,纸片的尖端角度约为53°,这个角度能够产生更强的电场,可以提升离子化效率并增强信号强度。同时,合适的尖端角度还有助于维持喷雾的稳定性,减少信号波动。因此,选择底长8 mm、高度8 mm的纸基作为离子源基底。
-
本实验对纸基尖端与质谱进样口的距离进行优化,其响应强度示于图4b。随着纸基尖端与质谱口距离的逐渐增加,目标物响应强度呈先增加后减弱的趋势,当距离为5 mm时,目标物响应强度最高。纸喷雾过程中,纸基尖端产生的带电液滴是呈泰勒锥形式的,当纸基尖端与质谱口的距离过近时,带电液滴无法全部进入质谱口中,从而导致信号强度降低。此外,在施加一定电压时,过近的距离还可能引发尖端放电现象,这不仅会损害设备,还可能带来安全隐患。当纸基尖端与质谱口的距离为5 mm时,质谱口可以有效地接收带电液滴,喷雾模式更稳定,有利于形成单锥喷雾,从而进一步增强信号强度。当纸基尖端与质谱口的距离过远时,由于喷雾离子未能进入质谱口而导致目标物信号强度较低。此外,喷雾模式可能会由单锥喷雾转变为多锥喷雾或边缘喷雾,从而降低信号强度。因此,选择纸基尖端与质谱口距离为5 mm。
-
喷雾电压对他克莫司响应强度的影响示于图4c。结果表明,随着喷雾电压的逐渐提高,他克莫司的响应强度相应增强。在喷雾电压达到4 500 V时,他克莫司的响应强度达到最高;继续增加电压,响应强度开始下降。这可能是喷雾电压过低时,他克莫司无法在纸基上发生电离而产生电喷雾,导致检测信号缺失;而施加的电压过高,可能会提高杂质的信号强度,进而导致目标物的信号强度降低。此外,过高的电压还可能导致纸基尖端与质谱口之间发生放电现象,这不仅会降低信号质量,还可能带来安全隐患。
-
适量的溶剂滴加量能够确保样品在纸基上的均匀分布和有效传输,其优化结果示于图4d。可见,随着上清液滴加量增加,目标物响应强度逐渐增大,当滴加量为30 μL时,响应信号最强,随后下降。这是因为适量的溶剂可以促进样品的均匀分布和有效离子化,而过量的溶剂可能导致样品扩散过快或喷雾效率降低。因此,选择上清液滴加量为30 μL。
-
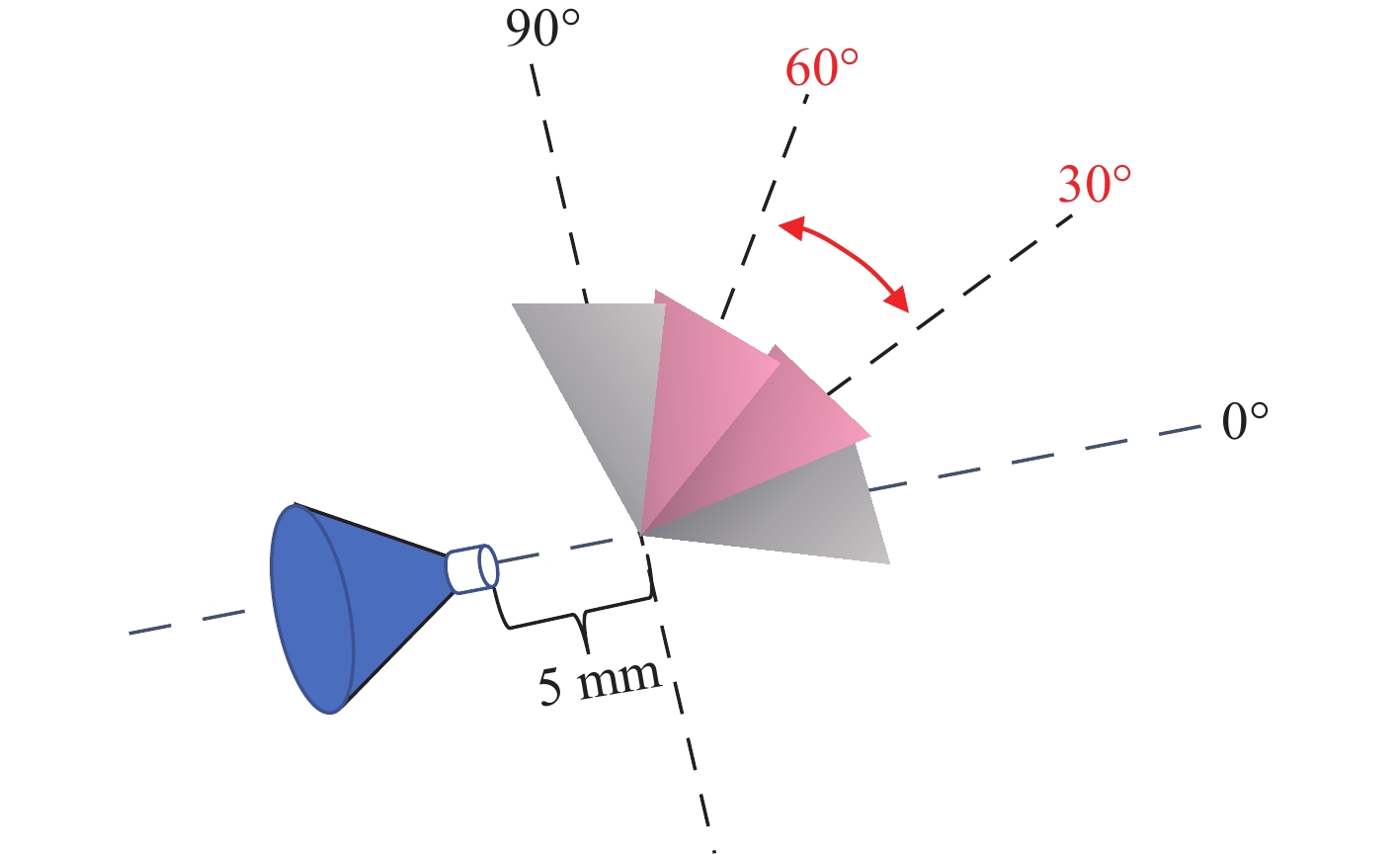
本实验对纸基尖端与质谱口之间的角度进行研究,角度测试范围为0°~90°,在30°~60°范围内检测效果较好,结果示于图5。但考虑到设备和操作的简便性、实用性,以及对实验结果的影响程度,实际检测过程选择的角度为0°。
-
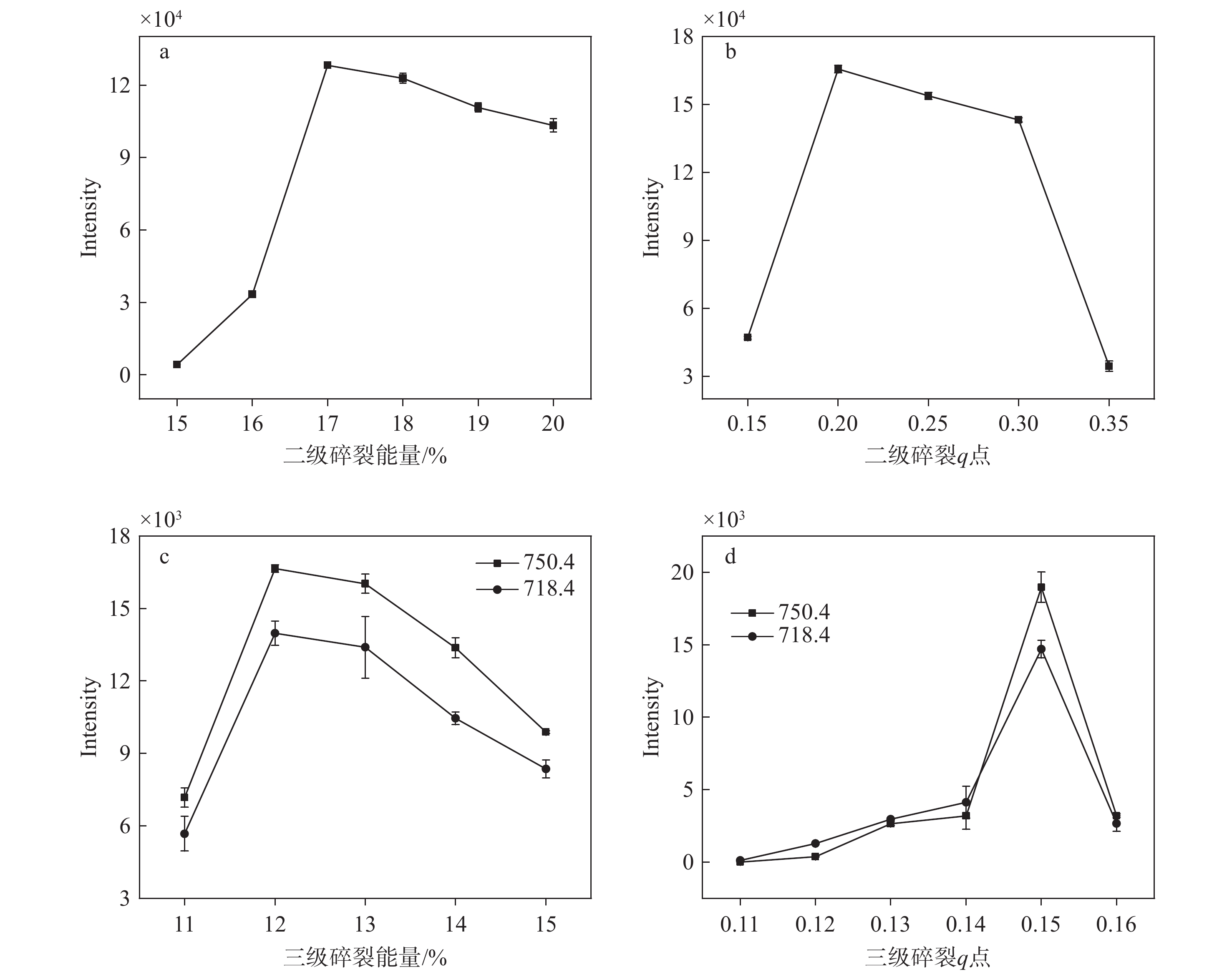
在QLIT-6610MD质谱仪中,首先通过四极杆的选择功能选择目标母离子,消除背景干扰,从而减少进入线形离子阱的离子数量,减弱空间电荷效应。这些母离子进入离子阱后,对目标母离子施加碎裂能量,使其碎裂形成二级碎片离子;二级离子在离子阱中再次被捕获,并应用第2次碎裂能量使其进一步解离形成三级碎片离子。优化碎裂能量不仅可以增强目标物的响应强度,还可以显著降低背景噪声,从而提高定量分析的灵敏度和准确性。如图6所示,优化二级碎裂能量和碎裂q点后,离子强度均提高了约4倍;优化三级碎裂能量和碎裂q点后,离子强度也均提高了约4倍。二次碎裂能量和q点分别为17%和0.2,三级碎裂能量和q点分别为12%和0.15。
-
准确量取200 μL不含药物的空白血浆样本和含有他克莫司及他克莫司-13C,d2的血浆样本,按照1.3节对样本进行预处理和分析, 得到的色谱图示于图7。本方法能够准确检测复杂基质中的目标物,不会出现假阳性结果,专属性良好,可准确定量分析实际样品。
-
准确量取200 μL 10、100、500 μg/L他克莫司全血加标样品(A)和标准品溶液(B),分别与200 μL 1 000 μg/L他克莫司-13C,d2内标溶液(90%甲醇水-2 mmol/L甲酸铵)混合,摇匀后静置。然后,取30 μL上清液滴加于Whatman 3 MM纸基上,纸基尖端距离质谱口锥孔5 mm,并施加4 500 V喷雾电压,记录目标物的峰面积,实验重复3次。通过计算(A峰面积/内标峰面积)/(B峰面积/内标峰面积)×100%来评价基质效应,结果列于表2。低、中、高浓度下的基质效应分别为82.19%、108.01%、97.96%,相对标准偏差(RSD)分别为8.88%、3.10%、2.00%。这表明,不同浓度水平下的基质效应存在显著差异,低浓度水平下的基质效应较明显。因此,后续实验选用血浆加标样品,以减少基质效应对分析结果的影响。
-
以3倍信噪比(S/N)作为检出限(LOD),10倍S/N作为定量限(LOQ),且精密度<20%,向空白血浆样本中加入特定浓度的他克莫司,按照1.3节进行纸喷雾分析,获取该浓度下的信噪比数值,然后稀释样品,直至得到的信噪比分别达到LOD和LOQ。最终得到的他克莫司LOD和LOQ分别为1.00、5.00 μg/L,RSD值分别为12.10%、6.41%。
-
配制5、10、25、50、500、1 000 μg/L系列标准溶液。以他克莫司浓度作为横坐标(x),他克莫司与内标的峰面积比作为纵坐标(y),进行线性回归。结果表明,在5.00~1 000.00 μg/L浓度范围,线性方程为y=0.002 39x−0.021 92,相关系数(R²)为0.998,表明该方法具有较高的定量准确性和可靠性。
-
选取低、中、高3个浓度的他克莫司血浆加标样品进行纸喷雾质谱分析,以测量值与理论值的比值评价准确度,分别为95.23%、102.39%、97.55%。
-
选取质控品的他克莫司血浆加标样本进行纸喷雾质谱分析,分别在同一天内和连续3天进行分析,重复测量3次,结果列于表3。他克莫司的日内精密度范围为6.17%~11.90%,日间精密度范围为5.30%~13.39%,表明该方法的精密度良好,能够用于他克莫司的定量分析。
-
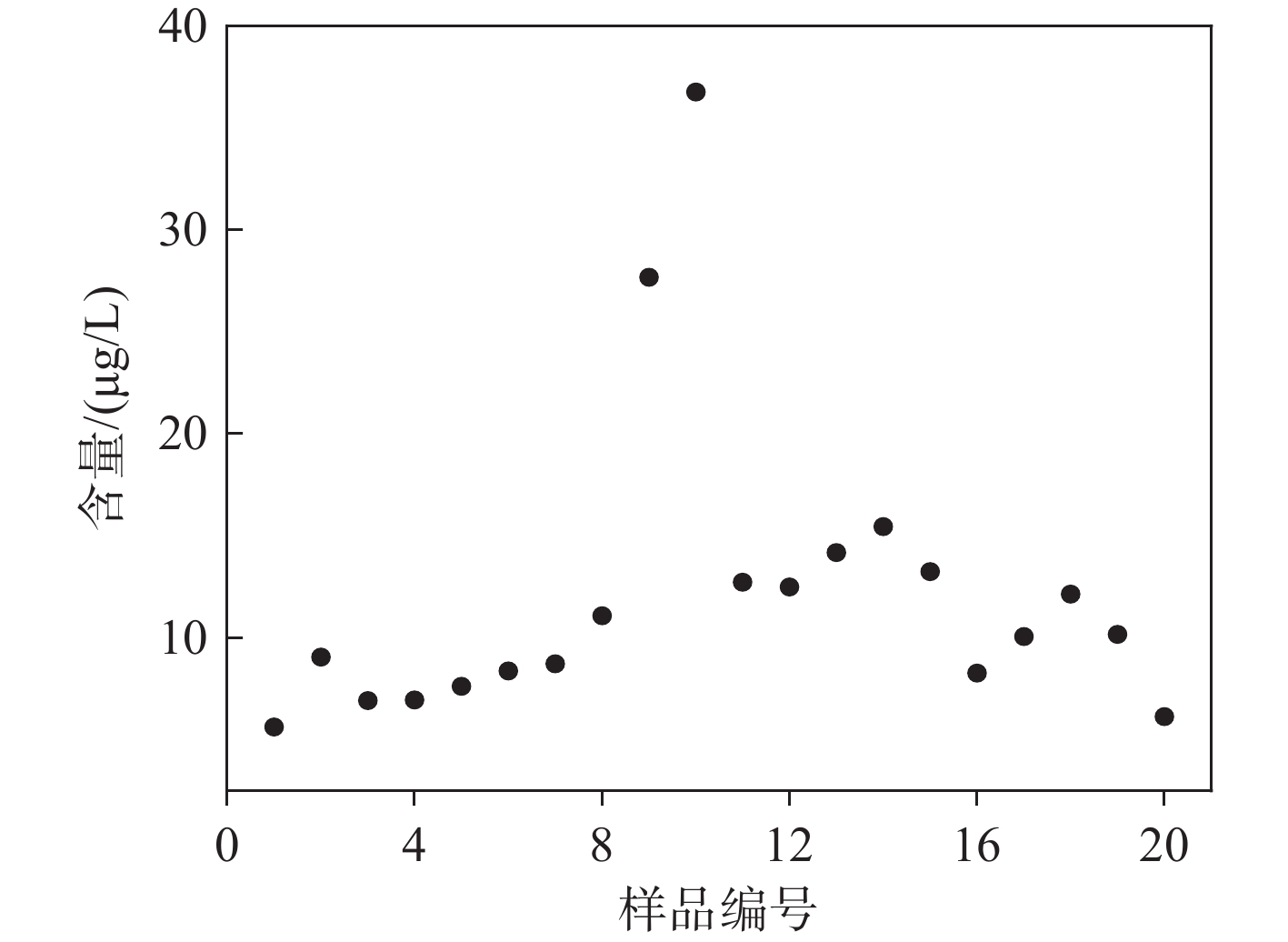
采用纸喷雾质谱法检测20例血浆样本中他克莫司含量,结果示于图8。可知,他克莫司含量范围为5.62~36.75 μg/L,RSD在1.75%~14.41%之间。
-
本研究基于自主研制的QLIT-6610MD液相色谱-串联质谱系统,结合纸喷雾电离技术,建立了一种高效定量检测血浆中他克莫司的方法。使用有机溶剂对血浆样本进行沉淀,并吸取上清液进行检测,整个检测过程仅需1 min。由于样品基质复杂,故采用他克莫司三级离子进行定量分析,专属性良好。通过优化纸喷雾离子源的纸基材料、纸基大小、纸基尖端与质谱口距离和溶剂类型等,增强离子强度,提高检测灵敏度。通过优化质谱碎裂能量和碎裂q点,离子强度增强约4倍。他克莫司在5.00~1 000.00 μg/L浓度范围内的线性方程为y=0.002 39x−0.021 92,相关系数(R²)为0.998,LOD和LOQ分别为1.00、5.00 μg/L,准确度在95.23%~102.39%之间,精密度在4.17%~13.39%之间,基质效应归一化因子(RSD)≤8.88%。采用该方法对20例血浆样本进行他克莫司定量分析,得到的含量范围为5.62~36.75 μg/L,RSD在1.75%~14.41%之间。
后续研究将对纸基进行物理或化学方法优化,如改进纸基的制备工艺、引入功能化涂层等,以增强纸基对目标物的吸附与传输效率,进而提升方法的灵敏度和精密度。
基于多级碎裂的纸喷雾原位质谱法测定血浆中他克莫司
Determination of Tacrolimus in Plasma by Paper Spray In-situ Mass Spectrometry Based on Multistage Fragmentation
-
摘要: 本研究采用自主研制的四极杆-线形离子阱串联质谱系统,建立了纸喷雾原位质谱快速检测血浆中他克莫司的方法。为了缩短检测时间,使用有机溶剂对血浆样本进行沉淀,然后吸取上清液进行检测。由于样品基质复杂,采用他克莫司三级碎裂离子进行定量分析。通过优化纸喷雾离子源和质谱条件,显著提高了检测灵敏度。结果表明,他克莫司在5.00~1 000.00 μg/L范围内的线性关系良好,相关系数(R2)为0.998,检出限和定量限分别为1.00、5.00 μg/L,准确度在95.23%~102.39%之间,日内和日间精密度范围分别为6.17%~11.90%和5.30%~13.39%,基质效应归一化因子(RSD)≤8.88%。采用该方法检测20例血浆样本中他克莫司的含量范围为5.62~36.75 μg/L,RSD在1.75%~14.41%之间,表明精密度良好。该方法有望成为一种快速检测血药的替代方案。Abstract: As an immunosuppressive agent isolated from Streptomyces, tacrolimus exerts its immunosuppressive effect mainly by interfering with T-cell activation. However, tacrolimus has a narrow therapeutic window, and excessively high concentrations can cause drug toxicity. Therefore, the degree of immunosuppression and adverse reactions of tacrolimus are closely related to its blood concentration, even when the blood concentration is within the therapeutic window, patients often experience adverse reactions such as nephrotoxicity and digestive system discomfort. Among various detection methods for blood immunosuppressants, mass spectrometry has become the gold standard for clinical therapeutic drug monitoring (TDM) of immunosuppressants. Compared with traditional ionization technologies, paper spray technology has significant advantages, as it can greatly reduce the use of solvents, simplify pretreatment steps, and improve analysis efficiency. In this study, a new multistage fragmentation method for the rapid detection of tacrolimus in plasma by paper spray in-situ mass spectrometry was established using an independently developed quadrupole-linear ion trap tandem mass spectrometry system. To minimize detection time, plasma samples were precipitated with an organic solvent containing an internal standard, and then the supernatant was aspirated for detection. Due to the complexity of the sample matrix, the tertiary fragment ions of tacrolimus were used for quantitative analysis. By optimizing the conditions of the paper spray ion source, such as the type of paper substrate, elution solvents, shape of the paper, distance between the paper tip and the mass spectrometer port, spray voltage, as well as the mass spectrometry conditions, the detection sensitivity and limit of quantification were significantly improved. The results demonstrated a good linear relationship for tacrolimus within the linear range of 5.00 to 1 000.00 μg/L, with a correlation coefficient (R²) of 0.998. The limit of detection and limit of quantitation are 1.00 and 5.00 μg/L, respectively. The accuracy ranges from 95.23% to 102.39%, with intra-day and inter-day precision ranging from 6.17% to 11.90% and 5.30% to 13.39%, respectively. The matrix effect normalization factor (RSD) is less than 8.88%. This method was applied to monitor tacrolimus levels in 20 plasma samples, with concentrations ranging from 5.62 to 36.75 μg/L and RSD between 1.75% and 14.41%, indicating that the method has good precision and can meet the needs of clinical blood drug concentration monitoring. The entire detection process only takes 1 min to obtain quantitative results, and in scenarios requiring rapid detection of blood drugs, this method is expected to become an efficient alternative, with the potential to be applied to the concentration monitoring of other immunosuppressants.
-

-
表 1 他克莫司离子对信息
Table 1. Ion pair information of tacrolimus
化合物
Compound母离子
Parent ion
(m/z)二级子离子 Secondary product ion 三级子离子 Tertiary product ion 质荷比(m/z) 碎裂q点
q Point碎裂能量
Fragmentation
energy/%质荷比(m/z) 碎裂q点
q Point碎裂能量
Fragmentation
energy/%他克莫司 821.5 768.5 0.2 17 750.4/718.4 0.15 12 他克莫司-13C,d2 824.5 773.5 0.2 17 753.4 0.15 12 表 2 基质效应
Table 2. Matrix effect
化合物
CompoundQC浓度
QC concentration/
(mg/L)基质效应
Matrix
effect/%相对标准
偏差 RSD/%他克莫司 10 82.19 8.88 100 108.01 3.10 500 97.96 2.00 表 3 日内和日间精密度
Table 3. Intra-day and inter-day precision
化合物
Compound标示浓度
Nominal
concentration/
(μg/L)相对标准偏差RSD/% 日内
Intra-day
(n=3)日间
Inter-day
(n=3)他克莫司 10 11.90 13.39 100 4.17 8.30 500 6.69 5.30 -
[1] KINO T, HATANAKA H, HASHIMOTO M, NISHIYAMA M, GOTO T, OKUHARA M, KOHSAKA M, AOKI H, IMANAKA H. FK-506, a novel immunosuppressant isolated from a Streptomyces. I. Fermentation, isolation, and physico-chemical and biological characteristics[J]. The Journal of Antibiotics, 1987, 40(9): 1 249-1 255. [2] 宋爱凤, 胡萍, 杨大伟. 他克莫司血药浓度检测方法的研究进展[J]. 现代药物与临床, 2019, 34(11): 3 497-3 500. SONG Aifeng, HU Ping, YANG Dawei. Research progress on detection methods of tacrolimus blood concentration[J]. Drugs & Clinic, 2019, 34(11): 3 497-3 500(in Chinese). [3] MIYATA S, OHKUBO Y, MUTOH S. A review of the action of tacrolimus (FK506) on experimental models of rheumatoid arthritis[J]. Inflammation Research, 2005, 54(1): 1 -9 . doi: 10.1007/s00011-004-1318-5[4] 张金萍, 王相峰, 宋燕青. CYP3A5多态性对肾移植术后患者他克莫司药代动力学的影响[J]. 实用器官移植电子杂志, 2020, 8(1): 68 -70 . doi: 10.3969/j.issn.2095-5332.2020.01.018 ZHANG Jinping, WANG Xiangfeng, SONG Yanqing. Effect of CYP3A5 polymorphism on pharmacokinetics of tacrolimus in patients after renal transplantation[J]. Practical Journal of Organ Transplantation (Electronic Version), 2020, 8(1):68 -70 (in Chinese). doi: 10.3969/j.issn.2095-5332.2020.01.018[5] 王意如. 免疫抑制剂研究新进展[J]. 中国新药杂志, 2002, 11(7): 512 -515 . doi: 10.3321/j.issn:1003-3734.2002.07.004 WANG Yiru. Recent advances in immunosuppressive drugs[J]. Chinese New Drugs Journal, 2002, 11(7):512 -515 (in Chinese). doi: 10.3321/j.issn:1003-3734.2002.07.004[6] 黄金沐, 池慧琼, 张忠阳. 他克莫司的研究概况[J]. 海峡药学, 2010, 22(11): 148 -150 . doi: 10.3969/j.issn.1006-3765.2010.11.073 HUANG Jinmu, CHI Huiqiong, ZHANG Zhongyang. General situation of tacrolimus research[J]. Strait Pharmaceutical Journal, 2010, 22(11):148 -150 (in Chinese). doi: 10.3969/j.issn.1006-3765.2010.11.073[7] 王立明, 闵志廉, 朱有华, 高春芳, 陆慧琦, 周梅生, 姚亚成. 肾移植受者应用他克莫司治疗窗浓度的探讨[J]. 中华器官移植杂志, 2000, 21(3): 145 -146 . WANG Liming, MIN Zhilian, ZHU Youhua, GAO Chunfang, LU Huiqi, ZHOU Meisheng, YAO Yacheng. Clinical research of FK506 therapeutic window concentration in renal transplant recipients[J]. Chineae Journal of Organ Transplantation, 2000, 21(3):145 -146 (in Chinese) .[8] ALAK A M. Measurement of tacrolimus (FK506) and its metabolites: a review of assay development and application in therapeutic drug monitoring and pharmacokinetic studies[J]. Therapeutic Drug Monitoring, 1997, 19(3): 338 -351 . doi: 10.1097/00007691-199706000-00016[9] RODRÍGUEZ FABA O, BOISSIER R, BUDDE K, FIGUEIREDO A, TAYLOR C F, HEVIA V, LLEDÓ GARCÍA E, REGELE H, ZAKRI R H, OLSBURGH J, BREDA A. European association of urology guidelines on renal transplantation: update 2018[J]. European Urology Focus, 2018, 4(2): 208 -215 . doi: 10.1016/j.euf.2018.07.014[10] BANSAL S. Therapeutic drug monitoring of tacrolimus in kidney transplantation[J]. Indian Journal of Transplantation, 2020, 14(1): 8 . doi: 10.4103/ijot.ijot_4_20[11] 孙艺哲, 张平安. 肾移植患者他克莫司血药谷浓度与肝肾功能及血常规指标的关系[J]. 贵州医药, 2019, 43(1): 79 -82 . doi: 10.3969/j.issn.1000-744X.2019.01.027 SUN Yizhe, ZHANG Ping’an. Relationship between the concentration of tacrolimus in blood and liver and kidney function and blood routine indexes in renal transplant patients[J]. Guizhou Medical Journal, 2019, 43(1):79 -82 (in Chinese). doi: 10.3969/j.issn.1000-744X.2019.01.027[12] 陈惠芳, 刘锋, 吴丽荣, 苏丽婷. 环孢素A和他克莫司血药浓度检测方法比较分析[J]. 中国处方药, 2019, 17(9): 41 -42 . CHEN Huifang, LIU Feng, WU Lirong, SU Liting. Comparative analysis of detection methods of cyclosporine A and tacrolimus in blood[J]. Journal of China Prescription Drug, 2019, 17(9):41 -42 (in Chinese).[13] 梁陈方, 王亚洲. 反相高效液相色谱法测定他克莫司的血药浓度[J]. 广西医学, 2009, 31(3): 425 -426 . LIANG Chenfang, WANG Yazhou. Determination of tacrolimus in plasma by RP-HPLC[J]. Guangxi Medical Journal, 2009, 31(3):425 -426 (in Chinese).[14] SHIPKOVA M, VALBUENA H. Liquid chromatography tandem mass spectrometry for therapeutic drug monitoring of immunosuppressive drugs: achievements, lessons and open issues[J]. TrAC Trends in Analytical Chemistry, 2016, 84: 23 -33 . doi: 10.1016/j.trac.2016.01.031[15] ZHENG Y Z, WANG S. Advances in antifungal drug measurement by liquid chromatography-mass spectrometry[J]. Clinica Chimica Acta, 2019, 491: 132 -145 . doi: 10.1016/j.cca.2019.01.023[16] BIANCHI F, RIBONI N, TERMOPOLI V, MENDEZ L, MEDINA I, ILAG L, CAPPIELLO A, CARERI M. MS-based analytical techniques: advances in spray-based methods and EI-LC-MS applications[J]. Journal of Analytical Methods in Chemistry, 2018, 2018(1): 1 308 167. [17] 刘欢, 崔球. 原位电离质谱技术在微生物菌株筛选中的应用进展[J]. 合成生物学, 2023, 4(5): 980 -999 . LIU Huan, CUI Qiu. Advances and applications of ambient ionization mass spectrometry in screening of microbial strains[J]. Synthetic Biology Journal, 2023, 4(5):980 -999 (in Chinese).[18] THOMAS S N, FRENCH D, JANNETTO P J, RAPPOLD B A, CLARKE W A. Liquid chromatography-tandem mass spectrometry for clinical diagnostics[J]. Nature Reviews Methods Primers, 2022, 2(1): 96 . doi: 10.1038/s43586-022-00175-x[19] BENEITO-CAMBRA M, GILBERT-LÓPEZ B, MORENO-GONZÁLEZ D, BOUZA M, FRANZKE J, GARCÍA-REYES J F, MOLINA-DÍAZ A. Ambient (desorption/ionization) mass spectrometry methods for pesticide testing in food: a review[J]. Analytical Methods, 2020, 12(40): 4 831-4 852. [20] McBRIDE E M, MACH P M, DHUMMAKUPT E S, DOWLING S, CARMANY D O, DEMOND P S, RIZZO G, MANICKE N E, GLAROS T. Paper spray ionization: applications and perspectives[J]. TrAC Trends in Analytical Chemistry, 2019, 118: 722 -730 . doi: 10.1016/j.trac.2019.06.028[21] ESPY R D, MANICKE N E, OUYANG Z, GRAHAM COOKS R. Rapid analysis of whole blood by paper spray mass spectrometry for point-of-care therapeutic drug monitoring[J]. The Analyst, 2012, 137(10): 2 344-2 349. -


 首页
首页 登录
登录 注册
注册



 下载:
下载: