-
水凝胶具有含水量高、生物相容性及柔软性好等特点,在生物医学[1]、食品[2]和环境[3]等领域展现出广泛的应用前景。然而,未经改性的水凝胶固有的力学性能一般较弱,极大地限制了其应用场景。因此,探究高强度水凝胶的制备途径也成为该领域至关重要的研究方向[4]。依据水凝胶三维网络结构交联方式的差异,水凝胶可分为物理交联型和化学交联型2大类[4]。其中,化学交联方法包括互穿聚合网络、互补基团交联、自由基聚合和辐射交联等;物理交联方法则主要包括氢键相互作用、疏水缔合及离子交联等机制。通常情况下,通过化学交联形成的水凝胶具备较优异的力学强度,然而,交联剂的潜在毒性成为限制提高此类凝胶生物相容性的主要因素。随着水凝胶在医学领域应用范围的不断拓展,物理交联凝胶因制备条件温和、所制备凝胶柔韧性好、易成形等优势逐渐引起人们的重视。同时,无需额外交联剂的交联过程又使其在具有良好环保性的同时,最大程度地保持凝胶的生物相容性。因此,物理交联方法逐渐成为水凝胶制备的主要发展方向[5]。
在众多基于物理交联的凝胶制备方法中,冷冻解冻法因其操作尤为简便、无需添加化学试剂以及成形效果良好等优势得以广泛应用[6]。1975年,Peppas[7]基于水的相变以及聚合物链在低温下的聚集行为,首次系统地提出了利用冷冻解冻法制备聚乙烯醇(polyvinyl alcohol,PVA)水凝胶的方案:首先,对高分子水溶液进行冷冻,水分子迅速结晶形成冰晶,高分子链受自由能主导围绕冰晶规则排列;然后,进入升温解冻阶段,冰晶融化,高分子链恢复移动活性;最后,高分子链之间通过物理作用(如氢键与范德华力等相互作用)构建相互交联的三维网络结构[8]。此后,这一方法被应用于复合凝胶[9]、生物相容性凝胶[10–11]和双网络凝胶[12]等新型材料的制备,极大地拓宽了冷冻-解冻法(freeze-thaw,FT)的应用范围。冷冻-解冻法可以通过调节冷冻与解冻的温度、时间和频次等过程参数,进而调节水凝胶的物理和机械性能[13],如水分保持能力、柔韧性等,使材料更加符合使用场景所需的性能,目前已经成为制备具有特定性质水凝胶的关键技术手段。
压力作为物理学中的关键变量之一,与温度存在着紧密的关系。在热力学范畴内,特定条件下,压力与温度具有等效性,两者对物质的相态和性质均具有显著影响。通常,温度升高会加剧分子的热运动;而施加压力则能够使物质体积减小,进而增强分子间的相互作用力[14]。这2个因素均可改变分子的聚集状态以及排列方式,在其作用下,物质在相变过程中展现出各异的物理和化学特性。鉴于凝胶体系中压力诱导相变过程与冷冻-解冻法中温度诱导过程的相似性,通过施加压力实现凝胶制备和性能调控具备可行性[15–16]。此新方法为凝胶材料的合成及其性能调控开拓了创新性的思路,并为凝胶在更广泛领域的应用提供了可能性。
本研究以聚乙烯醇和透明质酸(hyaluronic acid,HA)为例,基于自主研发的动态加载/卸载装置[17],通过循环加压-卸压(alternate compression-decompression,ACD)技术制备凝胶,并探讨通过控制制备过程中加载幅度、加载速率和加载频次等参数实现水凝胶性质调控。
-
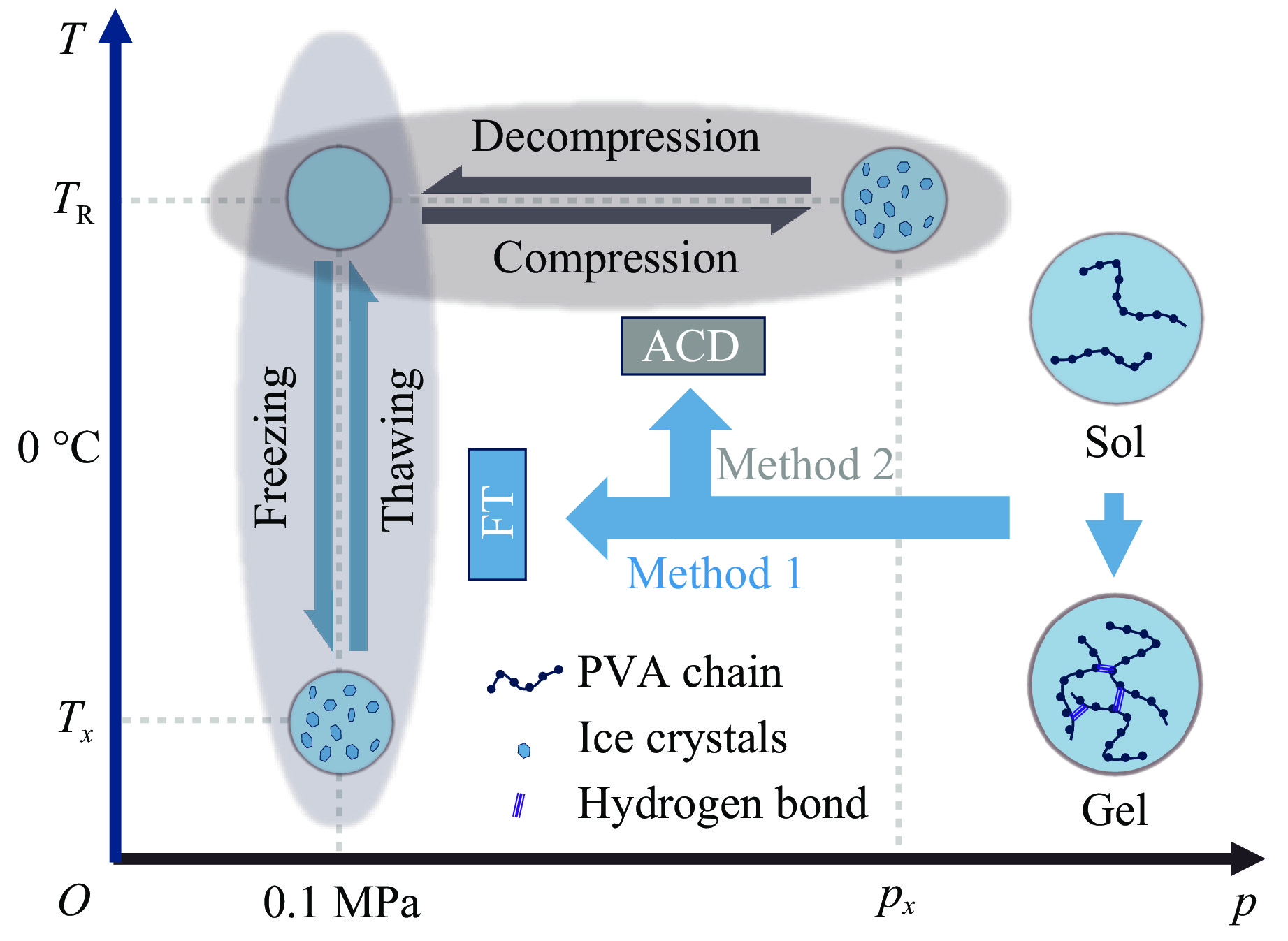
图1给出了循环加压-卸压方法制备水凝胶的示意图,展示了加压-卸压过程中高分子水溶液凝胶化的过程。图1中:
$T_x $ 和$p_x $ 为随溶液不同而变化的温度和压力。在室温(TR)下,溶液中的溶剂在压力作用下发生相变,且相变压力通常受溶剂内离子浓度的影响。当压力超过相变压力$p_x $ 时,溶剂发生相变,其中$p_x $ 与溶剂内的离子有关,此时体系形成微观的两相区:其一为冻结相,另一相是未冻结的液体微区。在未冻结的液体微区内,聚合物分子浓度提高,并在压力作用下通过分子间相互作用力形成交联,进而形成三维网络结构。在卸压过程中,溶剂恢复为液态,未冻结区所形成的三维网络结构得以保留,随后液体溶液填充至该网络结构中,最终形成凝胶。值得注意的是,在高压条件下,高分子链受限于狭小的液体微区和高浓度引起的分子链缠结,交联效率大大降低;而在卸压过程中,虽然液体微区扩大且高分子链运动加剧,但浓度和压力的降低使得分子间相互作用减弱[18]。然而,循环加压-卸压处理能够通过反复调整压力,确保凝胶长期保持较高的交联效率。
-
以聚乙烯醇和透明质酸为例,针对同一溶液,分别采用冷冻-解冻法和加压-卸压法制备凝胶,并比较2种方法制备的凝胶在外观、力学性能以及微结构上的异同。
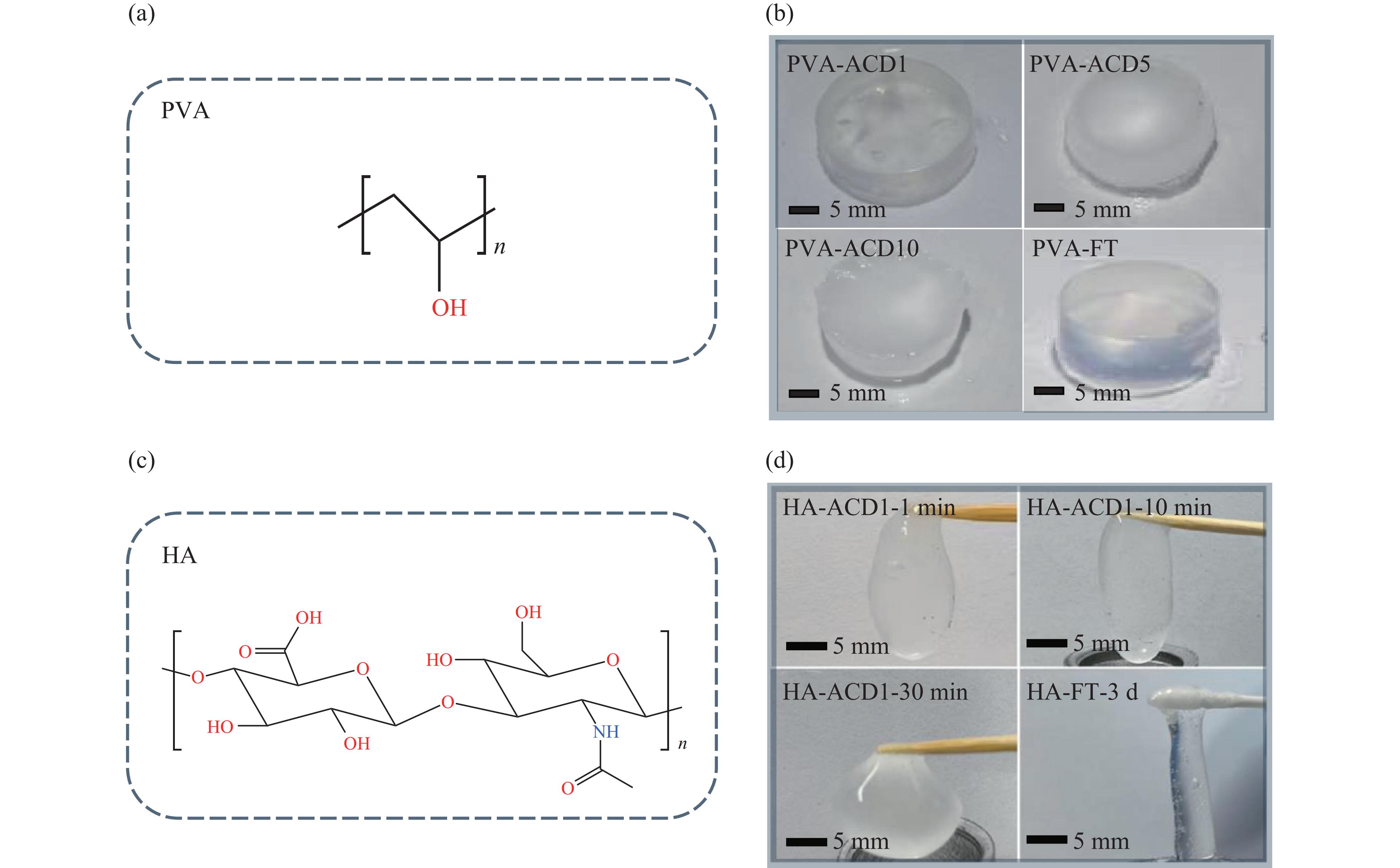
聚乙烯醇是一种由聚乙酸乙烯酯部分或全部羟基化而成的一种高分子聚合物[19],其化学式如图2(a)所示。聚乙烯醇具有良好的成膜、黏合和乳化性能,在特定条件下能够结晶并形成水凝胶。鉴于其出色的生物相容性、可调节的机械性能(如韧性、弹性、抗疲劳性)以及低毒性,聚乙烯醇水凝胶被广泛应用于生物医学领域,如药物输送、组织工程、生物模型和医用敷料等[20–21]。本研究采用的聚乙烯醇由Sigma-Aldrich提供,分子量在8.9×104~9.8×104之间。聚乙烯醇凝胶的制备方法:首先,将10 g聚乙烯醇粉末溶解于90 mL去离子水中,在96 ℃下恒温加热并搅拌6 h以上,直至聚乙烯醇完全溶解,配制成质量分数为10%的聚乙烯醇水溶液;然后,将得到的均匀溶液缓慢冷却到室温(25±1) ℃,并静置4 h以去除气泡;最后,在室温下,以0.001 GPa/s的速度将质量分数为10%的聚乙烯醇水溶液从常压(液体)压缩至1.2 GPa,保压2 min并以相同速率卸压至常压。以上加压-保压-卸压过程被视为一个循环。冷冻-解冻法制备聚乙烯醇水凝胶则是在−20 ℃下冷冻12 h,再在25 ℃下解冻制备。从图2(b)可以看出,随着加压、卸压次数的增多,聚乙烯醇水凝胶逐渐从透明变为白色不透明状态,并在反复加卸压10次后体积明显减小。采用与10次循环加压-卸压相同时间(1 h)时,通过冷冻-解冻法制备的聚乙烯醇水凝胶的透明度更高,但成形效果弱于加压-卸压法制备的凝胶成型效果。
透明质酸是一种天然存在的线性多糖,化学式为 (C14H21NO11)n,如图2(c)所示,由 D-葡萄糖醛酸和N-乙酰-D-氨基葡萄糖交替连接而成[22]。透明质酸广泛存在于细胞外基质和结缔组织中,具有优异的保水性、生物相容性和生物降解性,在细胞增殖、迁移和组织修复中发挥着重要作用。透明质酸能够通过冷冻-解冻法形成水凝胶,广泛应用于药物输送、组织工程和再生医学等领域[23–24],因其可调控的降解速率和促进细胞生长的特性而备受关注。本研究采用的透明质酸由福瑞达制药有限公司提供,分子量为1.66×106。透明质酸水凝胶的制备方法是:首先,将1 g透明质酸粉末溶解于99 mL去离子水中,配制成10 g/L的透明质酸水溶液,调制透明质酸溶液的pH值至1.5;然后,将酸化后的溶液立即以104 r/min的速度离心30 min以去除气泡。将冷冻-解冻法制备的透明质酸水凝胶作为参考样品:在−20 ℃下冷冻3 d,然后在25 ℃下解冻3 h。加压-卸压法制备透明质酸水凝胶的步骤为:室温下,在10 s内将质量分数为1%的透明质酸水溶液从常压(液体)压缩至1.8 GPa,在该压力分别保持1、10和30 min,随后卸压至常压,得到压力型透明质酸水凝胶,生成的样品分别命名为ACD1-1 min、ACD1-10 min和ACD1-30 min。用牙签提起凝胶,在重力作用下,原本呈圆柱状的凝胶被拉长的程度越小,越能维持其初始状态,表明该凝胶的机械性能越好。通过调整透明质酸在加压-卸压过程中的保压时间,可以观察到,随着保压时间的延长,其强度呈显著升高趋势。与之形成对比的是,采用冷冻-解冻法在更长时间内制备的凝胶,其强度明显低于采用加压-卸压法制备的凝胶。
将冷冻-解冻法与加压-卸压法制备的水凝胶进行对比测试,发现在实现凝胶制备的前提下,加压-卸压法能够实现溶液到凝胶的快速转化。2种制备方法中溶液经历了相似的动力学过程。在传统水凝胶制备过程中,温度降低往往会使分子运动速率下降,进而延长凝胶的形成时间。而加压-卸压法引发相分离,有效克服了因温度降低致使分子运动减缓的问题;同时,加压-卸压法通过施加压力,在一定程度上增加了溶液的分子间相互作用力,促使分子在短时间内更高效地聚集和排列。加压-卸压法不仅加快了相分离速度,还能在相变过程中保持较高的分子活性,最终实现更快速的凝胶化。
-
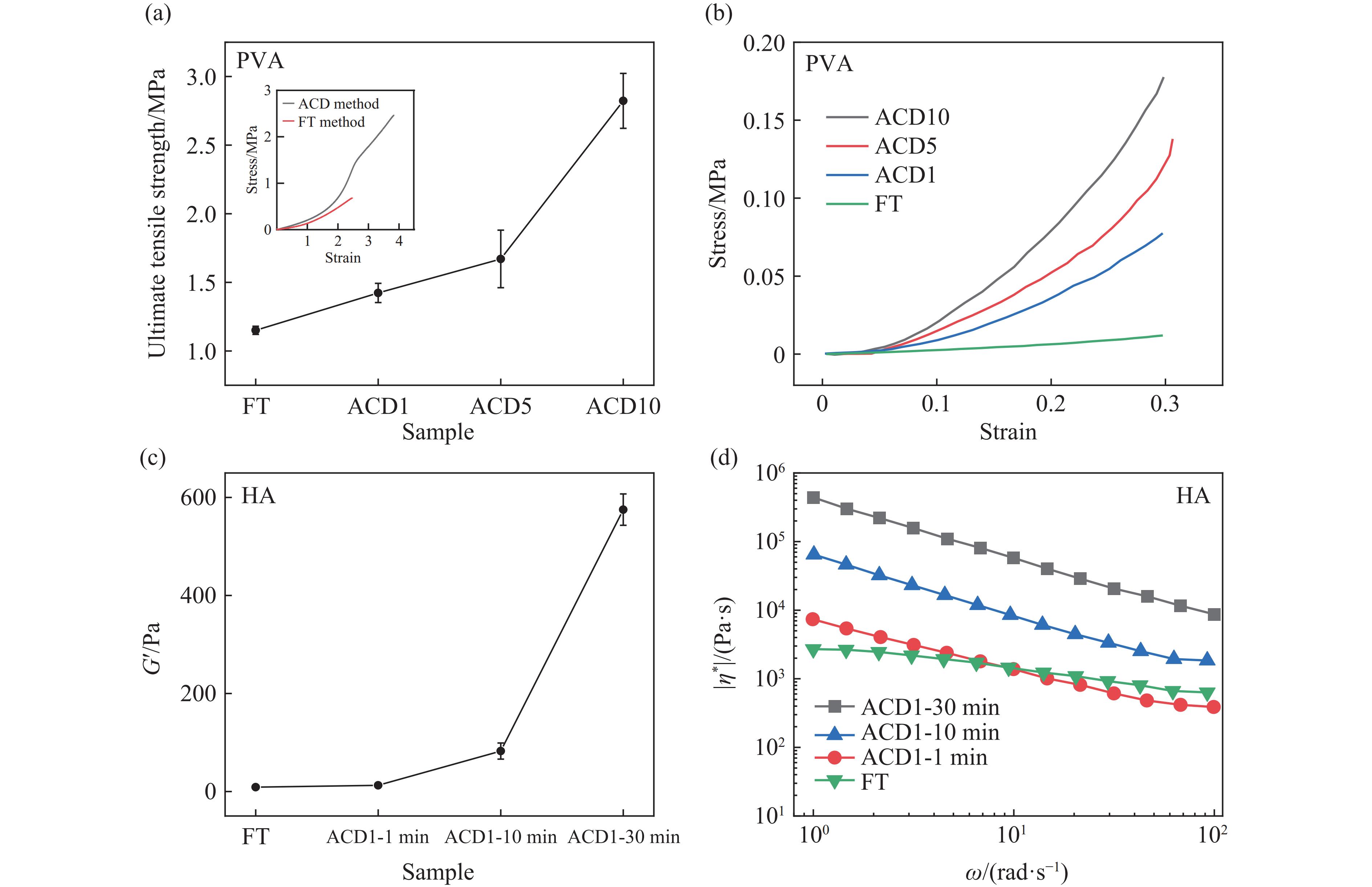
在此基础上,进一步对比冷冻-解冻法与加压-卸压法制备凝胶的力学性能。针对强度较高的聚乙烯醇进行了拉伸和压缩测试。将制备好的圆柱形凝胶切割成矩形试样进行拉伸试验,典型拉伸试样的尺寸为15.0 mm×8.0 mm×1.5 mm。拉伸测试加载速率为2 mm/min,图3展示了采用2种方法制备的凝胶的应力-应变曲线及其极限抗拉强度(ultimate tensile strength,UTS)。与采用冷冻-解冻法制备的样品(FT样品)相比,采用加压-卸压法制备的凝胶的极限抗拉强度显著提高,并且随着循环次数的增加,极限抗拉强度逐渐提升。最终,在循环次数达到10次时,极限抗拉强度提高了约3倍。在抗压测试中,采用固定应变(30%)测试聚乙烯醇的应力-应变曲线,结果显示,其压缩性能随着循环次数的增加显著提高。通过加压-卸压法制备的水凝胶的压缩应力(固定应变为30%时约为0.18 MPa)是通过冷冻-解冻法制备的凝胶的压缩应力(固定应变为30%时约为0.013 MPa)的14倍。对于力学性能相对较弱的透明质酸,则通过流变测试评估其性能。测试采用直径为40 mm、间距1 mm的平行板。为了避免测试过程中水分蒸发,在其周围添加了一层薄薄的硅油。在线性动态黏弹性区域进行频率扫描测试(频率
$\omega $ 为1~100 rad/s)以获得复黏度(|η*|)、储能模量(G΄)和损耗模量。透明质酸水凝胶的弹性模量和复黏度随着保压时间的延长显著提升。仅保压1 min即可实现与冷冻解冻3 d相当的力学性能,而保压30 min的透明质酸水凝胶的力学强度大大提升。在水凝胶的制备过程中,与冷冻-解冻法相比,加压-卸压法通过施加压力,影响了未冻结的液态微区环境,显著增强了高分子链之间的相互作用力。这种增强作用促使溶液中的分子能够以更高效的方式聚集与排列。具体而言,施加的外部压力增加了溶液中分子的聚集程度,进而提升了分子间相互作用的强度。这一过程改善了分子链的缠结和交联程度,形成了更加紧密和有序的网络结构。这样的三维网络结构对于力学性能的提升至关重要,能够有效分散外部施加的应力,提高凝胶的强度和韧性,从而实现更强的力学性能。
-
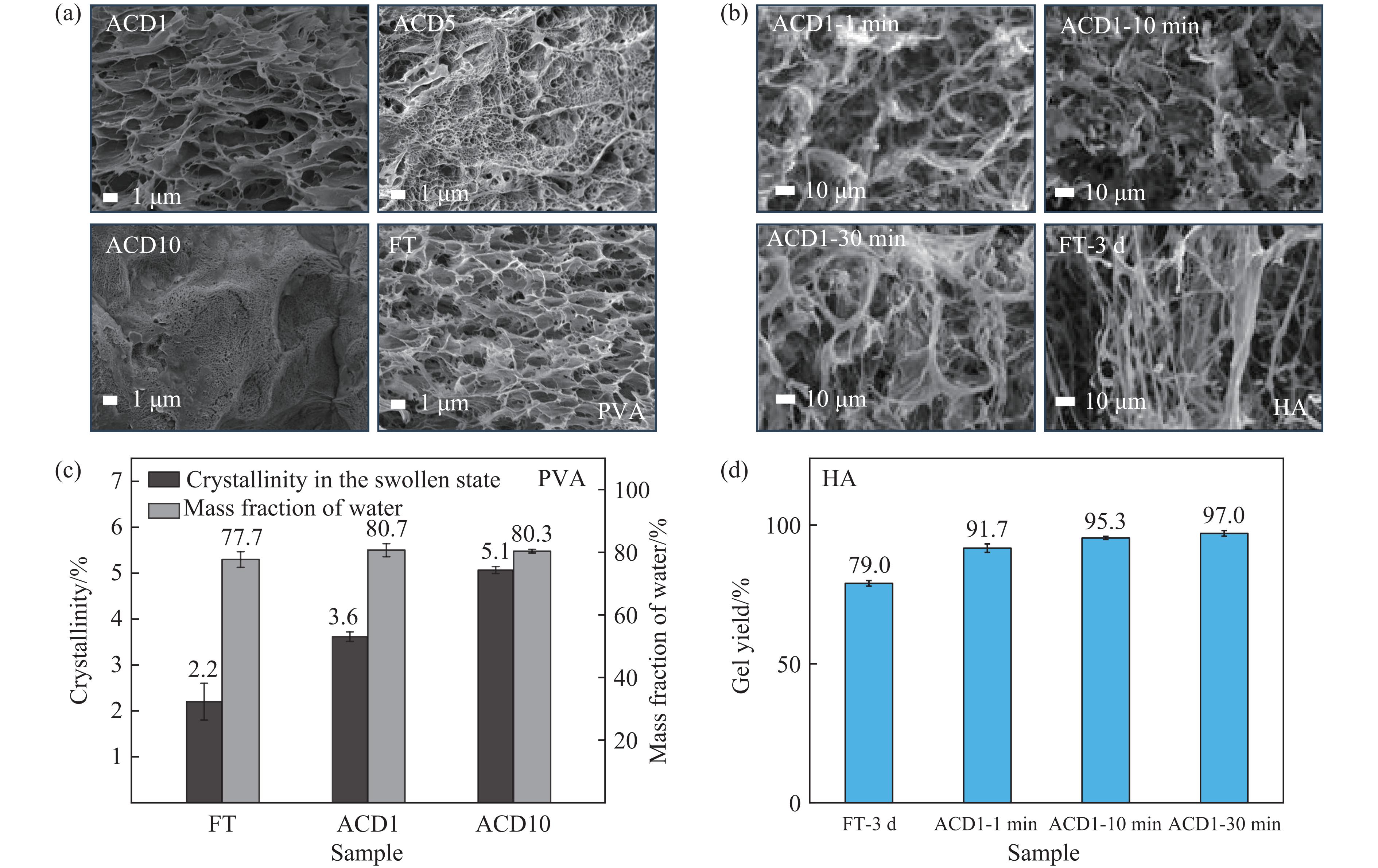
为阐释循环加压-卸压技术提升水凝胶强度的机理,采用扫描电子显微镜(scanning electron microscope,SEM)对所制备的样品进行微观结构特征。首先,对样品进行12 h冷冻干燥;然后,将获得的样品切割成适合观察的块体,表面喷铂以增强导电性;最后,对样品进行观察分析。结果表明:冷冻-解冻法制备的聚乙烯醇凝胶具有较大的孔隙率,而经加压-卸压法处理的凝胶的孔隙相对较小。同时,随着压缩次数的增多,孔隙逐渐减小,从最初的约3 µm减小到约0.1 µm,如图4(a)所示。这是由于孔隙形成后,经过反复的相分离过程,会在已成形的微孔结构中构建二级孔隙,使得凝胶产率提高,而凝胶强度得以提升。同时,在循环加压-卸压过程中,原有形成的交联结构得以增强,也使得孔隙更加密集。采用冷冻-解冻法制备的透明质酸水凝胶呈现束状结构,而经循环加压-卸压技术处理的透明质酸水凝胶更多呈现为层状结构。这是由于,在压力作用下,凝胶交联更为高效,与周围形成了更紧密的结构。由此可见,加压-卸压法能够在一定程度上调控水凝胶的微观结构与物理性质,如孔隙率和机械强度。
在聚乙烯醇凝胶体系中,分子链因溶液环境的改变发生排列与聚集现象,进而形成微晶区域。微晶的形成有助于提高凝胶的强度和刚性。通常来说,微晶的形成过程受温度和浓度的影响。在较低温度下,聚乙烯醇链的运动受到限制的程度增大,为结晶的形成创造了条件,同时温度降低使得结晶产生的效率难以提高。更高的浓度增加了缠结,使得高分子链的受限程度提高,同样影响晶体的产生效率。加压-卸压过程能够促使聚乙烯醇微晶高效地形成,外界动态压力使得凝胶在高压时进入高分子链受限与高浓度状态形成结晶,而低压时未参与结晶和部分参与结晶的高分子链的移动活性提高,并在下一次加压过程中更加充分地参与结晶。同时,由于这一过程在室温下完成,使得高分子链的移动活性被充分激发。更高的结晶度使得凝胶机械性能得到充分的强化。对凝胶进行差示扫描量热(differential scanning calorimeter,DSC)测试:将样品浸泡在戊二醛和盐酸水溶液中进行无定形聚合物固定,再放入去离子水中浸泡,除去多余的戊二醛和盐酸,将质量为M0的样品进行干燥,干燥后的样品质量为M,在氩气气氛下以5 ℃/min的速率从50 ℃加热到280 ℃,流速为30 mL/min。分析升温至200~250 ℃时晶畴熔化的吸热窄峰计算熔化焓H0,已知PVA在平衡熔点的熔化焓为138.6 J/g,结晶度X的计算公式为
结果表明:采用加压-卸压法制备的凝胶的结晶度约为3.6%,高于冷冻-解冻法制备的凝胶的结晶度(约为2.1%)。这是因为,压力作用缩短了高分子链之间的间距,使得分子链在相互接近过程中更易形成微晶。此外,随着反复加压-卸压次数的增加,凝胶结晶度进一步提高,可达约5.1%。上述结果表明:在循环加压-卸压过程中,持续有新的结晶生成,从而促使凝胶强度逐渐提升。由此可见,加压-卸压过程对凝胶结晶具有促进作用,进而实现了力学性能的增强。同时,研究还发现,循环加压-卸压技术制备的水凝胶具有更高的含水量,这是由于压力型水凝胶的孔隙结构更完整,更有利于保持水分。
透明质酸在形成凝胶的过程中并不倾向于形成结晶,凝胶的形成主要依赖分子间的疏水作用与氢键的协同作用。在加压过程中,透明质酸大分子链围绕形成的冰晶交联成网状结构,抑制冰晶生长并形成多孔层状网络。卸压后,分子链进一步交联,冰晶转化为水填充于三维网状结构中,从而提高透明质酸水凝胶的产量、结构稳定性和含水量。通过对比凝胶产率来判断制备方式对凝胶强度的提升作用,凝胶产率定义为
式中:C0为透明质酸的初始浓度,C为去胶后剩余溶液中透明质酸的浓度。采用体积排除色谱法检测样品浓度。对比图4(d)可以发现,冷冻-解冻3 d制备的凝胶产率为79.0%,而通过加压-卸压约2 min得到的凝胶产率可达90%以上。上述研究结果表明:加压-卸压法能够促使溶液中的高分子更多地参与交联过程,从而使凝胶具备更高的强度,这一结论与扫描电子显微镜表征结果一致。
通过PVA和HA的实例,证明了循环加压-卸压技术作为物理方法制备凝胶的优势,充分体现了此方法制备速度快、强度高的特点,可以成为水凝胶制备的理想新方法。
-
通过对比冷冻-解冻法与加压-卸压法制备的PVA和HA凝胶在形貌、力学性能及微结构方面的差异,展示了循环加压-卸压技术作为一种新兴水凝胶制备和调控手段的巨大潜力。加压-卸压法具有制备速度快、水凝胶强度高和产率高的特点。同时,压力增强了凝胶内部的氢键交联作用,促进了更强交联网络的构建。对于部分凝胶,压力有助于提高其结晶度,这些结晶显著提升了凝胶的力学性能。鉴于医药、可穿戴设备和环境保护等领域对高强度无毒凝胶的需求,循环加压-卸压技术将成为物理凝胶制备的新方法,未来也有望成为其他相关材料微结构和性质调控的重要手段。
循环加压-卸压法制备高分子水凝胶
Preparation of Polymeric Hydrogel via Alternate Compression-Decompression
-
摘要: 基于冷冻-解冻法制备凝胶原理及相关的研究成果,依托自主设计的动态加载装置,从压力调控的角度出发,系统探究了不同加载方式(加载幅度、加载速率、加载频次)对高分子水溶液胶凝过程的影响。结果表明:采用循环加压-卸压法,能够高效、快速地合成一系列具备优异机械强度的水凝胶,其潜在应用涵盖生物医学、环境保护、电子器件等多个领域。循环加压-卸压技术作为一种创新方法,不仅极大地拓展了水凝胶的制备策略,还显著提升了水凝胶在软物质科学领域的应用潜力,为该领域的进一步发展提供了新的思路和方向。Abstract: Based on the principles of gel preparation via freeze-thaw method and research progress in hydrogel synthesis, this study explores the effects of different pressure parameters systematically from the perspective of pressure regulation. Pressure magnitude, pressure compression and decompression rate, and number of cyclic loading were investigated during the gelation process of polymer solutions. By using the alternate compression-decompression (ACD) method, efficient and rapid synthesis of a series of hydrogels with excellent mechanical strength is enabled. These hydrogels have potential applications in diverse fields, including biomedicine, environmental protection, and electronic devices. As an innovative approach, the ACD method not only expands the preparation strategies for hydrogels significantly but also enhances the application potential of hydrogels in the field of soft matter science, providing new insights and directions for further development in this field.
-
Key words:
- hydrogel /
- alternate compression-decompression method /
- pressure regulation .
-

-
图 2 (a) 聚乙烯醇的化学式;(b) 循环加压-卸压法和冷冻-解冻法制备的聚乙烯醇水凝胶的外观,其中ACDm(m=1,5,10)代表反复加压、卸压次数;(c) 透明质酸的化学式;(d) 循环加压-卸压法和冷冻-解冻法制备的透明质酸水凝胶的外观,其中ACD1-t(t=1,10,30 min)代表单次加压高压的保持时间为1、10、30 min,FT-3 d表示冷冻处理样品保持时间为3 d[15]
Figure 2. (a) Chemical formula of polyvinyl alcohol; (b) appearance of polyvinyl alcohol hydrogels prepared by pressure method and freeze-thaw method, where ACDm (m=1, 5, 10) represents the number of repeated pressurization and depressurization cycles; (c) chemical formula of hyaluronic acid; (d) appearance of hyaluronic acid hydrogels prepared by pressure method and freeze-thaw method, where ACD1-t (t=1, 10, 30 min) represents the single pressurization and high-pressure holding time of 1, 10, and 30 min respectively, and FT-3 d indicates the sample held for 3 d after freeze treatment[15]
图 3 凝胶力学测试结果[15–16]:(a) 聚乙烯醇拉伸测试结果,不同循环次数加压-卸压法和冷冻-解冻法制备凝胶的极限抗拉强度对比,插图为加压-卸压法和冷冻-解冻法制备凝胶的应力-应变曲线;(b) 聚乙烯醇抗压测试结果,30%应变压缩聚乙烯醇凝胶的应力-应变曲线;(c) 加压-卸压法和冷冻-解冻法制备透明质酸凝胶的储能模量;(d) 加压-卸压法和冷冻-解冻法制备透明质酸凝胶的复黏度
Figure 3. Mechanical test results of gels[15–16]: (a) tensile test results of polyvinyl alcohol, the small figure shows the stress-strain curves of gels prepared by the compression and unloading method and the freeze-thaw method, and the large figure shows the comparison of the ultimate tensile strength of gels prepared by the compression and unloading method and freeze-thaw method with different number of cycles; (b) compressive test of polyvinyl alcohol, the stress-strain curve of polyvinyl alcohol gel compressed at 30% strain; (c) storage modulus of hyaluronic acid gels prepared by compression and unloading method and freeze-thaw method; (d) reversibility viscosity of hyaluronic acid gels prepared by compression and unloading method and freeze-thaw method
图 4 加压-卸压法和冷冻-解冻法制备的聚乙烯醇凝胶(a)和透明质酸凝胶(b)的SEM影像,(c) 不同制备方法得到的聚乙烯醇凝胶的结晶度和含水量,(d) 不同制备方法得到的透明质酸凝胶的凝胶产率
Figure 4. SEM images of polyvinyl alcohol gel (a) and hyaluronic acid gel (b) prepared by alternate compression-decompression method and freeze-thaw method; (c) crystallinity and water content of polyvinyl alcohol gel prepared by different methods; (d) gel yield of hyaluronic acid gel prepared by different methods
-
[1] 王薇, 关国平, 王璐. 生物医用水凝胶研究进展 [J]. 生物医学工程学进展, 2015, 36(4): 221–225. doi: 10.3969/j.issn.1674-1242.2015.04.008 WANG W, GUAN G P, WANG L. Research progress in biomedical hydrogels [J]. Progress in Biomedical Engineering, 2015, 36(4): 221–225. doi: 10.3969/j.issn.1674-1242.2015.04.008 [2] 谭燕, 刘曦, 袁芳. 魔芋葡甘聚糖的结构、性质及其在食品中的应用 [J]. 中国调味品, 2019, 44(2): 168–174, 178. doi: 10.3969/j.issn.1000-9973.2019.02.038 TAN Y, LIU X, YUAN F. Structure, properties of konjac glucomannan and its application in food industry [J]. China Condiment, 2019, 44(2): 168–174, 178. doi: 10.3969/j.issn.1000-9973.2019.02.038 [3] CHEN X L, YANG T, CAI X L, et al. Eco-friendly hydrogel based on locust bean gum for water retaining in sandy soil [J]. International Journal of Biological Macromolecules, 2024, 275: 133490. doi: 10.1016/j.ijbiomac.2024.133490 [4] ZHANG Y S, KHADEMHOSSEINI A. Advances in engineering hydrogels [J]. Science, 2017, 356(6337): eaaf3627. doi: 10.1126/science.aaf3627 [5] 饶涛, 何显儒. 高强度物理交联水凝胶综述 [J]. 塑料工业, 2022, 50(7): 6–11. doi: 10.3969/j.issn.1005-5770.2022.07.002 RAO T, HE X R. Review of high strength physical hydrogels [J]. China Plastics Industry, 2022, 50(7): 6–11. doi: 10.3969/j.issn.1005-5770.2022.07.002 [6] LOZINSKY V I, PLIEVA F M, GALAEV I Y, et al. The potential of polymeric cryogels in bioseparation [J]. Bioseparation, 2001, 10: 163–188. doi: 10.1023/A:1016386902611 [7] PEPPAS N A. Turbidimetric studies of aqueous poly (vinyl alcohol) solutions [J]. Die Makromolekulare Chemie, 1975, 176(11): 3433–3440. doi: 10.1002/macp.1975.021761125 [8] LOZINSKY V I, DAMSHKALN L G, BROWN R, et al. Study of cryostructuring of polymer systems. XIX. on the nature of intermolecular links in the cryogels of locust bean gum [J]. Polymer International, 2000, 49(11): 1434–1443. doi: 10.1002/1097-0126(200011)49:11<1434::AID-PI525>3.0.CO;2-F [9] 程慧茹, 张德坤. PVA-Silk复合水凝胶的摩擦磨损性能研究 [J]. 润滑与密封, 2010, 35(3): 14–18, 40. doi: 10.3969/j.issn.0254-0150.2010.03.004 CHENG H R, ZHANG D K. Research on the friction and wear properties of PVA-Silk composite hydrogel [J]. Lubrication Engineering, 2010, 35(3): 14–18, 40. doi: 10.3969/j.issn.0254-0150.2010.03.004 [10] GRIGORYAN B, PAULSEN S J, CORBETT D C, et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels [J]. Science, 2019, 364(6439): 458–464. doi: 10.1126/science.aav9750 [11] LEE J H, RIM Y S, MIN W K, et al. Biocompatible and biodegradable neuromorphic device based on hyaluronic acid for implantable bioelectronics [J]. Advanced Functional Materials, 2021, 31(50): 2107074. doi: 10.1002/adfm.202107074 [12] SEDLAČÍK T, NONOYAMA T, GUO H L, et al. Preparation of tough double- and triple-network supermacroporous hydrogels through repeated cryogelation [J]. Chemistry of Materials, 2020, 32(19): 8576–8586. doi: 10.1021/acs.chemmater.0c02911 [13] ADELNIA H, ENSANDOOST R, SHEBBRIN MOONSHI S, et al. Freeze/thawed polyvinyl alcohol hydrogels: present, past and future [J]. European Polymer Journal, 2022, 164: 110974. doi: 10.1016/j.eurpolymj.2021.110974 [14] MIAO M S, SUN Y H, ZUREK E, et al. Chemistry under high pressure [J]. Nature Reviews Chemistry, 2020, 4(10): 508–527. doi: 10.1038/s41570-020-0213-0 [15] QIAO P, SHI K Y, WANG Y L, et al. Ultrafast gelation of hyaluronan hydrogels via alternate compression-decompression [J]. Food Hydrocolloids, 2023, 141: 108732. doi: 10.1016/j.foodhyd.2023.108732 [16] QIAO P, LI B, HE Y, et al. High-performance hydrogels via alternate compression-decompression [J]. The Journal of Physical Chemistry C, 2022, 126(51): 21825–21832. doi: 10.1021/acs.jpcc.2c06997 [17] SU L, SHI K Y, ZHANG L, et al. Static and dynamic diamond anvil cell (s-dDAC): a bidirectional remote controlled device for static and dynamic compression/decompression [J]. Matter and Radiation at Extremes, 2022, 7(1): 018401. doi: 10.1063/5.0061583 [18] LOZINSKY V I. Cryogels on the basis of natural and synthetic polymers: preparation, properties and application [J]. Russian Chemical Reviews, 2002, 71(6): 489–511. doi: 10.1070/RC2002v071n06ABEH000720 [19] DE BRITO CARDOSO G, SOUZA I N, PEREIRA M M, et al. Poly(vinyl alcohol) as a novel constituent to form aqueous two-phase systems with acetonitrile: phase diagrams and partitioning experiments [J]. Chemical Engineering Research and Design, 2015, 94: 317–323. doi: 10.1016/j.cherd.2014.08.009 [20] LIN S T, YUK H, ZHANG T, et al. Stretchable hydrogel electronics and devices [J]. Advanced Materials, 2016, 28(22): 4497–4505. doi: 10.1002/adma.201504152 [21] BAKER M I, WALSH S P, SCHWARTZ Z, et al. A review of polyvinyl alcohol and its uses in cartilage and orthopedic applications [J]. Journal of Biomedical Materials Research. Part B, Applied Biomaterials, 2012, 100(5): 1451–1457. doi: 10.1002/jbm.b.32694 [22] XU X, JHA A K, HARRINGTON D A, et al. Hyaluronic acid-based hydrogels: from a natural polysaccharide to complex networks [J]. Soft Matter, 2012, 8(12): 3280–3294. doi: 10.1039/C2SM06463D [23] BAKSH D, SONG L, TUAN R S. Adult mesenchymal stem cells: characterization, differentiation, and application in cell and gene therapy [J]. Journal of Cellular and Molecular Medicine, 2004, 8(3): 301–316. doi: 10.1111/j.1582-4934.2004.tb00320.x [24] ANSETH K S, METTERS A T, BRYANT S J, et al. In situ forming degradable networks and their application in tissue engineering and drug delivery [J]. Journal of Controlled Release, 2002, 78(1/2/3): 199–209. doi: 10.1016/S0168-3659(01)00500-4 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: