-
甘草为豆科植物甘草(Glycyrhiza uralensis Fisch.)的干燥根及根茎,主要分布在甘肃、新疆和内蒙古等地[1],具有补脾益气、清热解毒、祛痰止咳、缓急止痛及调和诸药之功效,被称为“国老”或“甜草”。甘草不仅可以作为天然的食品甜味增味剂[2],还被广泛应用于制药、化妆品和卷烟等行业[3]。蜂蜜作为常见的天然食品添加剂,含有丰富的糖、氨基酸和多酚类化合物[4],生甘草与蜂蜜混匀、加热炮制而成的炙甘草可以显著提高甘草中药效成分的含量[5]。炙甘草中含有糖、甘草酸、甘草次酸、甘草皂苷、甘草黄苷和甘草黄酮等多种有效成分[6],具有润肺止咳、清热解毒和缓急止痛等功效[7]。因此,探究甘草蜜炙过程中的化学成分变化机制对研究其品质和药效有着重要意义。研究[8-10]表明,产地是影响甘草品质的重要因素。Cui等[8]研究发现,不同产地栽培的甘草,其产量和品质存在显著差异;景泰和阿勒泰试验点栽培的甘草产量高,但品质较差;赤峰和渝中试验点栽培的甘草品质优,但产量低;而白城试验点栽培的甘草品质和产量均较低。
目前,已有研究[11]采用液相色谱-质谱(LC-MS)法分析甘草甲醇提取物中的甘草素、异甘草素和甘草酸等46种药效成分,有效表征了甘草苷、甘草素和异甘草素等3种酚类化合物及三萜类化合物甘草酸,并对其余42种已知化合物进行鉴定。另外,有研究[12]利用超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF MS)法对甘草粉末甲醇提取物中类黄酮、黄烷酮、查尔酮和异黄酮等51种酚类化合物进行色谱分离和结构表征。针对甘草中的初级化合物,Farag等[13]利用气相色谱-质谱(GC-MS)法分析甘草粉末甲醇提取物中丝氨酸、脯氨酸和糖类等33种初级化合物。对于甘草中的农药残留物,Guo等[14]改进了一种QuEChERS-超高效液相色谱-串联质谱(QuEChERS-UPLC-MS/MS)法,用于甘草中86种农药残留物的在线、同时检测和定性分析。目前,采用UPLC-Q TOF MS[15]、超高效液相色谱-四极杆-静电场轨道阱质谱(UHPLC-Q-Orbitrap/MS)[16]、LC-MS、GC-MS等方法检测复杂样品时,往往需要样品预处理[17],不仅耗时、耗力,还会损失部分样品信息。因此,实现原位、快速、无损分析甘草蜜炙过程中的品质变化是当前亟需解决的问题。
中性解吸-电喷雾萃取电离质谱(ND-EESI-MS)具有快速、灵敏和实时在线检测等优点,可直接对样本进行解吸化学电离和质谱分析[18],广泛应用于植物[18]、食品[19-20]、中药材[21]、化妆品[22-23]等领域。在植物逆境研究方面,有报道使用ND-EESI-MS直接分析水涝胁迫对烟草生长的影响,检出了丝氨酸、脯氨酸及谷氨酸等共22种代谢产物,并发现水涝胁迫会导致脯氨酸、谷氨酸、苏氨酸及组氨酸等初生代谢产物,以及绿原酸、咖啡酸及阿魏酸等次生代谢产物的含量呈上升趋势[18]。在食品安全研究方面,Huang等[19]使用ND-EESI-MS检测蜂蜜样品中的氯霉素,该方法无需复杂的样本预处理,可直接、快速且准确地获得蜂蜜样本中的氯霉素残留信息。在药用植物研究方面,Wu等[21]利用ND-EESI-MS原位、快速分析光质对金线兰中氨基酸和多酚类物质代谢的影响。研究表明,红蓝光可以促进金线兰中异亮氨酸、组氨酸、丝氨酸和精氨酸含量的积累,还可促进苯丙代谢途径中咖啡酸、阿魏酸、槲皮素、杨梅素、山奈酚和芦丁含量的积累。
本研究采用ND-EESI-MS技术分析甘草蜜炙过程中4种不同炮制程度的样本,并进一步比较6种不同地理来源的炙甘草样本品质。希望为甘草蜜炙过程的品质变化机制探究及不同地理来源炙甘草的品质评估提供理论和技术支持,同时为快速、原位、无损分析中药材炮制加工中的品质变化机制提供思路。
-
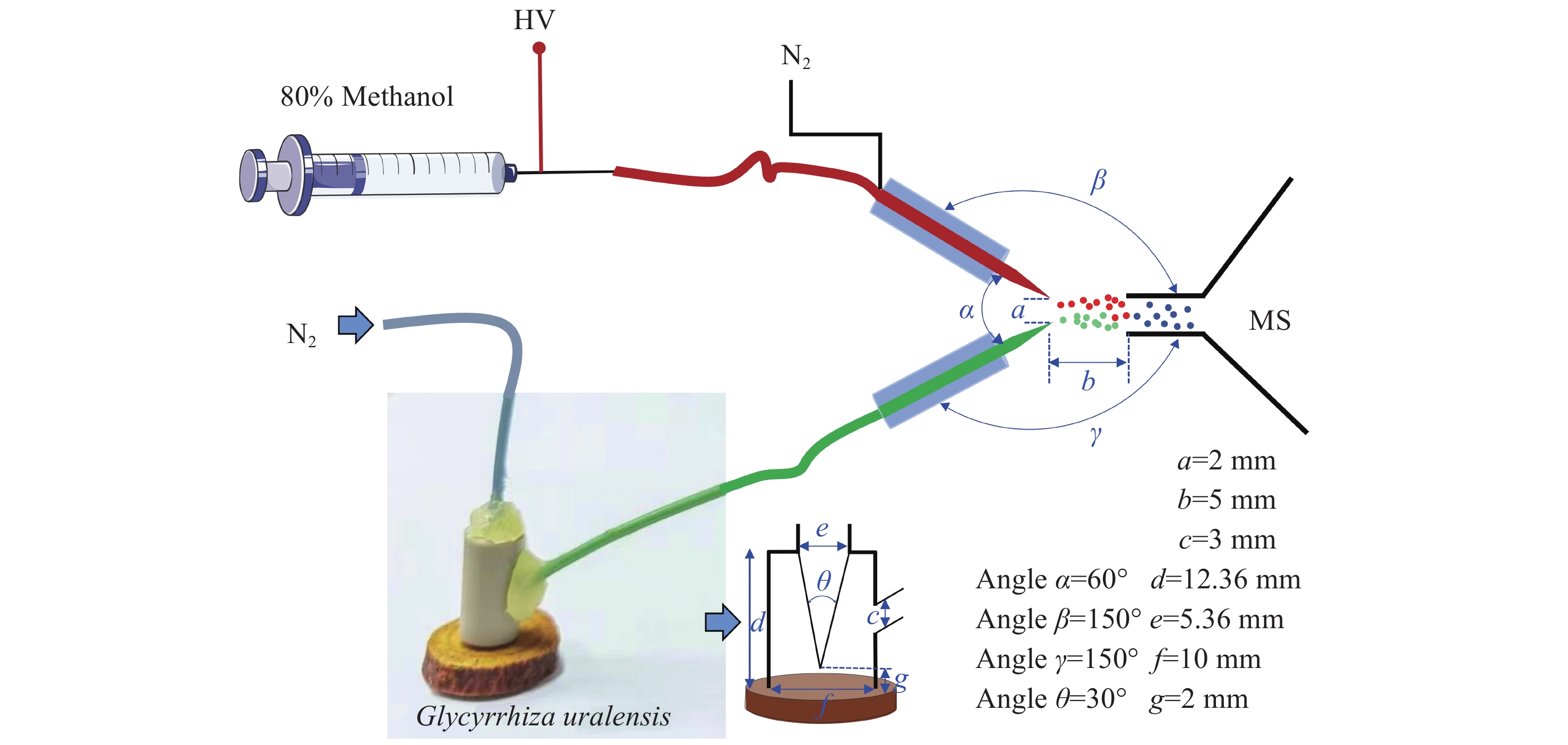
中性解吸-电喷雾萃取电离源:实验室自制,示意图示于图1;LTQ-XL线性离子阱质谱仪:美国Thermo Scientific公司产品,配有Xcalibur数据处理系统;Field-P综合型超纯水机:费尔德北京科学仪器有限公司产品;微量注射泵:英国保定兰格恒流泵有限公司产品;ME104电子分析天平:梅特勒-托利多仪器上海有限公司产品。
-
生甘草饮片和内蒙古炙甘草饮片(NMG):内蒙古厚德中药饮片有限公司产品;甘肃炙甘草饮片(GS):甘肃晶歌生物科技有限公司产品;安徽炙甘草饮片(AH):安徽正杞人电子商务有限公司产品;新疆炙甘草饮片(XJ):新疆禹和堂医药有限公司产品;广东炙甘草饮片(GD):东莞市德康堂医药有限公司产品;江西炙甘草饮片(JX):江西江中中药饮片有限公司产品;甲醇(色谱纯):德国默克公司产品;高纯氮气(99.99%):南昌国滕气体有限公司产品。
-
按照《中华人民共和国药典(中国药典2020版)》通则0213蜜炙工艺制备炙甘草饮片。首先,取100 g炼蜜,加适量的沸水稀释,将25 g生甘草饮片(S1)快速与稀释后的炼蜜拌匀闷透(S2);其次,将闷透的甘草片置于炒制容器内,用文火炒至表面呈黄色或深黄色,以不黏手为度(S3);最后,将炙甘草片放置至室温冷却,得到炙甘草饮片(S4)[24]。
-
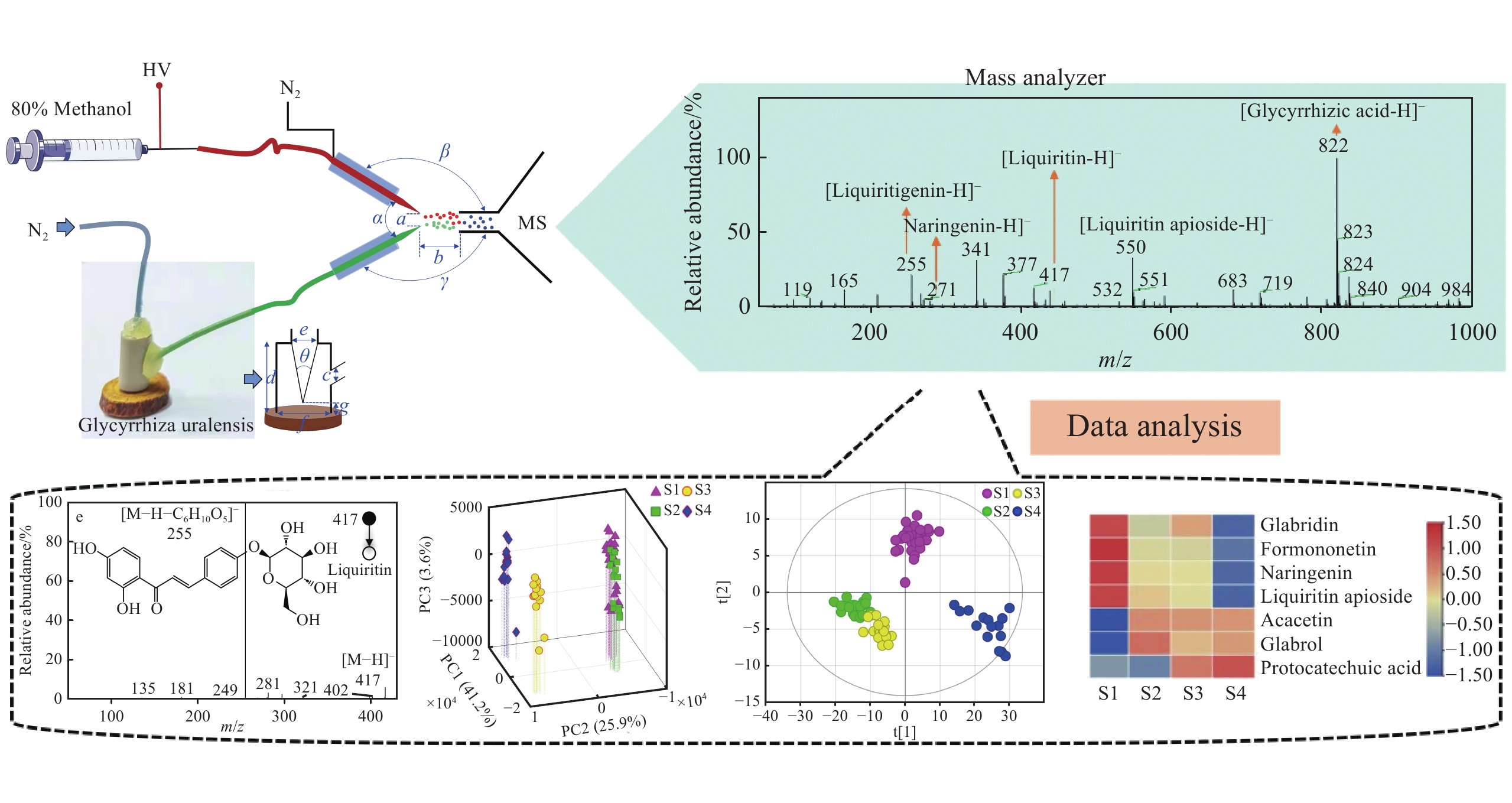
ND-EESI-MS装置原理图及实验参数示于图1。样本通道与萃取剂通道夹角α=60°,样本通道口和萃取剂通道口与质谱口的垂直夹角β=γ=150°,萃取剂通道毛细管尖端与样本通道毛细管尖端的距离a=2 mm,毛细管尖端与质谱口的距离b=5 mm,鞘气为N2(纯度99.99%)。萃取剂(10%、20%、30%、40%、50%、60%、70%、80%、90%和100%甲醇水溶液(V/V))、电喷雾萃取剂流速(3、4、5、6、7、8、9 µL/min)、喷雾电压(0.5、1、1.5、2、2.5、3、3.5、4 kV)、雾化气压(0.2、0.3、0.4、0.5、0.6、0.7、0.8 MPa)和样品端辅助气压(0.4、0.5、0.6、0.7、0.8、0.9、1 MPa)经实验优化后获取。质谱仪中,离子传输管温度260 ℃,毛细管电压20 V,透镜电压39 V,由LTQ-MS软件系统自动优化获得(负离子模式下,毛细管电压−45 V,透镜电压−35 V)。碰撞诱导解离(collision-induced dissociation,CID)时,母离子隔离宽度1.5 u,碰撞能量10%~40%,活化值Q为0.26,碰撞时间30 ms。实验过程中,N2用于将样品在EESI环境中离子化。在电场和萃取剂的作用下,样品产生大量含有待测物的微小带电液滴。这些液滴去溶剂化后形成气态待测物离子并向质谱口定向移动,随后进入质谱仪分析,质量扫描范围m/z 50~1 000。
-
所有实验数据均为3个生物学重复,使用Microsoft Excel进行收集和整理,以平均值±标准差(x±SD)表示。采用MATLAB R2016a对原始质谱指纹数据识别后进行主成分分析(PCA),主要流程包括数据标准化、计算协方差矩阵、计算特征值、特征向量、选择主成分、构建投影矩阵、数据降维及结果解释[25]。在PCA分析前,先进行数据异常值检测,识别出可能对结果产生不利影响的数据,删除具有明显错误的数据或异常值。使用SIMCA软件(14.0版)进行偏最小二乘法-判别分析(PLS-DA),主要流程包括数据标准化、模型建立、模型优化与选择以及结果解释与验证[26]。利用TBtools软件(2.09版)对化合物含量进行可视化热图分析。
-
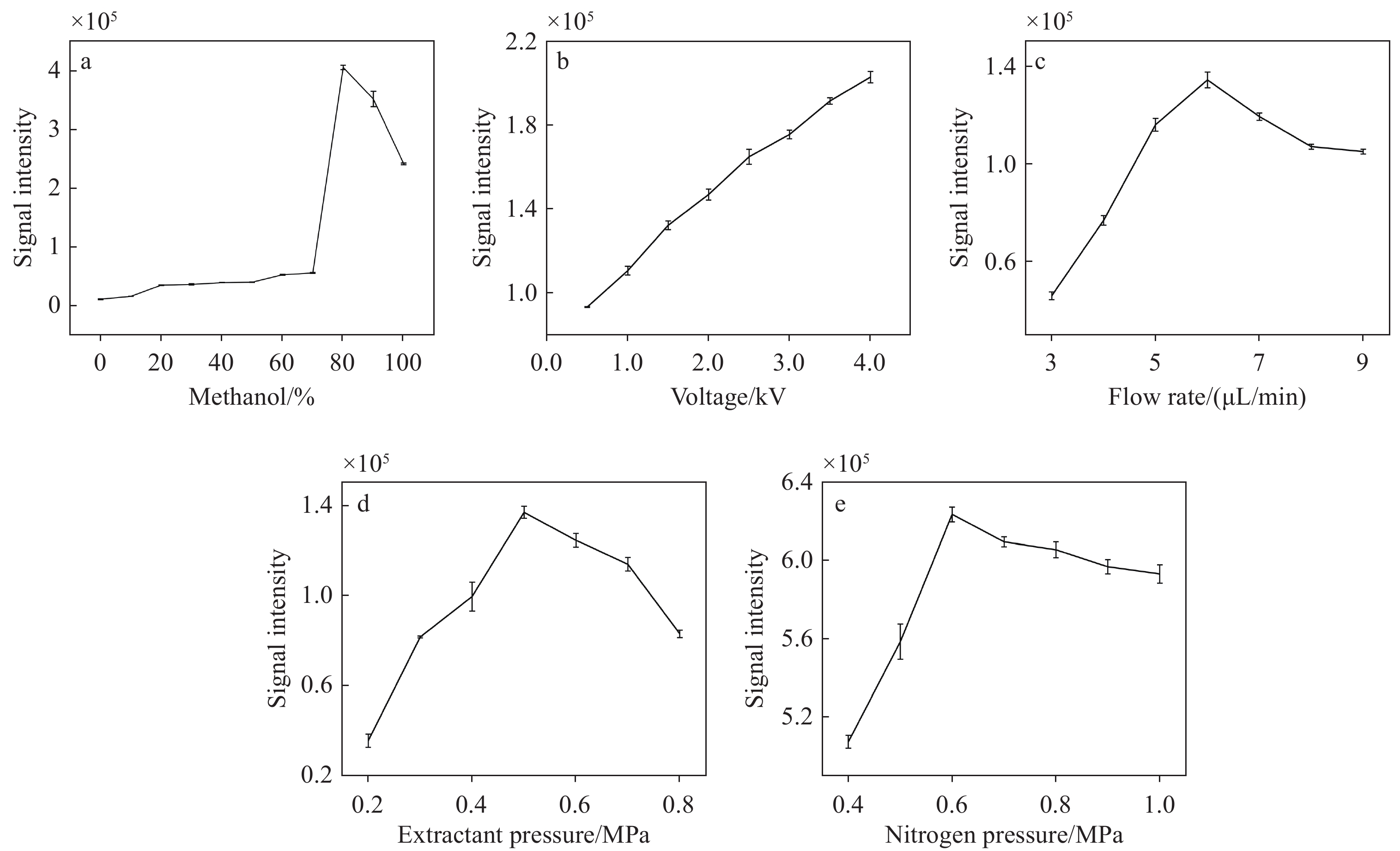
为了得到更优的分析效果,本实验优化了萃取剂、萃取剂流速、电喷雾电压、雾化气压和样品端辅助气压等参数。在正离子模式下,选择目标离子甘草素([M+H]+ m/z 257)为研究对象进行优化。甘草素是甘草中一种重要的活性化合物,属于黄酮类成分[27],具有较好的稳定性[28],在质谱中易于检测和识别[29]。
-
萃取剂甲醇的配比会影响炙甘草样本有效成分的萃取效率,进而影响目标离子的信号强度,示于图2a。目标离子(m/z 257)的信号强度随着甲醇浓度升高呈先上升后下降的趋势。当甲醇-水比例为4:1(V/V)时,目标离子信号强度达到最高,对样品的萃取效果最好。因此,选择甲醇-水(4:1,V/V)作为萃取剂进行后续的实验参数优化。
-
采用甲醇-水(4:1,V/V)作为萃取剂,以甘草素(m/z 257)目标离子的信号强度为指标进行参数优化,考察了电喷雾电压分别为0.5、1、1.5、2、2.5、3、3.5、4 kV时的检测性能,结果示于图2b。随着电喷雾电压的增大,m/z 257信号强度逐渐增强,在4 kV时达到最高。考虑到质谱仪的电喷雾电压不能过高,未继续提高电压强度。因此,选择电喷雾电压4 kV。
-
本实验考察了萃取剂流速分别为3、4、5、6、7、8、9 µL/min时的检测性能,结果示于图2c。随着萃取剂流速的增大,m/z 257信号强度呈先增大后减小的趋势,在6 µL/min时达到最高。因此,选择萃取剂流速6 µL/min。
-
本实验考察了雾化气压分别为0.2、0.3、0.4、0.5、0.6、0.7、0.8 MPa时对炙甘草检测的影响,结果示于图2d。随着雾化气压的增大,m/z 257信号强度呈先增大后减小的趋势,并在0.5 MPa时达到最高。因此,选择雾化气压0.5 MPa。
-
本实验考察了样品端辅助气压分别为0.4、0.5、0.6、0.7、0.8、0.9、1 MPa时对炙甘草检测的影响,结果示于图2e。随着辅助气压的增大,信号强度呈先上升后缓慢下降的趋势,并在0.6 MPa时达到最高。因此,选择样品端辅助气压0.6 MPa。
-
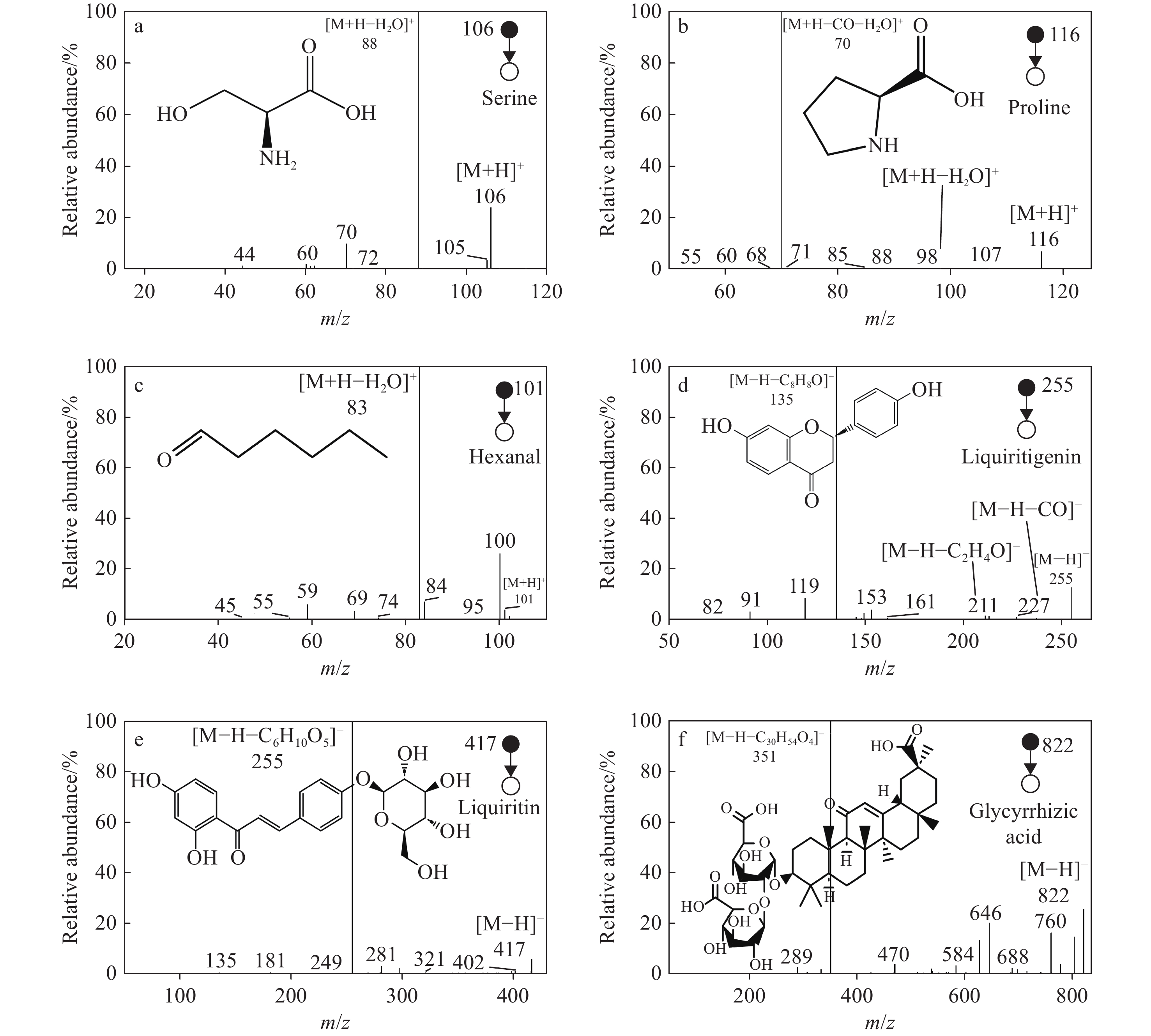
采用CID实验鉴定出炙甘草中甘草素、甘草酸、柚皮素、丝氨酸、脯氨酸和咖啡酸等共35种化合物,在正、负离子模式下分别筛选出17、18种化合物,详细信息列于表1。可见,在正离子模式下,主要检出己醛、辛醛、丝氨酸、脯氨酸、己酸甲酯、水杨酸甲酯、柠檬烯、山奈酚、香橙素和甘草香豆素等;在负离子模式下,主要检出没食子酸、咖啡酸、甘草素、芒柄花素、柚皮素、光甘草定、甘草苷、芹糖甘草苷、甘草酸和甘草次酸等。有研究[30]报道,炙甘草甲醇提取液中含有丰富的黄酮类和查尔酮类化合物;另外,Yu等[31]报道,炙甘草中含有多种氨基酸及甘草苷、甘草香豆素、甘草酸等化合物。这与本研究结果一致。
利用ND-EESI-MS鉴定炙甘草中化合物的二级指纹图谱示于图3。在正离子模式下,母离子m/z 106(C3H7NO3)失去质量数18(H2O)的碎片,产生m/z 88碎片离子,示于图3a;母离子m/z 116(C5H9NO2)失去质量数46(H2O—CO)的碎片,产生m/z 70碎片离子,示于图3b。它们分别与丝氨酸和脯氨酸标准品的二级质谱裂解行为一致,因此将m/z 106归属为丝氨酸,m/z 116归属为脯氨酸。以此方式还鉴定出缬氨酸、苯丙氨酸和精氨酸3种氨基酸。母离子m/z 101(C6H12O)失去质量数18(H2O)的碎片,产生m/z 83碎片离子,示于图3c,通过结合甘草二级质谱分析数据库,将m/z 101归属为己醛。此外,以同样的方式还筛选出己酸甲酯、水杨酸甲酯和肉豆蔻酸乙酯3种酯类物质,柠檬烯和香芹酚2种单萜类物质,山奈酚和香橙素2种黄酮类物质,以及辛醛、阿魏酸、芥子酸和甘草香豆素。
在负离子模式下,母离子m/z 255(C15H12O4)失去质量数120(C8H8O)的碎片,产生m/z 135碎片离子,示于图3d;母离子m/z 417(C21H22O9)失去质量数162(C6H10O5)的碎片,产生m/z 255碎片离子,示于图3e;母离子m/z 822(C42H62O16)失去质量数471(C30H47O4)的碎片,产生m/z 351碎片离子,示于图3f。它们分别与甘草素、甘草苷和甘草酸标准品二级质谱裂解行为一致,最终将m/z 255归属为甘草素,m/z 417归属为甘草苷,m/z 822归属为甘草酸。通过与标准品二级质谱裂解行为对比,并结合甘草二级质谱分析数据库,筛选出原儿茶酸和没食子酸2种酚酸类物质,水杨酸和咖啡酸2种有机酸类物质,黄芩素、光甘草定、异牡荆素和芹糖甘草苷4种黄酮类物质,芒柄花素和次槐黄素2种异黄酮类物质,以及对羟基苯丙酸、光果甘草酮、光甘草酚、柚皮素和甘草次酸。
-
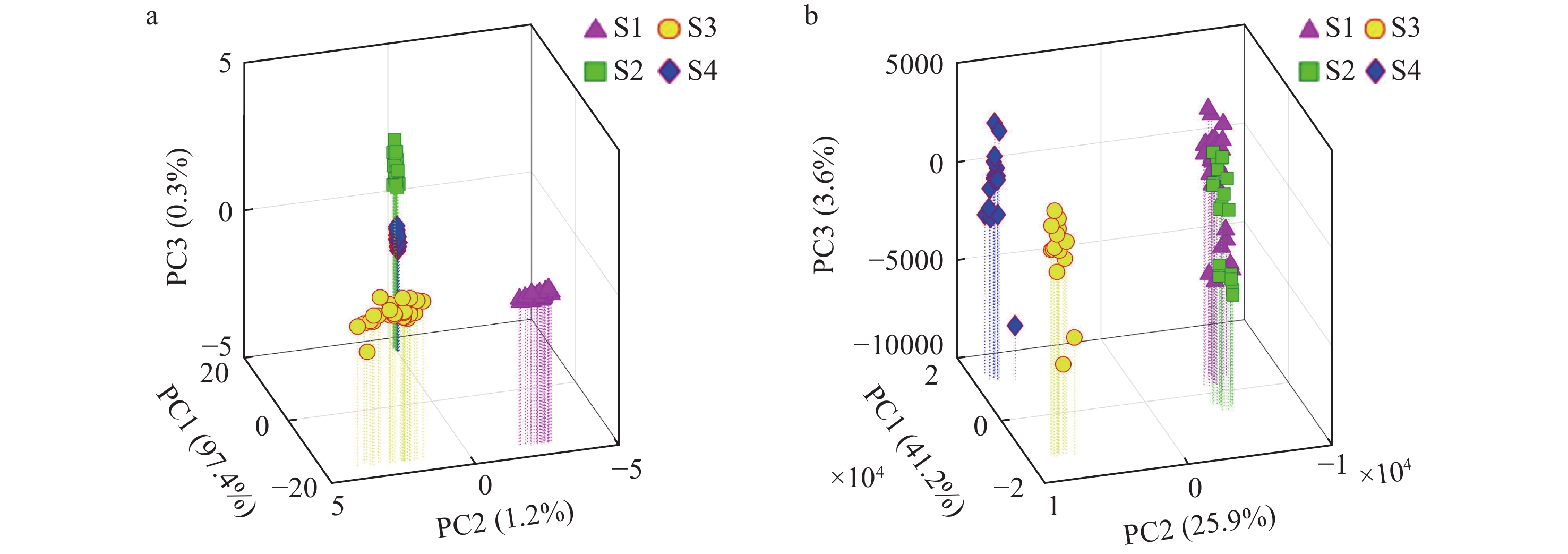
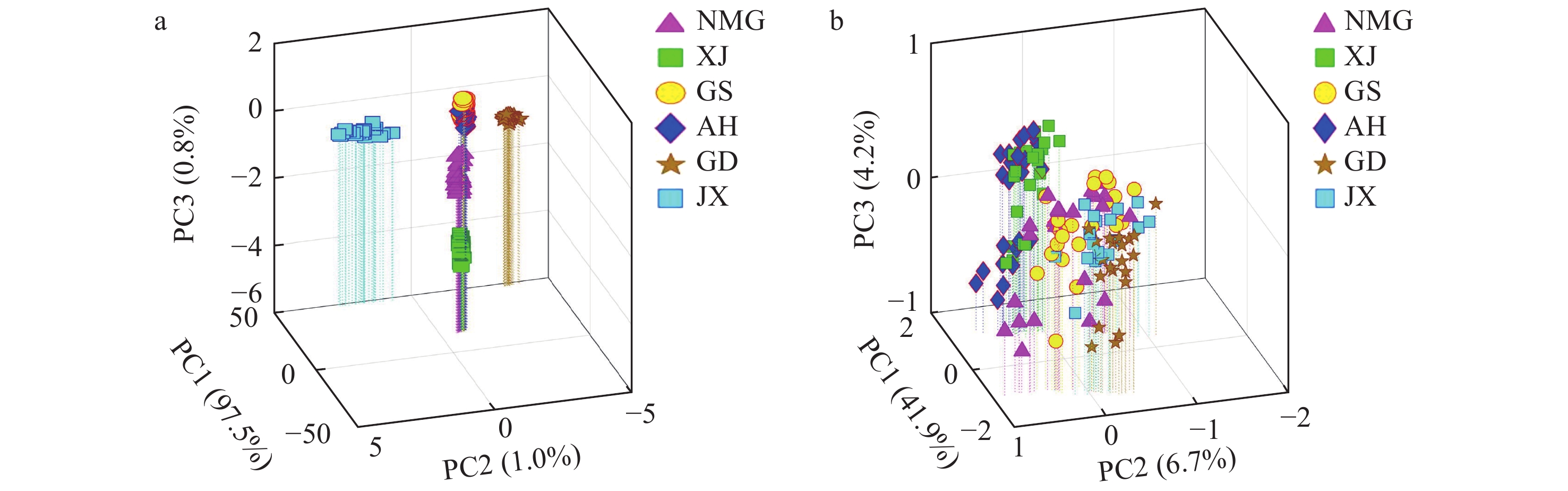
为了探究甘草加蜂蜜炮制过程中化合物的变化机制,对正、负离子模式下采集的4种不同炮制程度炙甘草样本(S1、S2、S3和S4)的ND-EESI-MS一级指纹图谱进行PCA分析。在正离子模式下,PC1、PC2和PC3分别代表变量总方差的97.4%、1.2%和0.3%,累积总方差值为98.9%,示于图4a;在负离子模式下,PC1、PC2和PC3分别代表变量总方差的41.2%、25.9%和3.6%,累积总方差值为70.7%,示于图4b。结果表明,4种不同炮制程度的甘草样本化合物轮廓差异较大,可实现有效区分。
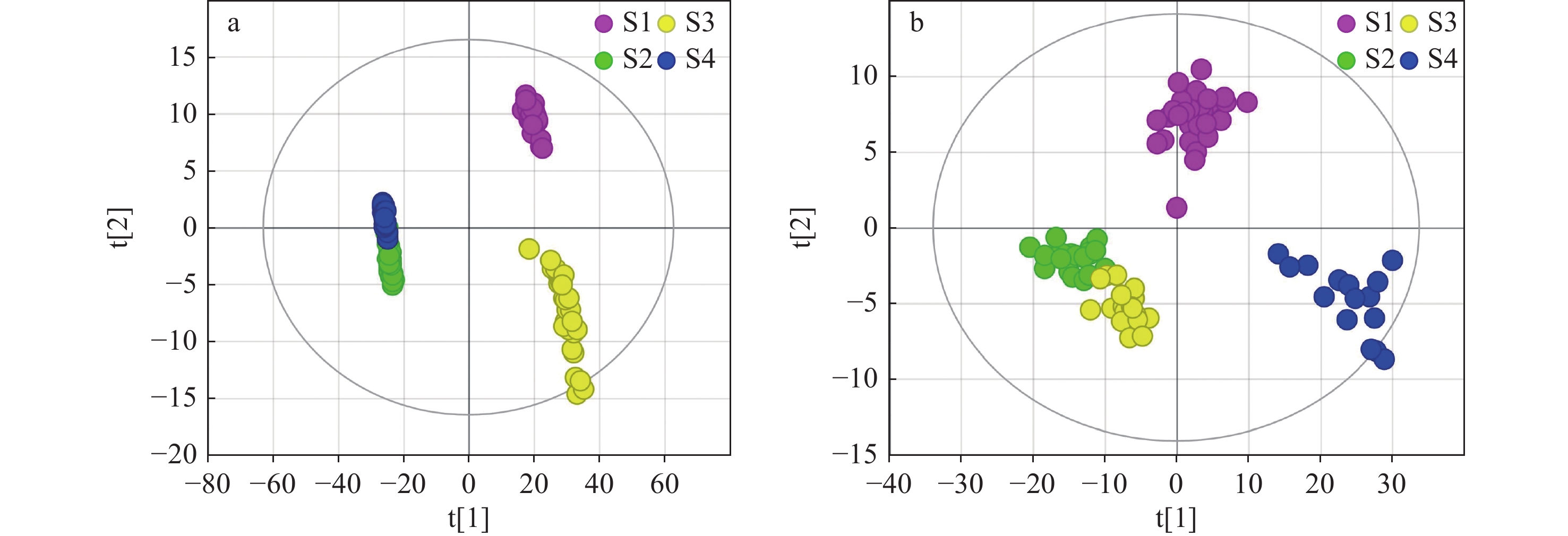
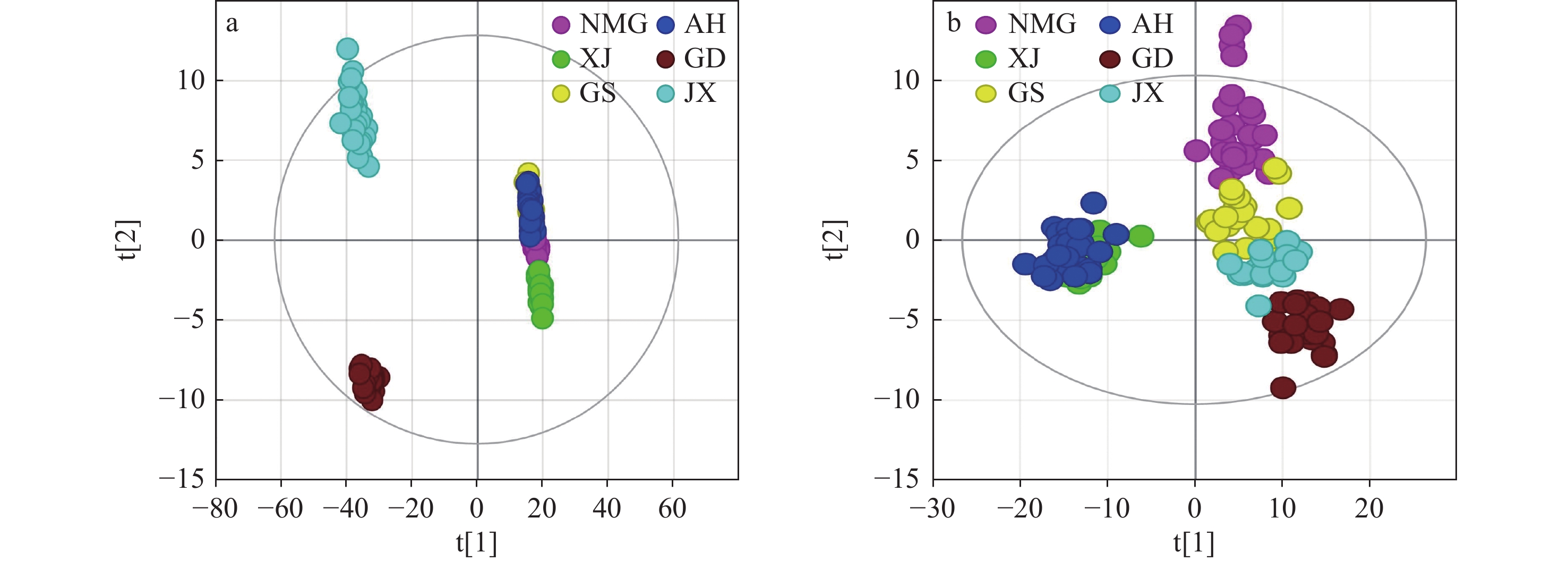
此外,对4个样本进行有监督的PLS-DA分析,示于图5a、5b。结果表明,在正、负离子模式下,4个炙甘草样本均可有效区分;在正离子模式下,R2和Q2分别达到了0.979、0.899;在负离子模式下,R2和Q2分别达到了0.990、0.902,且R2˃Q2˃0.5,表明构建的PLS-DA模型具有较好的解释率和预测率。
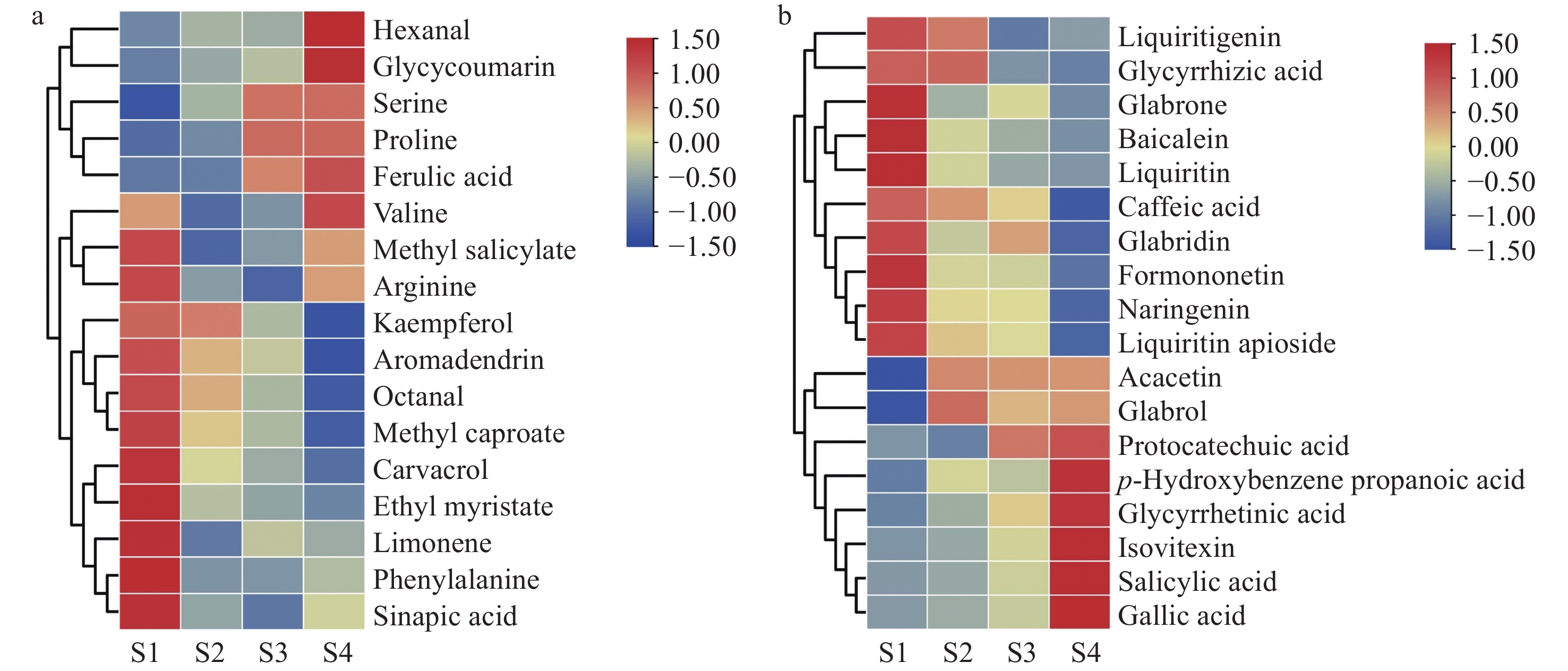
为进一步探究炙甘草的品质变化,对筛选出的35种化合物进行可视化热图分析。在正离子模式下,甘草中丝氨酸、脯氨酸和缬氨酸3种氨基酸的含量在加蜂蜜炮制后均增加,而水杨酸甲酯等3种酯类的含量均降低,示于图6a。甘草蜜炙过程中氨基酸含量的增加可能是由于蜂蜜中含有脯氨酸、精氨酸、丝氨酸、天冬氨酸和谷氨酸等丰富的氨基酸成分[32]。另外,Cheng等[33]研究发现氨基酸可以加速碱性环境下水杨酸甲酯的水解,甘草蜜炙过程中酯类含量降低可能与此水解反应有关。在负离子模式下,甘草中甘草素、黄芩素、光甘草定和甘草苷等物质的含量在蜜炙后均降低,示于图6b。这些成分在蜜炙过程中可能发生如水解、氧化、聚合等反应[34],进而影响甘草的色泽、气味和口感等品质特征[35]。Cai等[6]认为,可能是由于类黄酮化合物在加热过程中转化为查尔酮、异黄酮等,而黄酮苷类化合物在蜜炙加热过程中水解为苷元。Takla等[36]利用超高效液相色谱-质谱(UPLC-MS)法比较甘草加蜂蜜炮制前后的化合物差异,发现相比于生甘草,炙甘草中光甘草定和黄芪苷等黄酮及黄酮苷类化合物含量显著下降,这与本研究结果一致。另外,在蜜炙过程中,炙甘草中甘草酸含量降低,甘草次酸含量升高。甘草酸含量的降低可能与加热过程中的水解、氧化或热解等化学反应有关[37]。甘草酸是甘草的主要活性成分,具有抗炎、抗氧化、镇咳等药理作用[38],其含量的变化可能会影响甘草的药效。Shabkhiz等[37]在利用过热水萃取法从甘草根中提取甘草酸的研究中发现,萃取温度过高可能会导致甘草酸分子中的醚键水解,产生1分子甘草次酸和2分子葡萄糖醛酸,从而造成甘草酸含量降低,甘草次酸含量相对升高。在提取药用植物中天然成分时,需将温度从150 ℃升高至250 ℃以提高提取效率,但当温度升高到一定程度时,这些天然化合物会开始分解[39]。Wang等[40]发现,当温度为130 ℃时,甘草次酸含量显著增加。有研究表明,甘草加蜂蜜炮制后品质得以提升,主要表现为有效化合物含量升高,以及功效的明确和增强[6]。生甘草中甘草酸、甘草皂苷、黄酮类化合物等有效成分含量较高[6],其功效偏于清热解毒、祛痰止咳;炙甘草中甘草酸含量降低[37],同时保留了部分黄酮类化合物等有效成分,其功效偏于补脾和胃、益气复脉,此外还能够缓急止痛、调和诸药。
-
采用PCA对来自内蒙古(NMG)、新疆(XJ)、甘肃(GS)、安徽(AH)、广东(GD)和江西(JX)6个不同地理来源的炙甘草品质进行评估。在正离子模式下,PC1、PC2和PC3分别代表变量总方差的97.5%、1.0%、0.8%,累积总方差值为99.3%,示于图7a;在负离子模式下,PC1、PC2和PC3分别代表变量总方差的41.9%、6.7%、4.2%,累积总方差值为52.8%,示于图7b。
采用PCA无监督模式分析后,对6个炙甘草样本进行PLS-DA分析,示于图8。在正离子模式下,R2和Q2分别达到了0.918、0.554;在负离子模式下,R2和Q2分别达到了0.867、0.574,且R2˃Q2˃0.5,表明6种不同地理来源炙甘草样本的化合物轮廓差异较大,可实现有效区分。
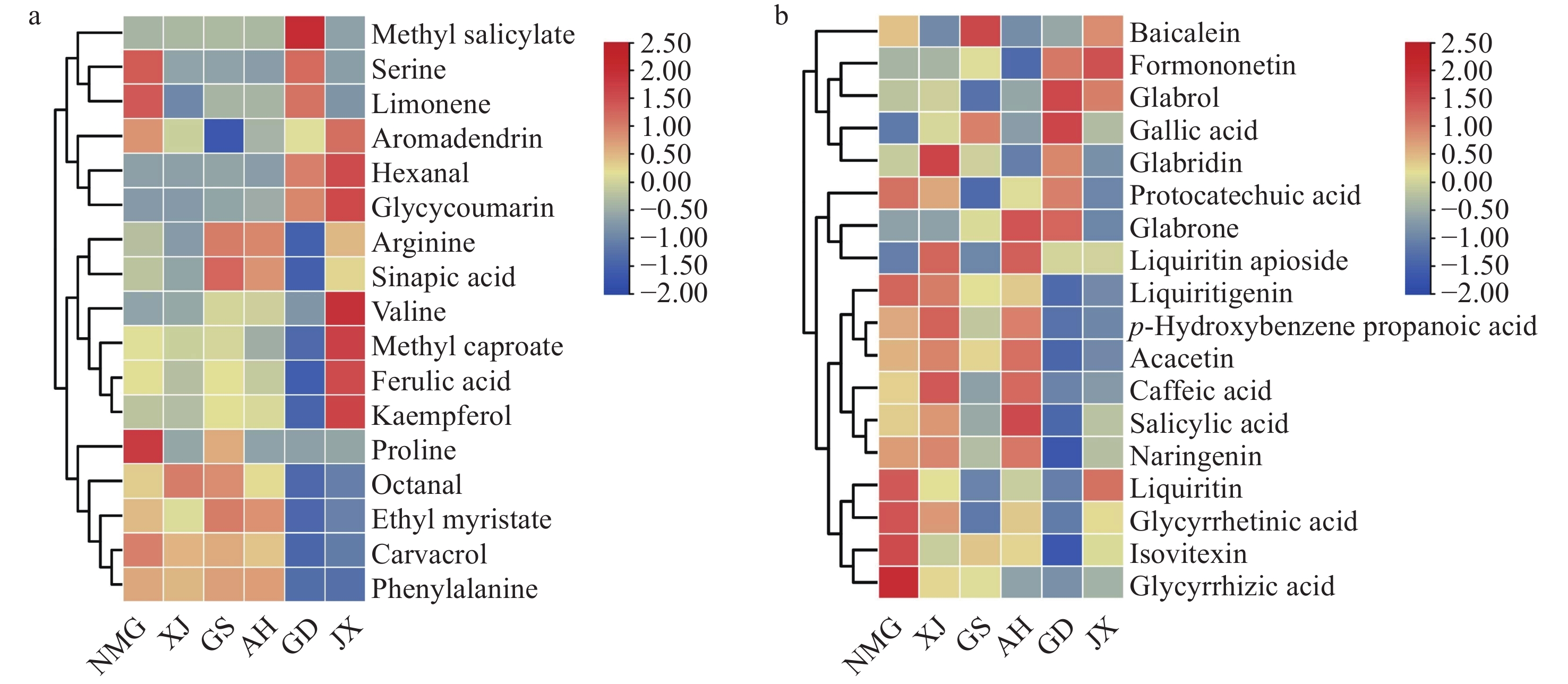
为进一步评估不同地理来源炙甘草的品质差异,对筛选出的35种化合物进行可视化热图分析,示于图9。在正离子模式下,丝氨酸、脯氨酸和柠檬烯的含量在内蒙古炙甘草中最高,辛醛、肉豆蔻酸乙酯、香芹酚和苯丙氨酸的含量在内蒙古、新疆、甘肃和安徽炙甘草中较高。在负离子模式下,炙甘草中含有的多种活性物质含量在内蒙古炙甘草中均最高,如甘草素、甘草酸、甘草次酸、甘草苷、芹糖甘草苷和柚皮素等,但没食子酸含量相对较低;另外,刺槐黄素、花旗松素、咖啡酸和水杨酸等物质含量在内蒙古、甘肃和安徽炙甘草中较高,光甘草定、黄芩素含量分别在新疆、甘肃炙甘草中较高,而芒柄花素、光甘草酚和没食子酸含量在广东和江西炙甘草中较高。通过比较6种不同地理来源炙甘草中多种化合物含量可知,内蒙古炙甘草的品质较优。Zhang等[41]评价分析了内蒙古、甘肃和新疆的甘草根品质,发现每个样本都含有丰富的类黄酮、酚类和多糖物质,且比较了3种地理来源甘草中甘草苷、异甘草苷、甘草素、异甘草素和甘草酸等5种化合物的总量后,证实了内蒙古甘草的含量最高。另外,Cui等[8]研究了甘肃、宁夏、内蒙古、新疆、陕西、吉林、黑龙江和辽宁等8个地理来源甘草中的有效成分含量,发现甘肃甘草中甘草酸含量较高,内蒙古甘草中甘草次酸和总黄酮含量较高,新疆甘草中总皂苷含量较高,本研究结果与上述结论相似。
-
本研究利用ND-EESI-MS原位、快速分析甘草蜜炙过程中化合物的变化及不同地理来源炙甘草化合物的差异,并优化了萃取剂、萃取剂流速、电喷雾电压、雾化气压和样品端辅助气压等实验参数。结果表明,本方法可在无需预处理的条件下直接分析炙甘草样本,在正、负离子模式下共鉴定出35种化合物,其中,正离子模式下鉴定出己醛、辛醛、丝氨酸、脯氨酸和己酸甲酯等17种化合物;负离子模式下鉴定出没食子酸、甘草素、芒柄花素、柚皮素和光甘草定等18种化合物。其次,甘草在蜜炙过程中化合物存在显著差异,光甘草酚、刺槐黄素、甘草香豆素和甘草次酸等物质含量积累。甘草蜜炙炮制前后化学成分的改变与其药效的改变密切相关,生甘草长于泻火解毒和化痰止咳,而炙甘草长于补脾益气复脉。炙甘草中主要成分甘草酸含量略有减少,但并不影响药效,还可能与炙甘草补益作用的增强有关。此外,内蒙古、新疆、甘肃、安徽、广东和江西6种地理来源炙甘草品质存在显著差异,其中,内蒙古炙甘草中甘草酸、甘草次酸、甘草素和柚皮素等物质含量较高,品质较优。本工作可为快速、全面分析植物源食品和中药材的品质提供方法和思路。
中性解吸电喷雾萃取电离质谱分析研究炙甘草炮制过程中的品质变化机制
Studies on the Mechanism of Quality Changes in the Honey-Processing of Glycyrrhiza Uralensis Using Neutral Desorption Electrospray Ionization Mass Spectrometry
-
摘要: 利用蜂蜜炮制加工甘草可增加其有效成分含量,具有补益作用,但炮制过程中的品质变化机制尚不明确,且产地与炙甘草品质密切相关。本实验在无需任何样品预处理的条件下,采用中性解吸电喷雾萃取电离质谱(ND-EESI-MS)技术,以80%甲醇为萃取剂,在正、负离子模式下对甘草蜜炙过程中4种不同炮制程度的甘草样本进行分析,并比较了内蒙古、新疆、甘肃、安徽、广东和江西等产地的炙甘草品质。采用碰撞诱导解离(CID)对目标离子进行分析,共鉴定出炙甘草中35种化合物,其中己醛、辛醛、丝氨酸、脯氨酸、己酸甲酯、水杨酸甲酯、柠檬烯、山奈酚、香橙素和甘草香豆素等17种化合物在正离子模式下检出;没食子酸、咖啡酸、甘草素、芒柄花素、柚皮素、光甘草定、甘草苷、芹糖甘草苷、甘草酸和甘草次酸等18种化合物在负离子模式下检出。结果表明,基于质谱分析数据的主成分分析(PCA)和偏最小二乘法-判别分析(PLS-DA)可有效区分甘草蜜炙过程中4种不同炮制程度的甘草样本,且光甘草酚、刺槐黄素、甘草香豆素和甘草次酸等物质含量在加工过程中不断积累;6种地理来源的炙甘草样本可有效区分,其中,内蒙古炙甘草中甘草酸、甘草次酸、甘草素和柚皮素等物质含量较高,品质较优。该方法为快速、原位、无损分析中药材炮制加工过程中的品质变化机制提供了参考。
-
关键词:
- 中性解吸电喷雾萃取电离质谱(ND-EESI-MS) /
- 甘草 /
- 主成分分析(PCA) /
- 偏最小二乘法-判别分析(PLS-DA) /
- 有效成分
Abstract: Honey-processed Glycyrrhiza (G.) uralensis has a wide range of pharmacological and medicinal effects. The processing of G. uralensis with honey has been associated with an increase in the content of pharmacologically active components and the enhancement of tonic effects. However, the mechanism underlying quality changes during processing remains unclear, as does the influence of its origin on the quality of honey-processed G. uralensis. In this study, the neutral desorption-extractive electrospray ionization mass spectrometry (ND-EESI-MS) method was used to analyze four honey-processed G. uralensis samples with different processing degrees, including raw G. uralensis (S1), raw G. uralensis mixed with honey (S2), heated (S3), and further processed until it was no longer sticky (S4). The samples were analyzed under positive and negative ion modes using 80% methanol as the extractant to explore the quality formation mechanisms during the processing. Additionally, the quality of honey-processed G. uralensis from six origins, namely Inner Mongolia, Xinjiang, Gansu, Anhui, Guangdong, and Jiangxi was also assessed. Five experimental conditions were optimized, including extractant, extractant flow rate, electrospray voltage, extractant air pressure, and auxiliary air pressure at the samples site. Collision-induced dissociation (CID) experiment was used to determine the target ions. A total of 35 compounds in honey-processed G. uralensis were identified, including 17 compounds of hexanal, serine, proline, valine, octanal, methyl caproate, limonene, carvacrol, methyl salicylate, phenylalanine, arginine, ferulic acid, sinapic acid, ethyl myristate, kaempferol, aromadendrin, and glycycoumarin under positive ion mode, and 18 compounds of salicylic acid, protocatechuic acid, p-hydroxyphenylpropionic acid, gallic acid, caffeic acid, liquiritigenin, formononetin, baicalein, naringenin, acacetin, glabridin, glabrone, glabrol, liquiritin, isovitexin, glycyrrhizic acid, glycyrrhetinic acid and liquiritin apioside under negative ion mode. More importantly, active metabolites increased in abundance and were better detected under positive ion mode, such as flavonoids and triterpenoids. The results showed that principal component analysis (PCA) and partial least squares discriminant analysis (PLS-DA) based on the MS data can effectively distinguish the four different processing degrees of G. uralensis samples. During honey processing, the contents of glabrol, acacetin, glycycoumarin, and glycyrrhetinic acid continued to accumulate. Similarly, PCA and PLS-DA can distinguish the metabolite profile of honey-processed G. uralensis from six origins. The contents of glycyrrhizic acid, glycyrrhetinic acid, liquiritigenin, and naringenin were higher in honey-processed G. uralensis from Inner Mongolia, indicating its superior quality. This study demonstrates a novel technique, which eliminates the need for sample pretreatment, for the rapid, in situ, non-destructive detection of plant-derived foods and Chinese herbal medicines, providing a comprehensive analysis of quality. -

-
表 1 正、负离子模式下,利用ND-EESI-MS鉴定炙甘草中35种化合物
Table 1. Identification of 35 compounds in honey-processed G. uralensis by ND-EESI-MS under positive and negative ion modes
序号
Number化合物
Compound分子式
Molecular formula母离子
Precursor ion (m/z)特征碎片离子
Characteristic fragment ion1 己醛 C6H12O 101 m/z 83[M+H−H2O]+ 2 丝氨酸 C3H7NO3 106 m/z 88[M+H−H2O]+ 3 脯氨酸 C5H9NO2 116 m/z 70[M+H−H2O−CO]+ 4 缬氨酸 C5H11NO2 118 m/z 100[M+H−H2O]+, m/z 58[M+H−C3H10N]+ 5 辛醛 C8H16O 129 m/z 112[M+H−OH]+ 6 己酸甲酯 C7H14O2 131 m/z 113[M+H−H2O]+, m/z 74[M+H−C4H9]+ 7 柠檬烯 C10H16 137 m/z 93[M+H−C3H8]+, m/z 79[M+H−C4H10]+ 8 香芹酚 C10H14O 151 m/z 132[M+H−H2O−H]+ 9 水杨酸甲酯 C8H8O3 153 m/z 135[M+H−H2O]+, m/z 121[M+H−H2O−CH2]+ 10 苯丙氨酸 C9H11NO2 166 m/z 148[M+H−H2O]+, m/z 121[M+H−COOH]+ 11 精氨酸 C6H14N4O2 175 m/z 158[M+H−OH]+, m/z 157[M+H−H2O]+ 12 阿魏酸 C10H10O4 195 m/z 177[M+H−H2O]+ 13 芥子酸 C11H12O5 225 m/z 183[M+H−C2H2O]+, m/z 207[M+H−H2O]+ 14 肉豆蔻酸乙酯 C16H32O2 257 m/z 102[M+H−C11H23]+, m/z 88[M+H−C12H25]+ 15 山奈酚 C15H10O6 287 m/z 269[M+H−H2O]+, m/z 241[M+H−CO−H2O]+ 16 香橙素 C15H12O6 289 m/z 271[M+H−H2O]+, m/z 245[M+H−CO2]+ 17 甘草香豆素 C21H20O6 369 m/z 351[M+H−H2O]+, m/z 313[M+H−C4H8]+ 18 水杨酸 C7H6O3 137 m/z 109[M−H−CO]−, m/z 93[M−H−C2H4O]− 19 原儿茶酸 C7H6O4 153 m/z 109[M−H−CO2]−, m/z 62[M−H−C4H11O2]− 20 对羟基苯丙酸 C9H10O3 165 m/z 121[M−H−CO2]−, m/z 137[M−H−CO]− 21 没食子酸 C7H6O5 169 m/z 151[M−H−H2O]−, m/z 125[M−H−CO2]− 22 咖啡酸 C9H8O4 179 m/z 151[M−H−CO]−, m/z 135[M−H−CO2]− 23 甘草素 C15H12O4 255 m/z 237[M−H−H2O]−, m/z 135[M−H−C8H8O]− 24 芒柄花素 C16H12O4 267 m/z 252[M−H−CH3]− 25 黄芩素 C15H10O5 269 m/z 251[M−H−H2O]−, m/z 225[M−H−CO2]− 26 柚皮素 C15H12O5 271 m/z 253[M−H−H2O]−, m/z 151[M−H−C8H8O]− 27 刺槐黄素 C16H12O5 283 m/z 268[M−H−CH3]−, m/z 255[M−H−CO]− 28 光甘草定 C20H20O4 323 m/z 135[M−H−C11H24O2]− 29 光果甘草酮 C20H16O5 335 m/z 320[M−H−CH3]−, m/z 291 [M−H−CO2]− 30 光甘草酚 C25H28O4 392 m/z 203[M−H−C13H17O]−, m/z 187[M−H−C13H17O2]− 31 甘草苷 C21H22O9 417 m/z 255[M−H−C6H10O5]− 32 异牡荆素 C21H20O10 431 m/z 341[M−H−C8H8O]− 33 甘草次酸 C30H46O4 470 m/z 426[M−H−CO2]− 34 芹糖甘草苷 C26H30O13 550 m/z 297[M−H−C15H9O4]−, m/z 225[M−H−C11H19O9]− 35 甘草酸 C42H62O16 822 m/z 804[M−H−H2O]−, m/z 351[M−H−C30H47O4]− -
[1] DING Y, BRAND E, WANG W, ZHAO Z. Licorice: resources, applications in ancient and modern times[J]. Journal of Ethnopharmacology, 2022, 298: 115 594. [2] WANG C, ZHANG J, PEI Y, LI C, LI Y, CHEN S, WANG Z. Visualized electrochemiluminescence detection of trace copper in practical food samples[J]. Food Chemistry, 2024, 451: 139 461. [3] LI Y, XIE Z, HUANG Y, ZENG J, YANG C, YUAN L, WANG Y, LI Y. Integrated metabolomic and transcriptomic analysis provides insights into the flavonoid formation in different Glycyrrhiza species[J]. Industrial Crops and Products, 2024, 208: 117 796. [4] KUŚ P M. Honey as source of nitrogen compounds: aromatic amino acids, free nucleosides and their derivatives[J]. Molecules, 2020, 25(4): 847 .[5] SUN P, CHEN H, FAN X, WANG J, LU L, YANG G, LIU J, YAO W, DING F, DING J, LIU J, LU T, CHEN L. Exploring the effective components of honey-processed licorice (Glycyrrhiza uralensis Fisch.) in attenuating Doxorubicin-induced myocardial cytotoxicity by combining network pharmacology and in vitro experiments[J]. Journal of Ethnopharmacology, 2024, 329: 118 178. [6] OTA M, XU F, LI Y, SHANG M, MAKINO T, CAI S. Comparison of chemical constituents among licorice, roasted licorice, and roasted licorice with honey[J]. Journal of Natural Medicines, 2018, 72(1): 80 -95 .[7] ZHOU Q, ZHANG S, GENG X, JIANG H, DAI Y, WANG P, HUA M, GAO Q, LANG S, HOU L, SHI D, ZHOU M. Antioxidant effects of roasted licorice in a zebrafish model and its mechanisms[J]. Molecules, 2022, 27(22): 7 743. [8] CUI X, LOU L, ZHANG Y, YAN B. Study of the distribution of Glycyrrhiza uralensis production areas as well as the factors affecting yield and quality[J]. Scientific Reports, 2023, 13(1): 5 160. [9] YANG F, CHU T, ZHANG Y, LIU X, SUN G, CHEN Z. Quality assessment of licorice (Glycyrrhiza glabra L.) from different sources by multiple fingerprint profiles combined with quantitative analysis, antioxidant activity and chemometric methods[J]. Food Chemistry, 2020, 324: 126 854. [10] PENG C, ZHU Y, YAN F, SU Y, ZHU Y, ZHANG Z, ZUO C, WU H, ZHANG Y, KAN J, PENG D. The difference of origin and extraction method significantly affects the intrinsic quality of licorice: a new method for quality evaluation of homologous materials of medicine and food[J]. Food Chemistry, 2021, 340: 127 907. [11] TAN G, ZHU Z, ZHANG H, ZHAO L, LIU Y, DONG X, LOU Z, ZHANG G, CHAI Y. Analysis of phenolic and triterpenoid compounds in licorice and rat plasma by high-performance liquid chromatography diode-array detection, time-of-flight mass spectrometry and quadrupole ion trap mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2010, 24(2): 209 -218 .[12] XU T, YANG M, LI Y, CHEN X, WANG Q, DENG W, PANG X, YU K, JIANG B, GUAN S, GUO D. An integrated exact mass spectrometric strategy for comprehensive and rapid characterization of phenolic compounds in licorice[J]. Rapid Communications in Mass Spectrometry, 2013, 27(21): 2 297-2 309. [13] FARAG M A, PORZEL A, WESSJOHANN L A. Comparative metabolite profiling and fingerprinting of medicinal licorice roots using a multiplex approach of GC-MS, LC-MS and 1D NMR techniques[J]. Phytochemistry, 2012, 76: 60 -72 .[14] 刘志荣, 张明童, 谢楠, 张平, 马潇, 郭朝晖. 改进QuEChERS-超高效液相色谱-串联质谱法同时测定甘草中86种农药残留[J]. 质谱学报, 2020, 41(6): 624 -636 . doi: 10.7538/zpxb.2019.0116 LIU Zhirong, ZHANG Mingtong, XIE Nan, ZHANG Ping, MA Xiao, GUO Zhaohui. Simultaneous determination of 86 pesticide residues in Glycyrrhiza uralensis by improved QuEChERS-UPLC-MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2020, 41(6):624 -636 (in Chinese). doi: 10.7538/zpxb.2019.0116[15] 席绍峰, 李慧勇, 谭建华, 徐汉虹, 王继才, 熊小婷, 赵田甜, 冼燕萍, 郭新东. SPE-UPLC-Q-TOF MS测定育发化妆品中人参和甘草类功效成分[J]. 质谱学报, 2015, 36(4): 341 -349 . doi: 10.7538/zpxb.youxian.2015.0022 XI Shaofeng, LI Huiyong, TAN Jianhua, XU Hanhong, WANG Jicai, XIONG Xiaoting, ZHAO Tiantian, XIAN Yanping, GUO Xindong. Determination of active constituents of Ginseng and Glycyrrhizae in hair growth cosmetics by SPE-UPLC-Q-TOF MS[J]. Journal of Chinese Mass Spectrometry Society, 2015, 36(4):341 -349 (in Chinese). doi: 10.7538/zpxb.youxian.2015.0022[16] 郭倩池, 王康宇, 张龄月, 郭云龙, 贡济宇, 高文义. 基于UHPLC-Q-Orbitrap/MS鉴定当归四逆颗粒化学成分[J]. 质谱学报, 2024, 45(3): 432 -446 . GUO Qianchi, WANG Kangyu, ZHANG Lingyue, GUO Yunlong, GONG Jiyu, GAO Wenyi. Identification of chemical components of Danggui Sini Granules by UHPLC-Q-Orbitrap/MS[J]. Journal of Chinese Mass Spectrometry Society, 2024, 45(3):432 -446 (in Chinese).[17] 杨飞祥, 钟凌云, 陈焕文, 方小伟. 内部萃取电喷雾电离质谱研究枳壳炮制前后的化学成分[J]. 质谱学报, 2024, 45(6): 763 -772 . YANG Feixiang, ZHONG Lingyun, CHEN Huanwen, FANG Xiaowei. Research of chemical comparison of Aurantii Fructus before and after processing by internal extractive electrospray ionization mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2024, 45(6):763 -772 (in Chinese).[18] 吴栋, 于腾辉, 李享, 崔萌, 郝影宾, 刘丽华, 罗丽萍. 中性解吸-电喷雾萃取电离质谱直接分析水涝胁迫下烟草的代谢产物[J]. 分析化学, 2020, 48(1): 121 -128 . WU Dong, YU Tenghui, LI Xiang, CUI Meng, HAO Yingbin, LIU Lihua, LUO Liping. Direct analysis of Nicotiana tabacum metabolites under waterlogging stress by neutral desorption-extractive electrospray ionization mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2020, 48(1):121 -128 (in Chinese).[19] HUANG X, FANG X, ZHANG X, DAI X, GUO X, CHEN H, LUO L. Direct detection of chloramphenicol in honey by neutral desorption-extractive electrospray ionization mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2014, 406(29): 7 705-7 714. [20] WU Z, CHINGIN K, CHEN H, ZHU L, JIA B, ZENOBI R. Sampling analytes from cheese products for fast detection using neutral desorption extractive electrospray ionization mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2010, 397(4): 1 549-1 556. [21] WU D, MING H, WU W, YU W, ZHANG G, GU J, CUI M, HUANG X, NING F, LUO L. In situ neutral desorption-extractive electrospray ionization mass spectrometry reveals red-blue light promoted the accumulation of amino acids and polyphenols in Anoectochilus roxburghii[J]. Journal of Food Composition and Analysis, 2024, 125: 105 761. [22] ZHANG X, LIU Y, ZHANG J, HU Z, HU B, DING L, JIA L, CHEN H. Neutral desorption extractive electrospray ionization mass spectrometry for fast screening sunscreen agents in cream cosmetic products[J]. Talanta, 2011, 85(3): 1 665-1 671. [23] DING J, GU H, YANG S, LI M, LI J, CHEN H. Selective detection of diethylene glycol in toothpaste products using neutral desorption reactive extractive electrospray ionization tandem mass spectrometry[J]. Analytical Chemistry, 2009, 81(20): 8 632-8 638. [24] 商杰. 建昌帮蜜炙甘草的化学成分、工艺及质量标准研究[D]. 南昌: 江西中医药大学, 2024. [25] RINGNÉR M. What is principal component analysis?[J]. Nature Biotechnology, 2008, 26(3): 303 -304 .[26] LU W, JIANG Q, SHI H, NIU Y, GAO B, YU L. Partial least-squares-discriminant analysis differentiating Chinese wolfberries by UPLC-MS and flow injection mass spectrometric (FIMS) fingerprints[J]. Journal of Agricultural and Food Chemistry, 2014, 62(37): 9 073-9 080. [27] WANG Z, LIU J, YANG Y, ZHU H. A review: the anti-inflammatory, anticancer and antibacterial properties of four kinds of licorice flavonoids isolated from licorice[J]. Current Medicinal Chemistry, 2020, 27(12): 1 997-2 011. [28] FU Y, LIU W, SOLADOYE O P. Towards innovative food processing of flavonoid compounds: insights into stability and bioactivity[J]. LWT, 2021, 150: 111 968. [29] JIANG C, GATES P J. Systematic characterisation of the fragmentation of flavonoids using high-resolution accurate mass electrospray tandem mass spectrometry[J]. Molecules, 2024, 29(22): 5 246. [30] WANG D, LIANG J, ZHANG J, WANG Y, CHAI X. Natural chalcones in Chinese materia medica: licorice[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020(1): 3 821 248. [31] YU J, ZHANG D, LIANG Y, ZHANG Z, GUO J, CHEN Y, YAN Y, LIU H, LEI L, WANG Z, TANG Z, TANG Y, DUAN J A. Licorice-Yuanhua herbal pair induces ileum injuries through weakening epithelial and mucous barrier functions: saponins, flavonoids, and di-terpenes all involved[J]. Frontiers in Pharmacology, 2020, 11: 869 .[32] YANG J, LIU Y, CUI Z, WANG T, LIU T, LIU G. Analysis of free amino acid composition and honey plant species in seven honey species in China[J]. Foods, 2024, 13(7): 1 065. [33] CHENG C, BRINZARI T V, HAO Z, WANG X, PAN L. Understanding methyl salicylate hydrolysis in the presence of amino acids[J]. Journal of Agricultural and Food Chemistry, 2021, 69(21): 6 013-6 021. [34] GENG Z, WANG J, ZHU L, YU X, ZHANG Q, LI M, HU B, YANG X. Metabolomics provide a novel interpretation of the changes in flavonoids during sea buckthorn (Hippophae rhamnoides L.) drying[J]. Food Chemistry, 2023, 413: 135 598. [35] XU P, YANG Z, LI X, ZHANG Z, YANG J, YUAN T, YUSUBJONOVNA M M, ElGAMAL R, WU Z. Effects of different drying methods on drying characteristics and quality of silage Broussonetia papyrifera L[J]. LWT-Food Science and Technology, 2024, 210: 116 872. [36] TAKLA S S, SHAWKY E, MAHGOUB Y A, DARWISH R S. Tracking the effect of roasting and fermentation on the metabolites of licorice root (Glycyrrhiza glabra L.) using UPLC-MS analysis combined with multivariate statistical analysis[J]. BMC Complementary Medicine and Therapies, 2023, 23(1): 419 .[37] SHABKHIZ M A, EIKANI M H, BASHIRI SADR Z, GOLMOHAMMAD F. Superheated water extraction of glycyrrhizic acid from licorice root[J]. Food Chemistry, 2016, 210: 396 -401 .[38] CHEN K, YANG R, SHEN F Q, ZHU H L. Advances in pharmacological activities and mechanisms of glycyrrhizic acid[J]. Current Medicinal Chemistry, 2020, 27(36): 6 219-6 243. [39] ONG E S, CHEONG J S H, GOH D. Pressurized hot water extraction of bioactive or marker compounds in botanicals and medicinal plant materials[J]. Journal of Chromatography A, 2006, 1 112(1/2): 92-102. [40] WANG R, LIN C, LIU J, YU F, GAO J, PAN X. Pressured microwave-assisted hydrolysis of crude glycyrrhizic acid for preparation of glycyrrhetinic acid[J]. Chinese Journal of Chemical Engineering, 2012, 20(1): 152 -157 .[41] ZHANG X, GUO X, ZHAO P, ZHANG X, GAO W, LI X. Chemometric analysis of active compounds and antioxidant and α-glucosidase inhibitory activities for the quality evaluation of licorice from different origins[J]. Biomedical Chromatography, 2021, 35(12): e5215. -


 首页
首页 登录
登录 注册
注册



 下载:
下载: