-
中国已明确提出“2030年前达到碳排放峰值,2060年前实现碳中和”的宏伟目标[1],旨在大幅降低二氧化碳排放对生态环境的负面影响。近年来,碳捕集、利用与封存(CCUS)技术取得了显著进展,并被视为达成上述目标的关键路径之一[2]。CO2资源化利用作为CCUS技术的核心环节,涵盖了生物转化、化学转化以及矿化利用等多种技术[3]。
由于CO2分子结构稳定,其转化面临较大挑战。化学转化成为当前最为普遍采用的方法,它包括催化氢化、电化学还原和光催化还原等多种方法[2]。其中,催化氢化尤为突出,能够生成一系列有价值的化学品,如甲醇、乙醇和烷烃等[4]。该方法不仅具有高转化率和优良的产品选择性,而且能处理大量的反应物。然而,催化氢化也受限于热力学因素,通常需要在高温高压条件下或借助高效催化剂来推动反应进程。因此,优化催化氢化的反应条件,使其更加温和且高效,成为CO2资源化利用领域的研究热点。
在催化氢化过程中,甲醇因其在工业应用中的巨大潜力而备受瞩目。尽管关于甲醇合成的具体机理尚存争议,但科学界普遍认同,在CO2加氢生成甲醇的过程中,如式(1),逆水煤气变换(RWGS)反应式(2)会同时发生。这一副反应降低了甲醇的选择性和产量,限制了CO2加氢制甲醇工艺的发展。值得注意的是,CO2加氢生成甲醇是一个放热过程,随着温度上升,反应变得不利;然而,激活CO2分子又需较高的温度,从而形成了一个矛盾点。相比之下,CO2加氢生成一氧化碳CO为吸热反应,即式(2),升温有利于提高CO的产率。后续的CO加氢生成甲醇步骤式(3)中,则只要考虑温度对甲醇产量及催化剂活性的影响。
Vidal-López A等[5]通过DFT计算发现,CO解吸的能量需求为80 kJ·mol−1。由于CO的解吸较为困难,这可能提高甲醇的选择性。同时,HCO的生成被认为具有甲醇生成过程中最高的能垒,其能垒约为122 kJ·mol−1。而从能量角度看,CO的氢化过程更加可行,因其更倾向于加氢而非脱附。
在RWGS+CO加氢路径,即两步法制甲醇中[2],CO2加氢生成的COOH中间体会迅速解离形成CO,随后CO经过连续加氢依次生成HCO、H2CO、H3CO等,最终形成甲醇[6]。因此,在该两步法中CO的选择性与产率至关重要。Wu Z等[7]研究发现,采用Ru/Mo2TiC2催化剂时,CO的产率可达4.0 mol·g−1·h−1。Tang R等[8]使用空心二氧化硅壳层包覆的Ru团簇催化剂,其催化剂具有优异的稳定性和RWGS催化性能,CO选择性接近100%。然而,这两项研究在工业应用中均受到与Ru相关的高成本制约。因此,开发具有高催化性能的非贵金属催化剂成为当前研究的热点。
在非均相催化剂体系中,当反应温度低于600℃时,CO2可以通过热化学还原生成CO[9]。通过特殊设计的催化剂[8],在低于600℃的条件下实现了较高的CO选择性。然而,对于化学品与燃料的生产而言,仍需进一步努力降低RWGS反应温度,以提高能源利用效率并降低经济成本[10]。在常压、反应温度为500℃、H2/CO2摩尔比为3的条件下,CO2转化率仅为8%左右[11]。此外,在低于600℃的条件下,催化RWGS过程还会生成副产物CH4,从而限制了反应温度的进一步降低。因此,在保持CO高选择性的前提下,提高CO2转化率并降低反应所需温度仍是当前亟待解决的问题。
低温等离子体(NTP)技术相较于传统方法具有更低的能耗,能够在较低温度下产生大量活性物质(如自由基和高能电子),是一种极具潜力的CO2转化方法。Joshi N等[12-13]研究发现,不同催化剂中负载CuO的催化剂对CO2的转化表现出更高的效率。当等离子体与催化剂联合使用时,等离子体放电可在催化剂表面产生活性物质,从而加速CO2的转化,CO2转化率提升至16.7%。这种方法不仅显著降低了反应温度,还增强了体系的活性。由此可认为,填充催化剂的DBD反应器在低温高效转化CO2方面具有较好的潜力。
本文设计了一种非平衡态等离子体与催化剂协同作用的反应装置。通过将原料气体引入填充催化剂的DBD反应器,考察不同实验条件下,特别是催化剂填充与否,对CO2转化率和CO选择性的影响,为两步法制备甲醇提供了新的研究思路。
-
实验所用气体及药品如下:氢气(≥99.99%,华阳气体)、二氧化碳(≥99.995%,华阳气体)、氩气(99.999%,华阳气体)、氮气(99.999%,华阳气体)、硝酸铜(Cu(NO3)2·3H2O,分析纯,上海沃凯生物技术有限公司)、氧化铝小球(Φ0.5−1 mm)。
实验仪器:同轴DBD式反应器(Ф8 mm)、等离子体电源(CTP-2000 K)、示波器(SDS 1102X-C)、质量流量计(SLD-MFC)、热流道温控箱、气相色谱仪(GC-7860plus)、空气发生器(NXA-5)、氢气发生器(NXH-300)
-
实验中所用的负载型金属催化剂以活性氧化铝小球(Φ0.5−1 mm)为载体,通过等体积浸渍法制备8%的Cu基催化剂。首先,测定载体的吸水量,取5 g载体放入100 mL纯净水中浸泡24 h后取出擦干表面水分称量测得吸水量为40%。以三水合硝酸铜(Cu(NO3)2·3H2O)作为负载金属的前驱体,并根据目标负载量计算所需前驱体的质量为1.316 g。将载体与相应量的盐溶液混合在40℃下搅拌4 h后,在室温下老化12 h。随后,将样品置于120℃的烘箱中干燥6 h,以初步除去水分。最后,将干燥后的催化剂放入马弗炉中,在450℃下焙烧5 h,完成催化剂的制备。
-
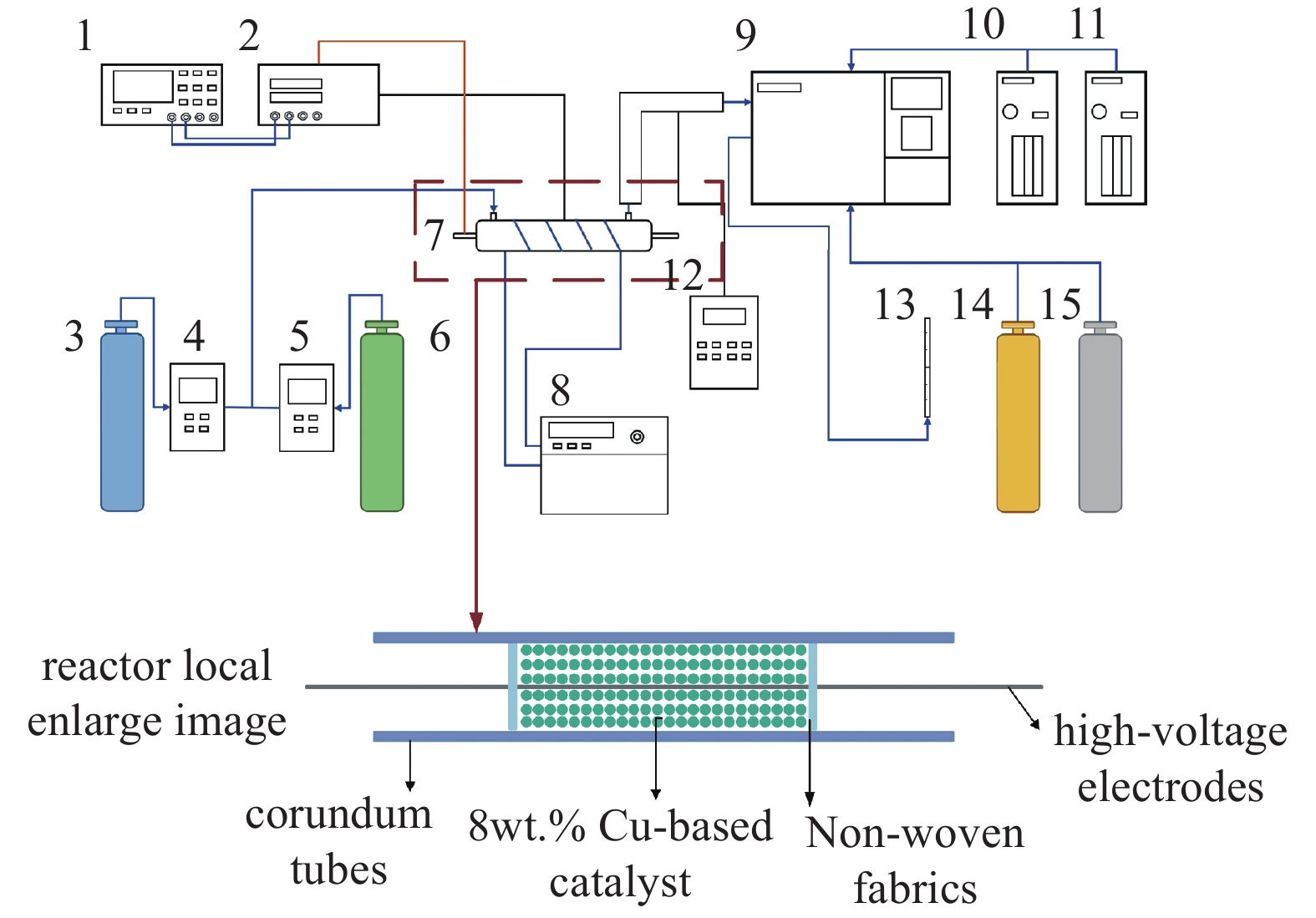
非平衡态等离子体催化CO2加氢的放电实验在如图1所示的装置中进行,采用内径8 mm的刚玉管作为反应器,直径2 mm不锈钢棒作为高压电极,放电长度为90 mm。CO2和H2按照设置比例混合后进入放电区域,反应后气体通入配有两个样品柱的气相色谱仪(GC-7860plus)中进行产物分析,其中热导池检测器(TCD)和氢火焰离子化检测器(FID)分别用于检测不同组分。在每次取样分析前,需循环冲洗30分钟,以确保精确,反应后气体主要包括CO、CO2、H2、CH4、CH3OH、CH3CH2OH等化合物。图2为本实验平台实物图。
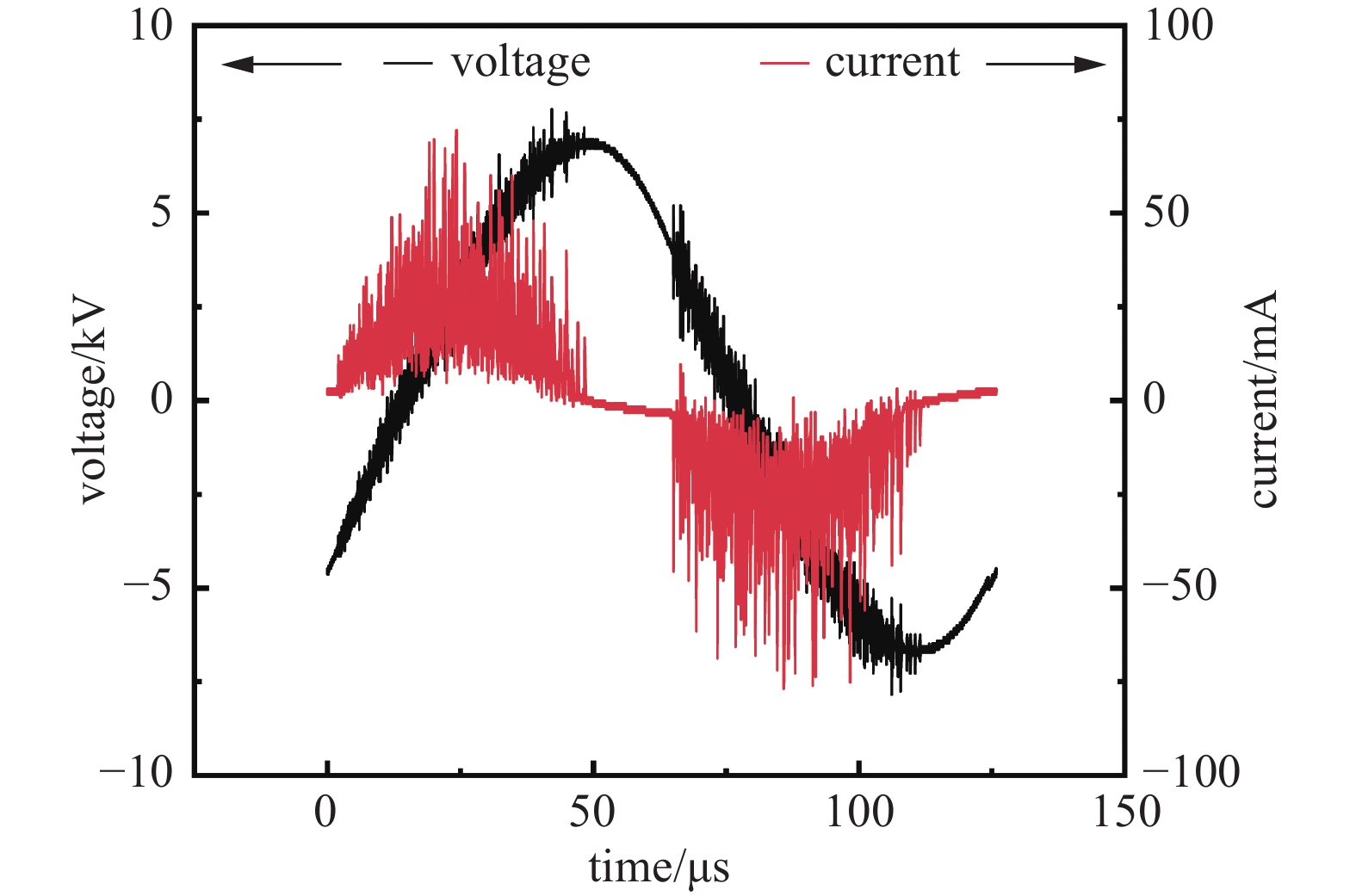
本实验中使用的等离子体电源可以输出高频高压正弦交流电,其中电压峰峰值可达到十几千伏。等离子体放电的电压和电流参数通过数字示波器进行测量,典型放电曲线如图3所示。由图3可见,在一个放电周期中,输出电压是正弦波,峰峰值为15 kV,放电频率为8.3 kHz。途中带有毛刺的放电部分占比较大,此时高能粒子碰撞较为剧烈,CO2获得较高的转化率也可能与此有关。由于本实验中等离子体放电设备为非对称结构,所以图中放电过程电压下降沿电流毛刺区域持续时间更长。实验中不同的放电条件下需要调整合适的放电频率才能获得最大的放电功率。本研究每次实验都调整到最大放电功率,因此后文不再讨论放电频率的影响。实验中的等离子体放电功率通过示波器输出的电压和电流进行计算。
-
CO2转化率计算公式如下:
其中,
$ {Q\left({\mathrm{C}\mathrm{O}}_{2}\right)}_{{\mathrm{in}}} $ 和$ {Q\left({\mathrm{C}\mathrm{O}}_{2}\right)}_{{\mathrm{out}}} $ 分别表示反应初始通入的CO2的流量和反应后的CO2流量,mL/min。生成物CO的选择性分别定义为:
其中,
$ {Q\left(\mathrm{C}\mathrm{O}\right)}_{{\mathrm{out}}} $ 表示反应过程中生成的CO的流量,mL/min。等离子体放电参数通过数字示波器测量,示波器误差为±3%。通过示波器输出放电电压和电流U、I,并运用积分原理计算单位周期内的放电功率P:
式中,U为放电电压,kV;I为放电电流,mA;T为放电周期,s;P为放电功率,W。在实验中,将数字示波器采集的电压和电流数据通过逐点相乘累加求解放电功率的平均值。
单位能量输入(Specific energy input,SEI)代表每摩尔气体所消耗的能量,单位kJ/mol,使用下面的公式计算:
式中,
$ {N}_{{\mathrm{in}}} $ 为输入气体的摩尔流量mol/s。能量效率(E)定义为CO2的转化量与放电功率的比值,单位µmol/kJ,使用下面的公式计算:
式中,
$ {\rho }_{{\mathrm{C}\mathrm{O}}_{2}} $ 为标况下CO2密度,g/mL;$ {M}_{{\mathrm{C}\mathrm{O}}_{2}} $ 为CO2摩尔质量,g/mol;P为放电功率,W。 -
本节讨论当放电电压不同时,在纯催化、纯等离子体放电以及两者协同作用下CO2转化率、CO选择性的变化规律,其中气体比例为CO2:H2=1:3、气体总流量为20 mL/min、循环水温度为80℃,放电电压依次为12 kV、14 kV、15 kV、16 kV。
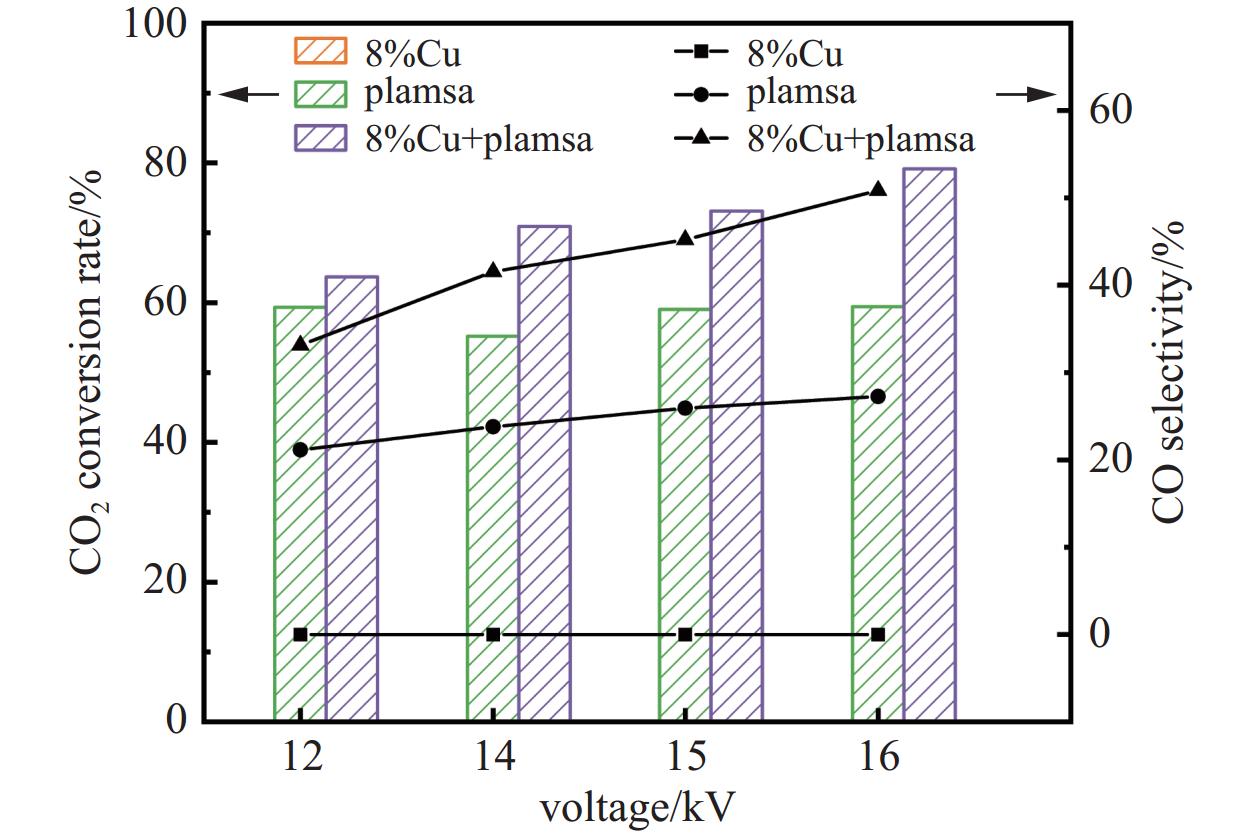
如图4所示,对比了纯催化、纯等离子体以及两者协同作用时不同电压对CO2转化率、CO选择性的影响。可以看出纯催化剂在80℃的温度下由于远远低于CO2分子活化的温度,并没有发生反应。仅有等离子体放电时,CO2转化率基本维持在55%−59%之间,CO选择性随着电压的增大略有涨幅,涨幅2%左右。两者耦合时,CO2转化率、CO选择性均有明显提高,同电压下,CO2转化率增大4.36%−19.75%、CO选择性增大11.98%−23.57%。电压的提高对CO2和H2分子活化有一定帮助,同时,较高的放电电压可以在短时间内使热量急剧增加,有利于反应的进行。
反应器中CO2的转化可能受到高能粒子增多的影响,促使更多的C=O键发生断裂,使CO2分解为CO和O2。如图5所示,CO2的转化率和CO的产率基本上随着外加电压、功率以及SEI的增加而逐步提高。这可能是由于高功率密度条件下生成的高能电子有效促进了CO2的深度分解。
-
本节讨论当气体流量不同时,在纯催化、纯等离子体放电以及两者协同作用下CO2转化率、CO选择性的变化规律,其中气体比例为CO2:H2=1:3、放电电压为15 kV、循环水温度为80℃,气体总流量依次为20 mL/min、30 mL/min、45 mL/min、60 mL/min、75 mL/min、90 mL/min。
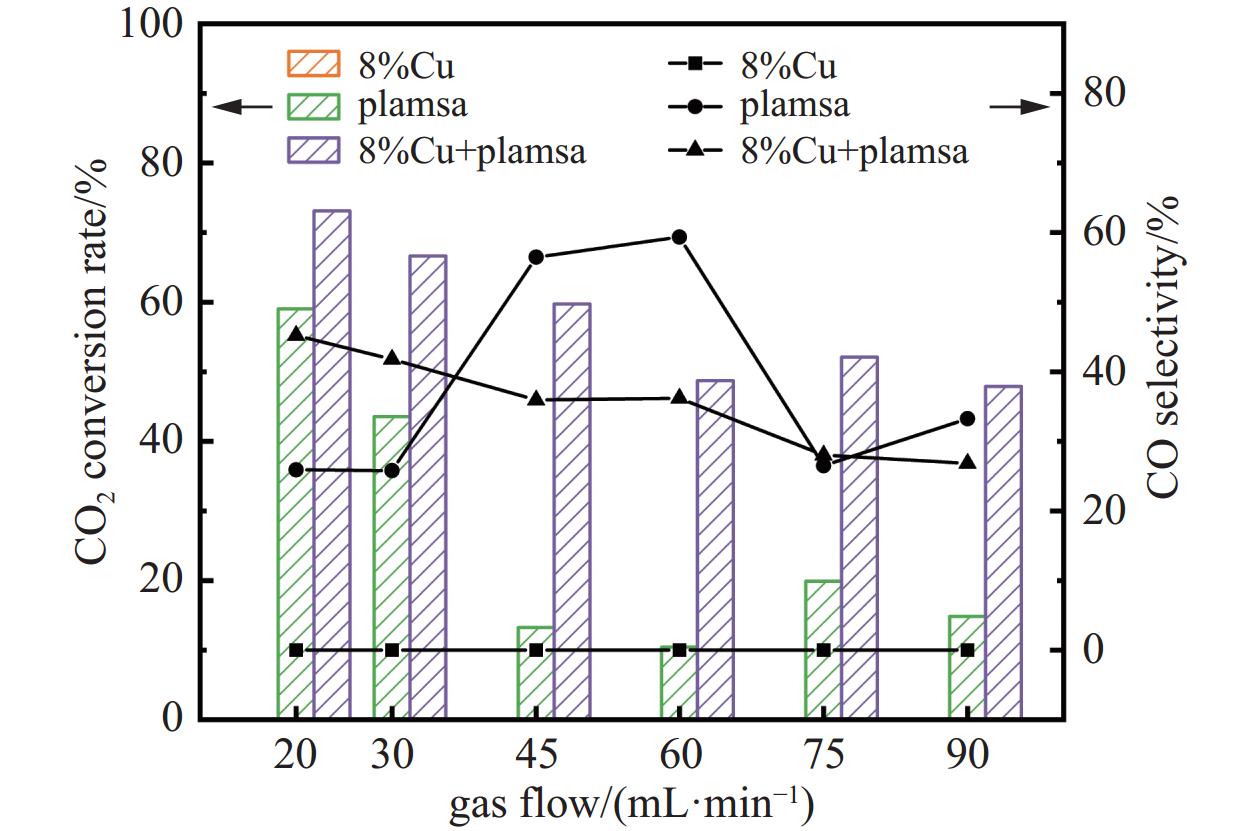
图6展示了不同气体流量下的CO2转化率和CO选择性。针对CO2转化率来说,纯等离子体放电和等离子体与催化剂协同作用两种情况下,转化率总体上随着流量增大而降低,75 mL/min时略微增高。其中气体流量为20 mL/min和30 mL/min时,在纯等离子体作用下CO2转化率分别为59.04%和43.53%,而45 mL/min、60 mL/min、75 mL/min、90 mL/min时CO2转化率平均只能达到14.60%。两者协同作用下,转化率最高可达到73.10%,考虑是流量较小时气体在放电区域停留时间较长,在等离子体放电区域和高能粒子碰撞的几率更大。催化剂的加入更有利于CO2的转化,这种作用在大流量时体现的更加明显。
针对CO选择性来说,纯等离子体放电时,呈现先增大后减小的凸型曲线,气体流量为60 mL/min时达到最大值,最大值可达59.35%。原因是此时CO2转化率下降,CO产量基本不变,所以选择性显得较高。而气体流量再增大的时候,有可能因为气流速度过快,在中心放电区域经过时带走了部分热量或者是停留时间较短,气体换热时间不长,不利于这一吸热反应的进行。催化剂与等离子体协同作用时CO选择性在20 mL/min−45 mL/min时逐渐下降,45 mL/min-60 mL/min时持平,60 mL/min−90 mL/min时继续下降。并且由于此时CO2转化率降低幅度没有纯等离子体放电时大,所以没有出现凸型曲线,持平的原因可能是转化率的降低。如果只有催化剂存在,在该实验条件下CO选择性几乎为0。
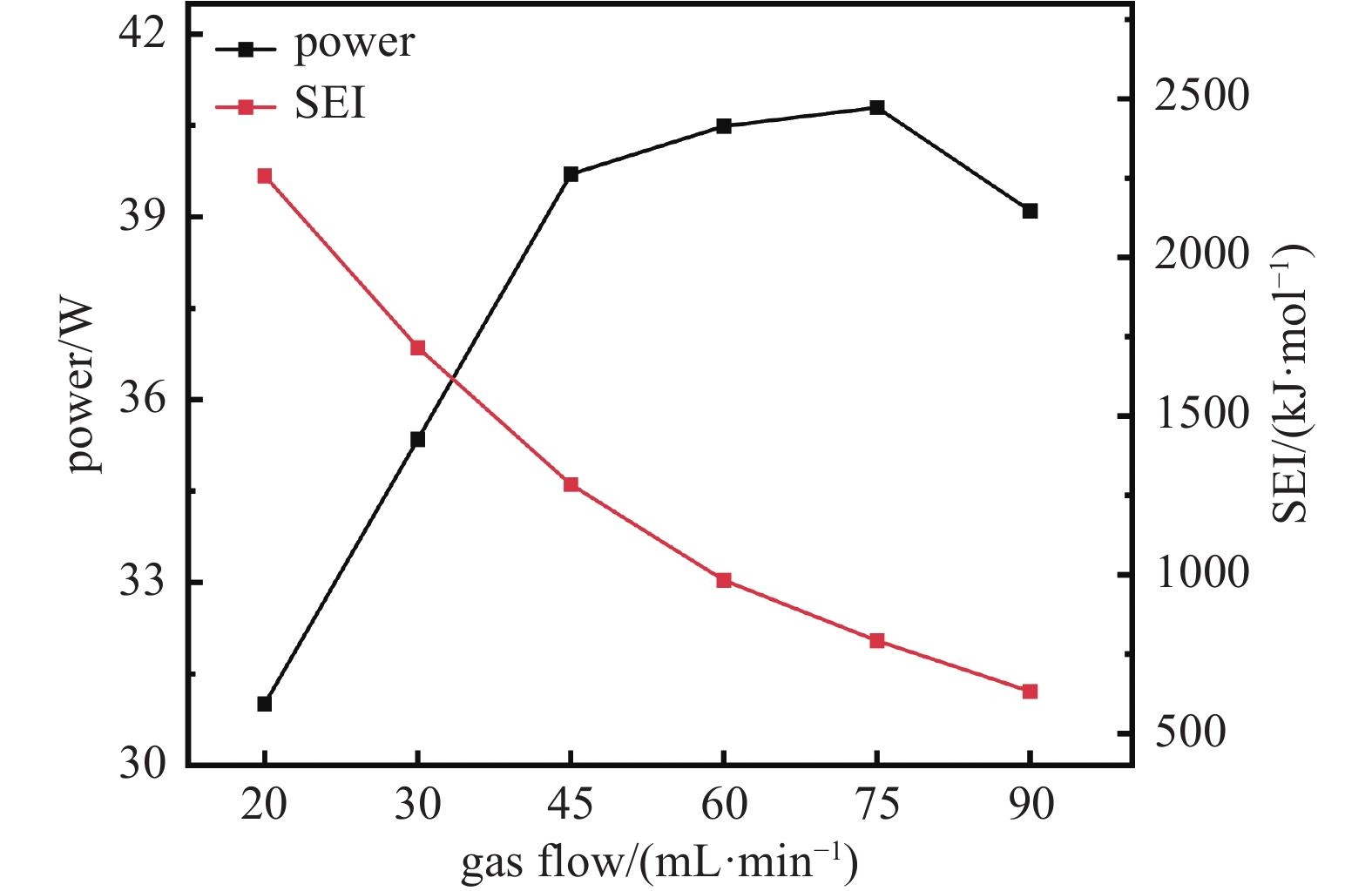
图7为不同气体流量对放电功率、SEI的影响,随着气体总流量的不断增大,放电功率分为三个阶段,20 mL/min−40 mL/min的迅速增长阶段、40 mL/min−75 mL/min的缓慢增长阶段以及75 mL/min−90 mL/min的下降阶段。SEI随着流量的增加逐渐下降,表明每毫升气体体积消耗的能量逐渐减少。
-
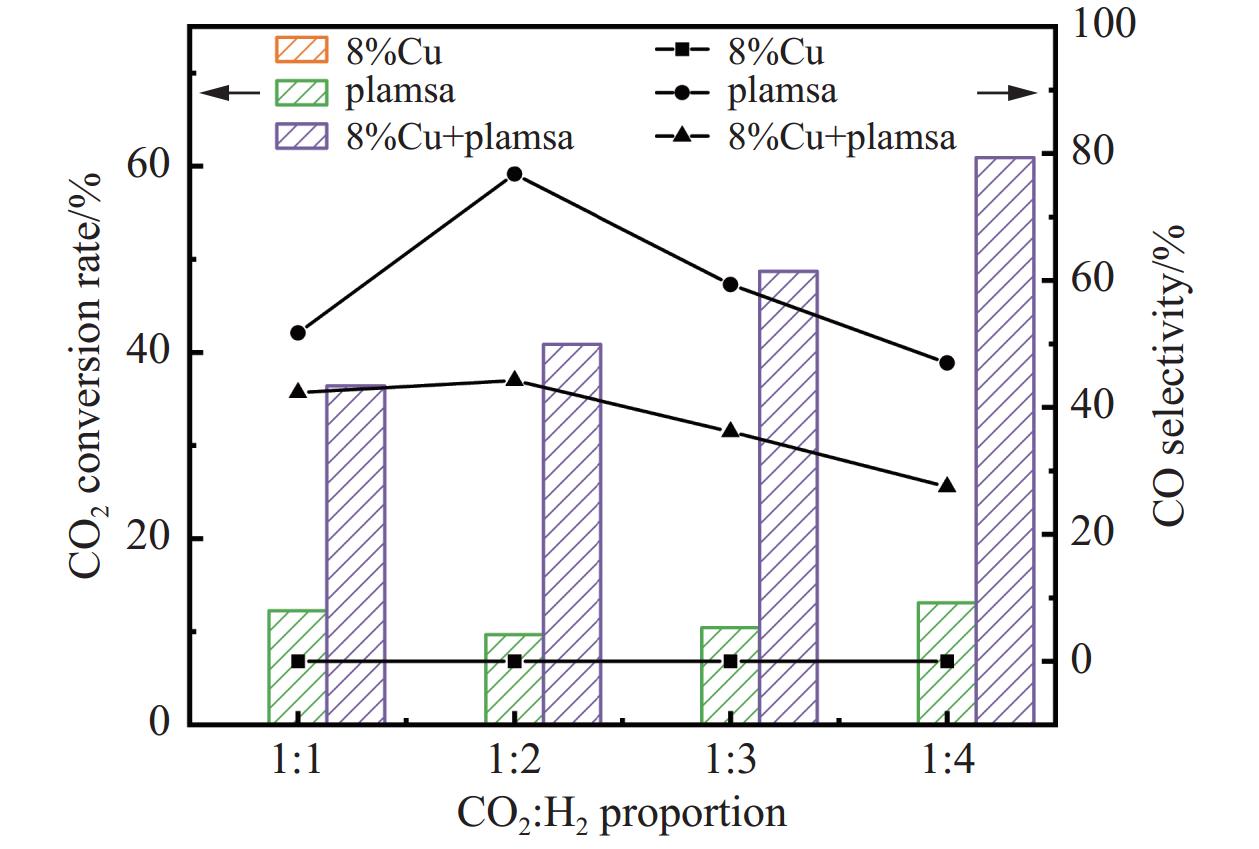
本节讨论当气体比例不同时,在纯催化、纯等离子体放电以及两者协同作用下CO2转化率、CO选择性的变化规律,其中循环水温度为80℃、气体总流量为60 mL/min、放电电压为15 kV,气体比例依次为CO2:H2=1:1、1:2、1:3、1:4。
图8显示,在纯等离子体放电条件下,不同气体比例下的CO2转化率差异较小,均维持在约10%左右。而在等离子体与催化剂协同作用下,CO2转化率显著提高,范围在36%−61%之间,并随着H2比例的增加而逐步提升。对于CO的选择性而言,无论是纯等离子体放电还是催化剂与等离子体的耦合作用,在CO2:H2=1:2时均达到最大值,且在耦合作用下这种提升效果更加显著。这表明催化剂的存在不仅能够有效调控CO2的转化率,还能进一步强化产物的选择性,尤其在CO2:H2=1:2的条件下,更有利于CO的生成。
Khan M K等[14]的研究发现,较低的CO2/H2比值可以增强CO2的活化能力。例如,在FeAlOx-5催化剂上,当CO2:H2从2:1改变到1:3时,CO2的转化率从12.5%显著提高至36.8%,而CO选择性则从28.9%显著降低至7.2%。此外,Gao J等[15]对CO2加氢的热力学进行了系统分析,结果与本研究一致,RWGS反应是生成CO的主导反应,且降低CO2/H2比对产物中CO浓度具有负面影响。
本实验中气体比例对放电功率的影响较小,本节中不加以讨论。
-
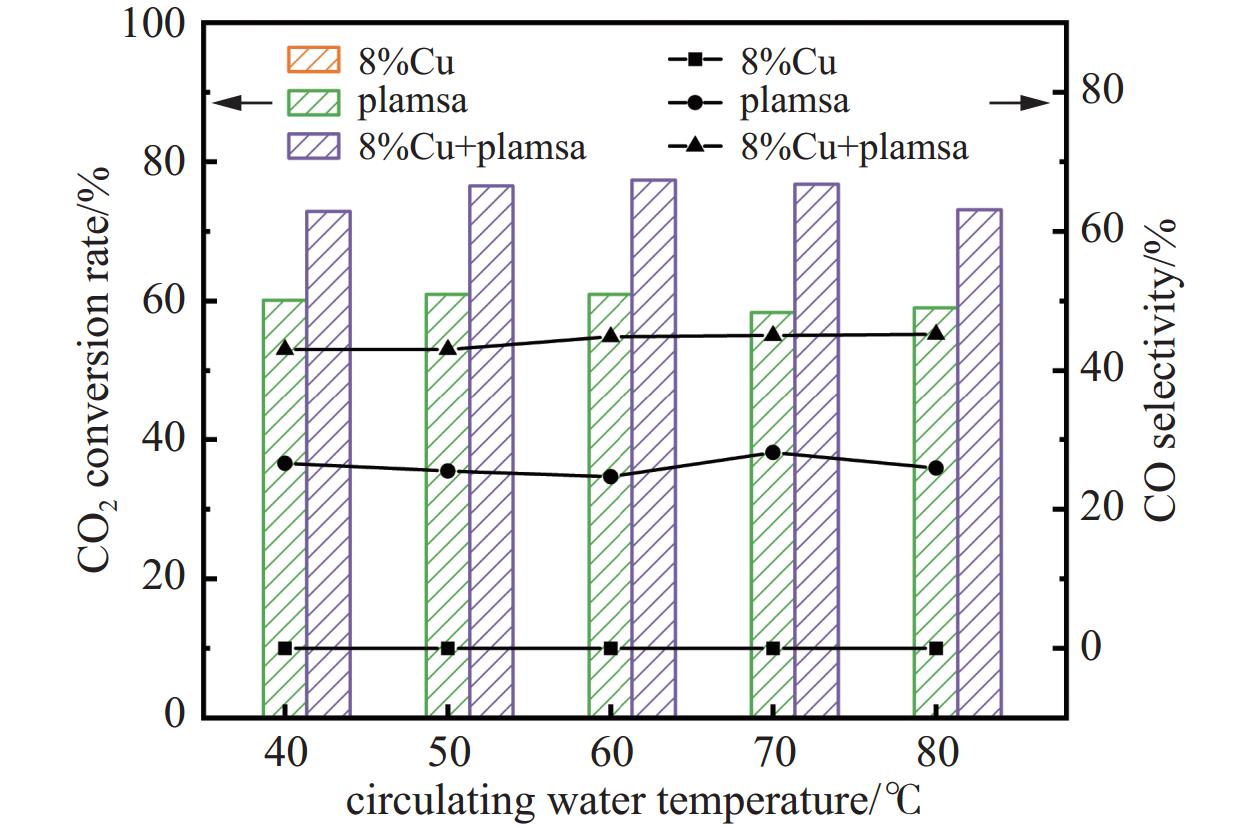
本节讨论当循环水温度不同时,在纯催化、纯等离子体放电以及两者协同作用下CO2转化率、CO选择性的变化规律,其中气体比例为CO2:H2=1:3、放电电压为15 kV、气体总流量为20 mL/min,循环水温度依次为40℃、50℃、60℃、70℃、80℃。
如图9所示,随着循环水温度在40℃至80℃范围内的升高,纯等离子体条件下CO2的转化率在58.35%−60.95%之间小幅波动,CO的选择性则在24.65%−28.14%之间小幅波动。在等离子体与催化剂耦合的条件下,CO2转化率提升了约12%−18%。总体来看,单独调节循环水温度并不足以显著改变产物选择性,需与其他条件协同调控以实现最佳效果。本实验中循环水温度对放电功率的影响较小。
-
在等离子体放电过程中,电子与CO2分子相互作用,通过电子碰撞引发分子解离,这被认为是DBD反应器中实现CO2转化的主要机制之一。此外,在等离子体处理CO2的过程中,还可能发生电子引发的解离反应以及电子碰撞引发的电离反应[16]。
CO2的转化从以下等离子体反应开始。
先前的实验研究表明,在恒定频率下,通过增加放电电压或输入功率均有利于更多的C=O键断裂,导致更多的CO2分解为CO和O,进而促进反应物气体的转化。
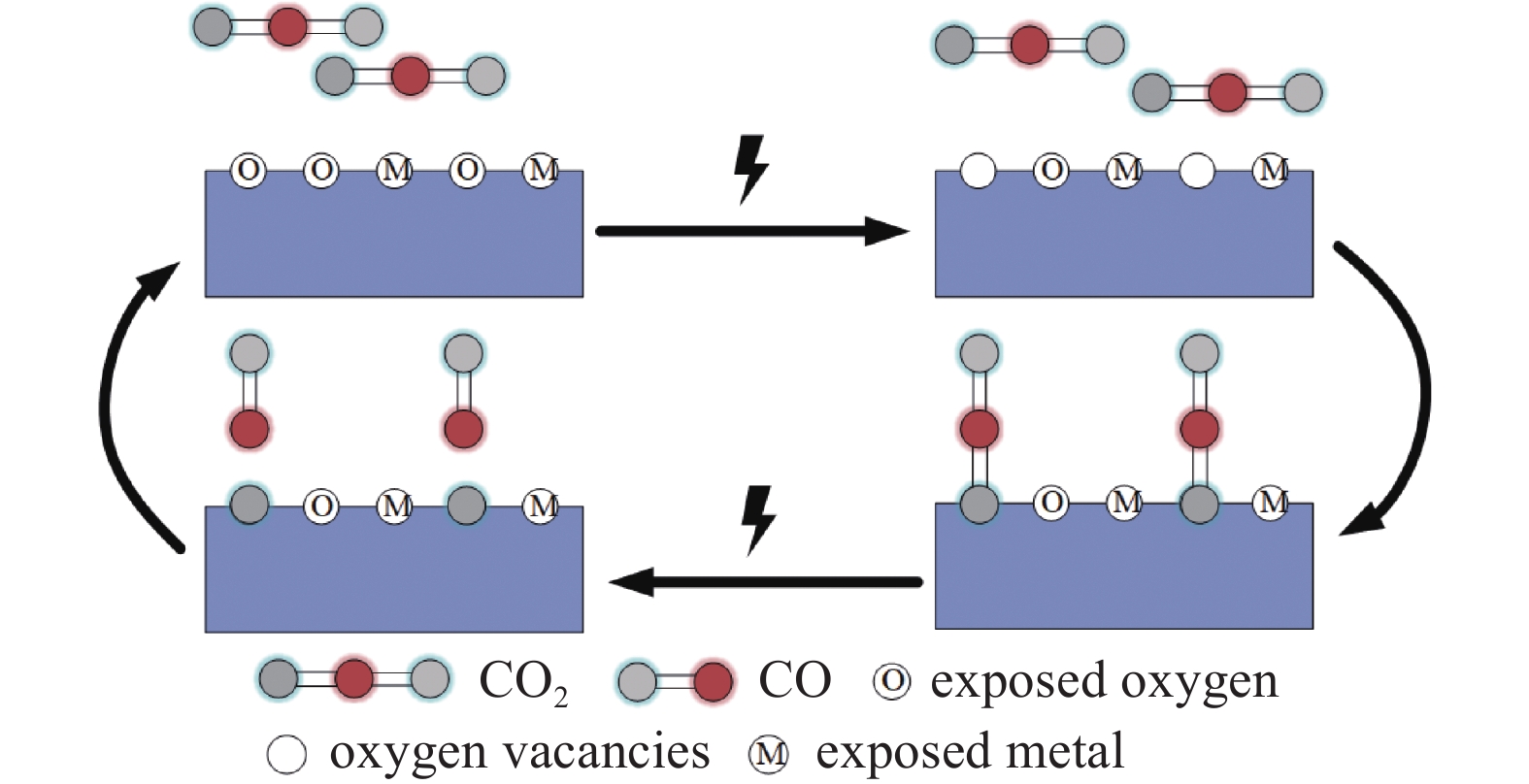
同时,催化材料与等离子体的协同作用使DBD反应器的CO2转化性能得到了改善。一方面催化材料对放电特性的影响以及对CO2的吸附作用使得反应器内的环境更有利于CO2转化;另一方面,等离子体电场激活了催化材料的催化效应,CO2可以在催化材料表面就可以被转化。一般来说,所有氧化物基催化剂都由不同的非化学计量氧组成[17]。催化剂暴露于等离子体环境中时,O从材料表面脱落造成氧空位,反应器间隙中的CO2中的O会填补空位,在催化剂的作用下促进了CO2的活化,使CO2更容易分解为CO离开催化材料表面,如图10所示。
表1对比了其他研究与本实验的数据,可以看出,DBD与催化剂的协同作用效果十分显著,本文采用的催化剂及其反应条件较为适合将CO2转化为CO。
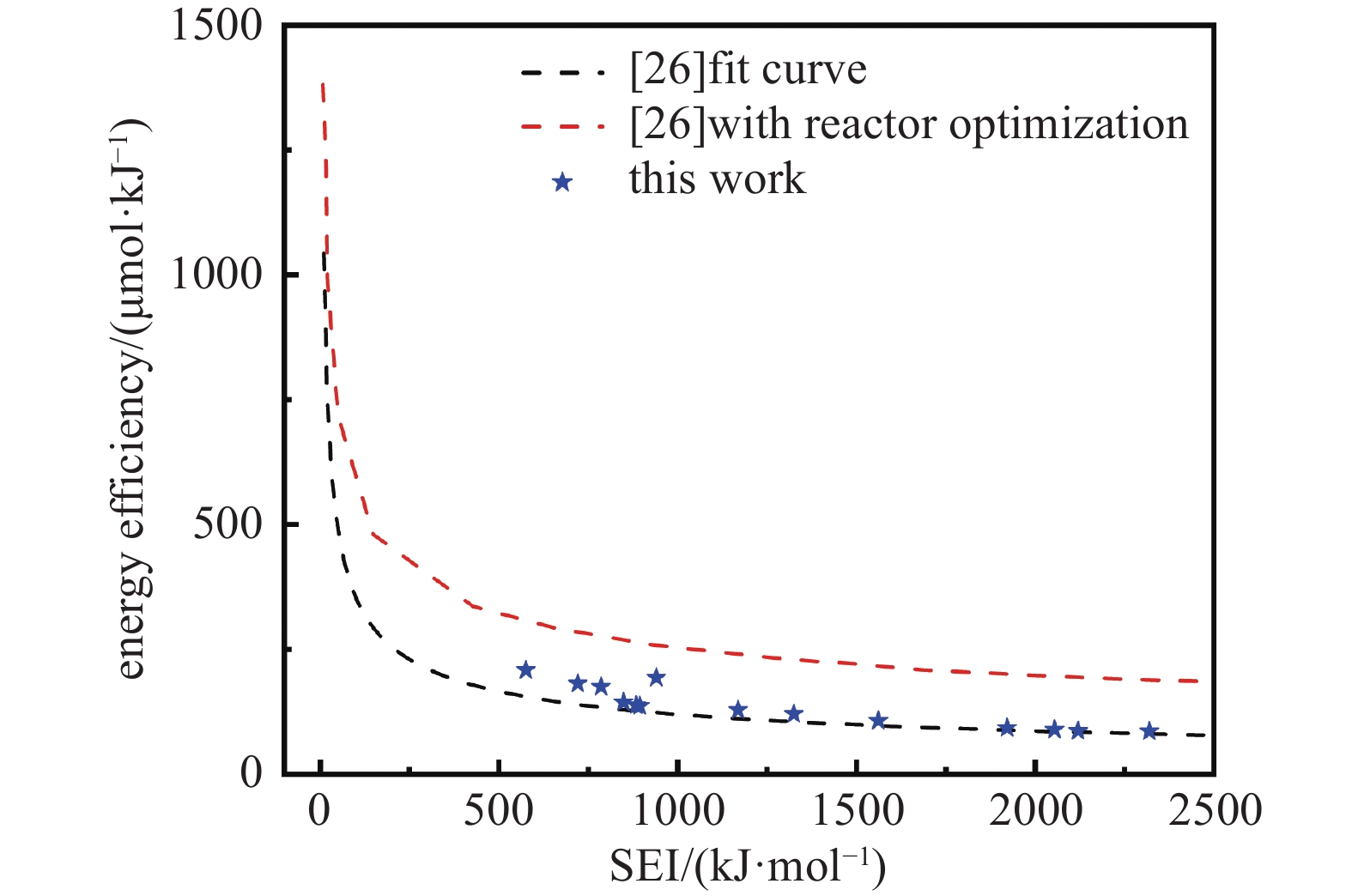
Luo Y等[26]从以前的研究收集能量效率的数据,利用Chapman函数对实验数据进行了非线性曲线拟合,得到了如下关系并绘制于图11中。
同时Luo Y等[26]对反应器优化的研究指出,增加叶片等装置诱导气体产生湍流和旋涡,可改善传热效果,或将磁场与针电极反应器耦合或采用三电极平行放电模式增大了放电体积,使气体停留时间更长,可以有效提高能量效率。图11中分别绘制了根据式(12)得到的实验数据拟合曲线和优化设计后的预期曲线。从图中看出在较低的输入能量下能得到较高的能量效率。这是由于在较高的输入能量下,更多比例的能量被用于气体加热,而不是用于CO2的转化。由于在实际应用中流量通常较高,因此可以实现最佳的能量效率[26]。
由图11可见,在500~1100 kJ/mol范围内本实验能量效率与文献实验平均数据相比有较为显著的提高,在气体比例CO2:H2为1:1和1:2,气体流量为60−90 mL/min的条件下,能量效率较高,最高可达208.47 µmol/kJ。进一步研究应考虑改善传热效果和增加反应时间等方案,以期进一步提高能量效率。
-
本文通过等离子体协同Cu基催化剂的方法,构建介质阻挡放电实验平台,研究了CO2加氢的逆水煤气反应。重点考察了放电电压、气体总流量、气体比例和循环水温度四个因素对CO2转化率和CO选择性的影响。
研究结果表明,等离子体放电与催化剂的协同作用显著。当放电电压为16 kV、气体总流量为20 mL/min、气体比例CO2:H2=1:3、循环水温度为80℃时,CO2的转化率达到79.17%,相比纯等离子体和纯催化作用分别提高了19.75%和79.17%;CO选择性达到50.83%,相比纯等离子体和纯催化作用分别提高了23.57%和50.83%。在等离子体与Cu基催化剂协同作用下,CO2转化率和CO选择性随着放电电压的升高而增加。当放电电压从12 kV升至16 kV时,CO2转化率和CO选择性基本随等离子体放电功率呈线性增长。
此外,CO2转化率和CO选择性随着气体流量的增加而降低。在CO2:H2=1:2条件下,CO选择性达到峰值44.24%。循环水温度对两者的影响较小,单独调节循环水温度难以显著改变产物选择性,需与其他条件配合优化。CO选择性最佳的实验条件为:放电电压16 kV、气体总流量20 mL/min、CO2:H2=1:2、循环水温度60℃。
在气体比例CO2:H2为1:1和1:2,气体流量为60−90 mL/min的条件下,能量效率较高,最高可达208.47 µmol/kJ,表明在这些条件下,同轴圆筒式单介质DBD具有较低能耗的特点。本研究结果证明了等离子体与催化剂耦合技术在催化CO2与H2进行逆水煤气反应中的可行性和高效性,同时为后续研究提供了新的思路和参考依据。
非平衡态等离子体催化CO2加氢逆水煤气反应的实验研究
Experimental Study on Non-Equilibrium Plasma-Catalyzed Reverse Water-Gas Shift Reaction for CO2 Hydrogenation
-
摘要: 文章采用非平衡态等离子体放电技术协同Cu基催化剂的方法,促进CO2加氢逆水煤气反应低温高效地进行。实验对比分析了纯催化、纯等离子体以及二者协同作用下对CO2转化性能的影响,重点考察了等离子体放电电压、气体流量、CO2和H2的比例、循环水温度对CO2转化率、CO选择性的影响,以及不同条件下的SEI值和能量效率。结果表明,等离子体放电与催化剂协同作用效果显著,在放电电压为16 kV,气体流量为20 mL/min,CO2:H2=1:3,循环水温度为80℃时,CO2的转化率高达79.17%,CO选择性达到50.83%。在CO2:H2比例为1:1、1:2以及60−90 mL/min的大流量条件下能量效率较高,最高可达208.47 µmol/kJ。Abstract: This study employs a non-equilibrium plasma discharge technology combined with Cu-based catalysts to enhance the low-temperature efficiency of CO2 hydrogenation via the reverse water-gas shift (RWGS) reaction. The experiment compared and analyzed the effects of catalysis, plasma, and their synergistic effects on CO2 conversion performance, focusing on the effects of plasma discharge voltage, gas flow rate, CO2 and H2 ratio, circulating water temperature on CO2 conversion rate and CO selectivity, as well as SEI values and energy efficiency under different conditions. The results showed that the synergistic effect of plasma discharge and catalyst was significant. At a discharge voltage of 16 kV, gas flow rate of 20 mL/min, CO2:H2=1:3, and circulating water temperature of 80℃, the conversion rate of CO2 reached 79.17%, and the selectivity of CO reached 50.83%. Under high flow conditions with CO2:H2 ratios of 1:1 or 1:2, and 60−90 mL/min, the energy efficiency is relatively high, reaching up to 208.47 µmol/kJ.
-

-
图 4 8% Cu基催化剂在不同放电电压下对CO2转化率、CO选择性的影响(操作条件:气体比例CO2:H2为1:3、气体总流量为20 mL/min、循环水温度为80℃)
Figure 4. The effect of an 8% Cu-based catalyst on CO2 conversion rate and CO selectivity under different discharge voltages (Operating conditions: gas ratio of CO2 to H2 is 1:3, total gas flow rate is 20 mL/min, and circulating water temperature is 80℃)
图 5 8%Cu基催化剂在不同放电电压下对放电功率、SEI的影响(操作条件:气体比例CO2:H2为1:3、气体总流量为20 mL/min、循环水温度为80℃)
Figure 5. The effect of an 8% Cu-based catalyst on discharge power and SEI under different discharge voltages (Operating conditions: gas ratio of CO2 to H2 is 1:3, total gas flow rate is 20 mL/min, and circulating water temperature is 80℃)
图 6 8%Cu基催化剂在不同气体流量下对CO2转化率、CO选择性的影响(操作条件:气体比例CO2:H2为1:3、放电电压为15 kV、循环水温度为80℃)
Figure 6. The effect of an 8% Cu-based catalyst on CO2 conversion rate and CO selectivity under different gas flow rates (Operating conditions: gas ratio of CO2 to H2 is 1:3, discharge voltage is 15 kV, and circulating water temperature is 80℃)
图 7 8%Cu基催化剂在不同气体流量下对放电功率、SEI的影响(操作条件:气体比例CO2:H2为1:3、放电电压为15 kV、循环水温度为80℃)
Figure 7. The effect of an 8% Cu-based catalyst on discharge power and SEI under different gas flow rates (Operating conditions: gas ratio of CO2 to H2 is 1:3, discharge voltage is 15 kV, and circulating water temperature is 80℃)
图 8 8%Cu基催化剂在不同CO2:H2气体比例下对CO2转化率和CO选择性影响(操作条件:循环水温度为80℃、气体总流量为60 mL/min、放电电压为15 kV)
Figure 8. The effect of an 8% Cu-based catalyst on CO2 conversion rate and CO selectivity under different gas ratios of CO2:H2 (Operating conditions: circulating water temperature is 80℃, total gas flow rate is 60 mL/min, and discharge voltage is 15 kV)
图 9 8%Cu基催化剂在不同循环水温度下对CO2转化率和CO选择性影响(操作条件:气体比例CO2:H2为1:3、气体总流量为20 mL/min、放电电压为15 kV)
Figure 9. The effect of an 8% Cu-based catalyst on CO2 conversion rate and CO selectivity under different circulating water temperatures (Operating conditions: gas ratio of CO2 to H2 is 1:3, total gas flow rate is 20 mL/min, and discharge voltage is 15 kV)
表 1 CO2转化的研究对比
Table 1. Comparison of research on CO2 conversion
反应器类型 功率/W 流量/(mL/min) 催化剂类型 CO2转化率/% CO选择性/% 引用文献 DBD 2.0 30 Quartz wool 9.3 65 [2] DBD 2.4 30 5%ZnO+g-C3N4 12 70 [18] DBD 2.2 30 15%CuO/Al2O3 15.7 48 [19] DBD 28 60 BaTiO3 38 − [20] DBD 55 150 Molecular Sieves 5A 25 63 [21] DBD 50 50 Glass beads ~21 ~95 [22] GAD 14000 9 [23] GAD 850 18 [24] MW 2200 10 [25] DBD 35 20 8%CuO/Al2O3 79.17 50.83 This work -
[1] 迟岩, 杨白桦, 王其乐. “双碳”目标下能源企业绿色低碳发展研究[J]. 能源与节能,2023(10):80−82 (in Chinese) Chi Y, Yang B H, Wang Q L. Green and low-carbon development of energy enterprises under goal of "double carbon"[J]. Energy and Energy Conservation,2023(10):80−82 [2] Umamaheswara Rao M, Bhargavi K V S S, Chawdhury P, et al. Non-thermal plasma assisted CO2 conversion to CO: Influence of non-catalytic glass packing materials[J]. Chemical Engineering Science,2023,267:118376 doi: 10.1016/j.ces.2022.118376 [3] 齐啸. CO2捕集与资源化利用技术现状及发展方向[J]. 化学工程师,2023,37(1):58−62 (in Chinese) Qi X. Current situation and development direction of CO2 capture and resource utilization technology[J]. Chemical Engineer,2023,37(1):58−62 [4] Zhang S, Shen Y, Wang L, et al. Phase change solvents for post-combustion CO2 capture: Principle, advances, and challenges[J]. Applied Energy,2019,239:876−897 doi: 10.1016/j.apenergy.2019.01.242 [5] Vidal-López A, López E D, Comas-Vives A. Enhanced catalytic performance of single-atom Cu on Mo2C toward CO2/CO hydrogenation to methanol: a first-principles study[J]. Catalysis Science & Technology,2024,14(23):6904−6916 [6] Zhong J, Yang X, Wu Z, et al. State of the art and perspectives in heterogeneous catalysis of CO2 hydrogenation to methanol[J]. Chemical Society Reviews,2020,49(5):1385−1413 doi: 10.1039/C9CS00614A [7] Wu Z, Shen J, Li C, et al. Mo2TiC2 MXene-supported Ru clusters for efficient photothermal reverse Water–Gas Shift[J]. ACS Nano,2023,17(2):1550−1559 doi: 10.1021/acsnano.2c10707 [8] Tang R, Zhu Z, Li C, et al. Ru-Catalyzed reverse water gas shift reaction with Near-Unity selectivity and superior stability[J]. ACS Materials Letters,2021,3(12):1652−1659 doi: 10.1021/acsmaterialslett.1c00523 [9] Daza Y A, Kuhn J N. CO2 conversion by reverse water gas shift catalysis: comparison of catalysts, mechanisms and their consequences for CO2 conversion to liquid fuels[J]. RSC Advances,2016,6(55):49675−49691 doi: 10.1039/C6RA05414E [10] Sun E, Wan G, Haribal V, et al. Low-temperature carbon dioxide conversion via reverse water-gas shift thermochemical looping with supported iron oxide[J]. Cell Reports Physical Science,2023,4(9):101581 doi: 10.1016/j.xcrp.2023.101581 [11] Cui X, Kær S K. Thermodynamic analyses of a moderate-temperature process of carbon dioxide hydrogenation to methanol via reverse water–gas shift with in situ water removal[J]. Industrial & Engineering Chemistry Research,2019,58(24):10559−10569 [12] Joshi N, Loganathan S. Methanol synthesis from CO2 using Ni and Cu supported Fe catalytic system: Understanding the role of nonthermal plasma surface discharge[J]. Plasma Processes and Polymers,2021,18(5):2000104 doi: 10.1002/ppap.202000104 [13] Joshi N, Sivachandiran L. Exploring the feasibility of liquid fuel synthesis from CO2 under cold plasma discharge: role of plasma discharge in binary metal oxide surface modification[J]. RSC Advances,2021,11(44):27757−27766 doi: 10.1039/D1RA04852J [14] Khan M K, Butolia P, Jo H, et al. Selective conversion of carbon dioxide into liquid hydrocarbons and long-chain α-olefins over Fe-Amorphous AlOx bifunctional catalysts[J]. ACS Catalysis,2020,10(18):10325−10338 doi: 10.1021/acscatal.0c02611 [15] Gao J, Wang Y, Ping Y, et al. A thermodynamic analysis of methanation reactions of carbon oxides for the production of synthetic natural gas[J]. RSC Advances,2012,2(6):2358 doi: 10.1039/c2ra00632d [16] Yap D, Tatibouët J M, Batiot-Dupeyrat C. Carbon dioxide dissociation to carbon monoxide by non-thermal plasma[J]. Journal of CO2 Utilization,2015,12:54−61 doi: 10.1016/j.jcou.2015.07.002 [17] Ray D, Chawdhury P, Bhargavi K. V. S. S, et al. Ni and Cu oxide supported γ-Al2O3 packed DBD plasma reactor for CO2 activation[J]. Journal of CO2 Utilization,2021,44:101400 doi: 10.1016/j.jcou.2020.101400 [18] Quigley K M, Althoff A G, Donati G L. Inductively coupled plasma optical emission spectrometry as a reference method for silicon estimation by near infrared spectroscopy and potential application to global-scale studies of plant chemistry[J]. Microchemical Journal,2016,129:231−235 doi: 10.1016/j.microc.2016.06.028 [19] Ray D, Subrahmanyam Ch. CO2 decomposition in a packed DBD plasma reactor: influence of packing materials[J]. RSC Advances,2016,6(45):39492−39499 doi: 10.1039/C5RA27085E [20] Mei D, He Y L, Liu S, et al. Optimization of CO2 conversion in a cylindrical dielectric barrier discharge reactor using design of experiments: optimization of CO2 conversion[J]. Plasma Processes and Polymers,2016,13(5):544−556 doi: 10.1002/ppap.201500159 [21] Kwak J H, Kovarik L, Szanyi J. Heterogeneous catalysis on atomically dispersed supported metals: CO2 reduction on multifunctional Pd catalysts[J]. ACS Catalysis,2013,3(9):2094−2100 doi: 10.1021/cs4001392 [22] Mei D, Zhu X, He Y L, et al. Plasma-assisted conversion of CO2 in a dielectric barrier discharge reactor: understanding the effect of packing materials[J]. Plasma Sources Science and Technology,2014,24(1):015011 doi: 10.1088/0963-0252/24/1/015011 [23] Nunnally T, Gutsol K, Rabinovich A, et al. Dissociation of CO2 in a low current gliding arc plasmatron[J]. Journal of Physics D: Applied Physics,2011,44(27):274009 doi: 10.1088/0022-3727/44/27/274009 [24] Indarto A, Yang D R, Choi J W, et al. Gliding arc plasma processing of CO2 conversion[J]. Journal of Hazardous Materials,2007,146(1-2):309−315 doi: 10.1016/j.jhazmat.2006.12.023 [25] Adamovich I, Agarwal S, Ahedo E, et al. The 2022 Plasma Roadmap: low temperature plasma science and technology[J]. Journal of Physics D: Applied Physics,2022,55(37):373001 doi: 10.1088/1361-6463/ac5e1c [26] Luo Y, Yue X, Zhang H, et al. Recent advances in energy efficiency optimization methods for plasma CO2 conversion[J]. Science of The Total Environment,2024,906:167486 doi: 10.1016/j.scitotenv.2023.167486 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: