-
结直肠癌是全球癌症死亡的主要原因之一[1]. 其临床筛查主要依赖于粪便免疫化学检测和内窥镜检查. 其中, 内窥镜检测主要分为宽场光学内镜(widefield optical endoscopy, WOE)和超声内镜(endoscopic ultrasound, EUS). 两种内镜均已成功实现临床转化, 成为众多内科疾病筛查和诊断的金标准[2,3]. 但是由于生物组织的高度散射特性, 常规的光学内窥镜只能对浅表组织进行成像, 严重妨碍了其在临床的广泛使用[4,5]. 超声内镜主要是通过前置的微型超声换能器进行扫描成像, 根据组织的声阻抗差异来显示组织/器官的形态学特征, 但其存在组织对比度差和功能/分子成像能力不足的问题[6,7].
光声成像(photoacoustic imaging, PAI)是一种新兴的生物医学影像技术. 其兼具光学成像的高组织对比度、超声成像的高穿透深度, 以及强大的功能/分子成像能力, 可以为光散射区域的深层组织提供高分辨、高对比度的非侵入性成像结果[8–11]. 光声内镜(photoacoustic endoscopy, PAE)将光声成像和内窥镜技术相结合, 能够很好地弥补传统光学内镜和超声内镜的不足. 其通过微型的探头插入人体, 利用光声成像的光谱成像能力获取内脏器官的结构和功能信息. 根据聚焦方式不同, 光声内镜大体上可以分为光聚集光声内镜(optical-resolution photoacoustic endoscopy, OR-PAE)和声聚集光声内镜(acoustic-resolution photoacoustic endoscopy, AR-PAE)[10–12]. 光聚集光声内镜可以通过聚焦激发光束来获得微米量级的高横向分辨率. 但是与常规光学内镜类似, 由于生物组织中光的强散射性, 仅能穿透约1 mm左右的深度. 由于采用光聚焦的方法, 其成像景深也很浅, 在离焦区域其分辨率会迅速降低, 造成视野的模糊. 此外, 此类光声内镜的波长选择也较为有限, 主要用于组织浅表血管网络的成像. 声聚焦光声内镜则可以有效地利用超声在组织中的高穿透深度, 实现对深层组织的探测. 其空间分辨率主要由超声换能器的带宽、数值孔径和中心频率等固有参数决定, 一般在数十到百微米[13]. 另外, 声聚焦光声内镜可以和波长可协调的高能量光参量振荡(optical parametric oscillator, OPO)脉冲激光器相配合, 实现对直肠等体内器官深层组织的高特异性分子成像, 在基础生命科学研究和临床医学中有良好的应用前景[14–18].
本文设计了一款小型化的手持式声聚焦光声/超声双模态内窥探头. 该探头直径为8 mm, 其不仅具有常规声聚焦光声内镜的光谱成像能力、高空间分辨率以及高穿透深度, 还可以和新型的光声泵浦成像方法结合, 实现深层组织内高特异性的分子成像. 本文通过一系列的仿体及在体实验对该探头的性能进行了验证. 结果表明, 该探头具有在深层组织的高特异性分子成像能力, 有望弥补现有光学和超声消化道内镜的相关不足, 成为相关疾病诊断的潜在有力工具.
-
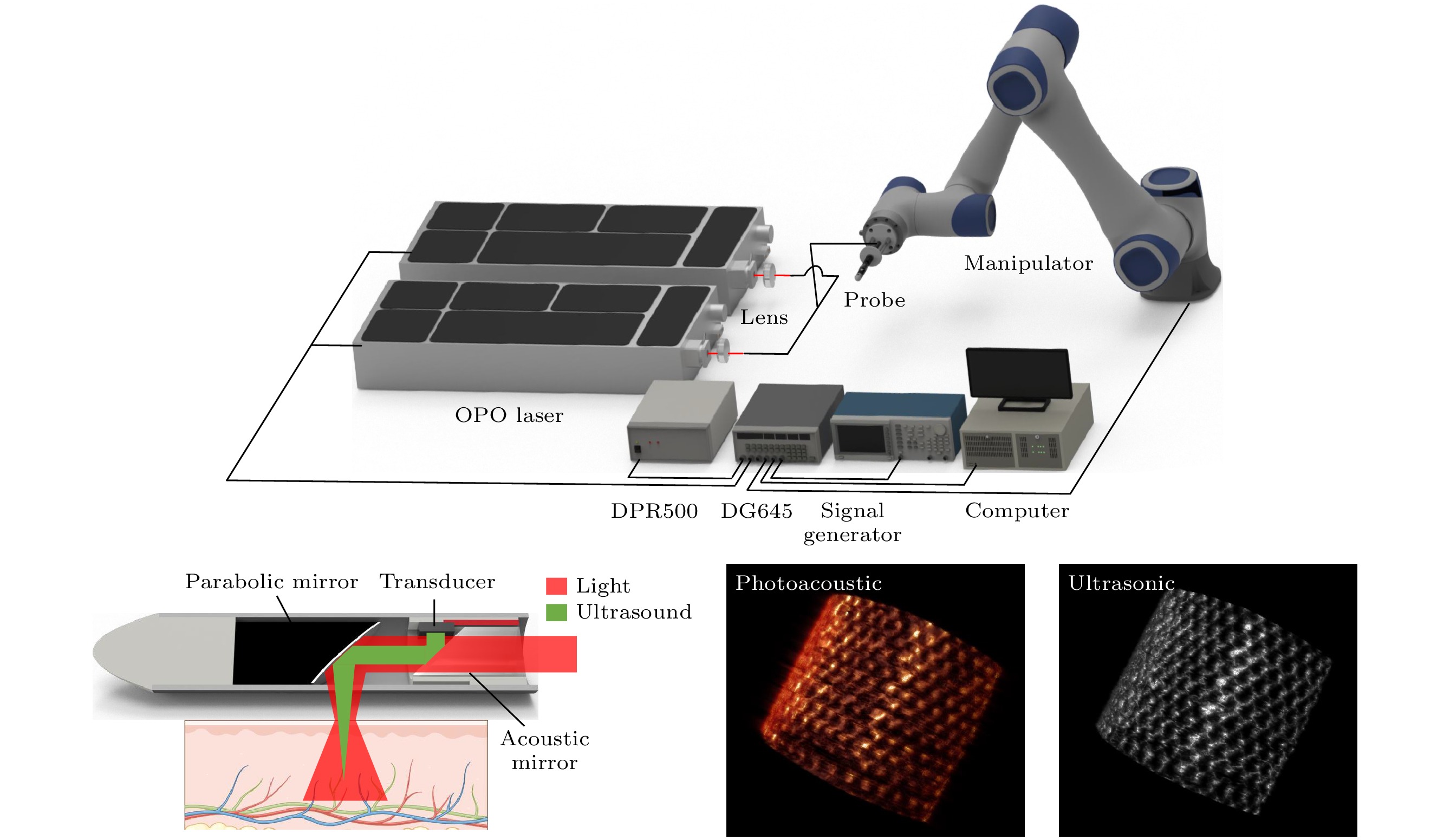
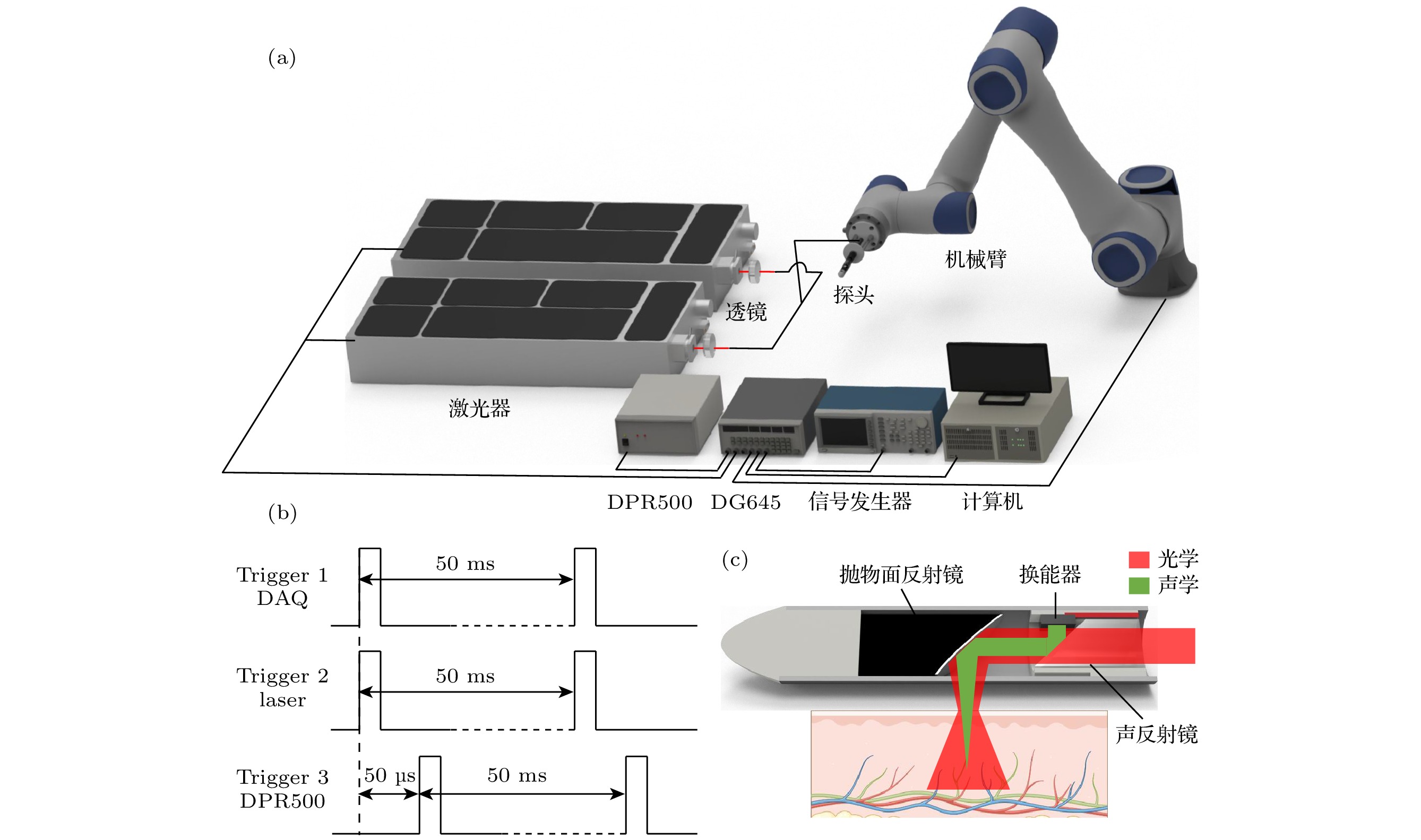
该探头总体系统结构如图1(a)所示. 其由重复频率为20 Hz的OPO脉冲激光器(SpitLight OPO 600, InnoLas, München, Germany)作为光源, 通过聚焦透镜耦合进入多模光纤束, 然后引导进入探头进行照明. 信号发生器给出20 Hz脉冲信号, 该信号同步触发OPO激光器和采集卡(PCI-5124, National Instruments Corporation, TX, USA), 进行出光以及启动信号采集, 采样频率为100 MHz. 同时该脉冲信号通过数字延迟/脉冲发生器(DG645, Stanford Research Systems, CA, USA)进行50 μs延时处理, 随后触发脉冲发生/接收器(DPR500, Imaginant, NY, USA)产生超声信号. 通过控制OPO激光器与DPR500之间的 延时, 以实现光声/超声的同时采集, 其采集时序如图1(b)所示[19]. 该探头采用机械臂进行灵活的平移扫描, 旋转扫描则由机械臂负载端进行驱动 控制.
探头内部结构如图1(c)所示. 其总体直径为8 mm, 多模光纤束通过3D打印模块固定在探头后端. 该3D打印模块还镶嵌一个45°平面石英反射镜, 和前端的铝制离轴抛物面反射镜共同构成了探头的声学耦合结构. 多模光纤束发出的激光首先透过声反射镜, 随后被抛物面镜反射到待测物上, 产生的光声信号经过抛物面镜聚焦收集, 再次通过声反射镜反射, 最终被探头侧面的微型超声换能器接收. 该换能器尺寸为3 mm, 中心频率为20 MHz. 为了确保声波的有效传递和避免空气间隙的影响, 探头内部使用水进行充分填充, 从而提供了一个均匀且稳定的声学环境.
-
通过分辨率测试实验、复杂物体的三维扫描实验, 以及光声泵浦成像实验, 对该内窥探头的性能进行了验证. 在实验过程中, 对复杂物体的三维扫描实验进行了细致的处理, 将待测样本固定在含有2%琼脂的仿体, 并完全浸没于水中, 以确保扫描的稳定性和准确性. 对于其他实验, 样本则是直接固定在水中. 在图像重建方面, 采用改进型反投影算法(improved back-projection, IBP), 能够在不同深度上实现动态聚焦[19], 从而提高图像的分辨率.
在分辨率测试实验中, 采用直径为50 μm的钨丝作为测试用的点目标, 这一尺寸远小于理论分辨率的极限. 通过在不同的成像深度上进行扫描, 得到对应的清晰光声/超声图像结果, 用于评估系统的横向分辨率性能. 光声扫描时, 使用外接的多模光纤束引导760 nm激光照射钨丝, 并保持钨丝与光纤的相对位置不变以实现稳定照明. 整个旋转扫描共50步, 覆盖角度为45°, 信号经过10次平均.
复杂物体的三维光声/超声扫描实验中选择金属网作为目标, 以评估成像系统对高对比度结构的解析能力. 实验使用的金属网直径约为400 μm, 将其卷成约30 mm粗的桶状, 其单个网格的大小为3 mm×6 mm. 采用柱形扫描方式, 竖直方向上总共扫描180层(共36 mm), 每一层扫描200步(单步角度为0.9°). 在该实验中信号仅平均一次, 总扫描时间约60 min. 单层的光声和超声数据首先重建为二维图像, 随后叠加为三维图像.
该探头可以与光声泵浦技术相结合实现高特异性的分子成像. 本文采用亚甲基蓝(methylene blue, MB)作为造影剂, 其被波长为660 nm泵浦激光激发后, 会经系间窜越进入具有长磷光寿命的三重态(T1), 该态寿命可达79 μs. T1态的MB分子对820 nm的探测光有较强的吸收, 从而产生光声信号. 利用瞬态三重态差分(transient triplet differential, TTD)检测方法[20], 可以去除组织中由于泵浦光和探测光引起的血液等成分产生的强背景光声信号, 特异性地检测到处于T1态的MB. 其信号可以通过如下公式计算:
其中Spump-probe为泵浦光和探测光同时开启时产生的光声信号; Spump和Sprobe分别为仅泵浦光和仅探测光开启时产生的光声信号;
$ \tau $ 为泵浦光和探测光之间的延时时间. 值得注意的是, MB的T1态的长磷光寿命对于光声泵浦成像至关重要, 因为在MB被泵浦光激发后, 需要在探测光到达时仍处于T1态上, 从而保证具有较高的探测灵敏度.为验证该探头光声泵浦成像的能力, 对其进行了仿体成像实验和活体成像实验. 其中, 仿体实验采用两根直径为3 mm的塑料管, 其中一根装有12%浓度的牛血红蛋白, 另一根装有200 μmol的MB, 通过光声泵浦实验验证对MB的特异性成像效果. 活体动物实验采用BALB/c裸鼠, 在其腿部种植HCT116直肠癌肿瘤. 肿瘤直径约1 cm, 成像前在肿瘤内注射0.3 mL浓度为400 μmol的MB溶液, 等待约30 min, MB在肿瘤内扩散均匀后进行光声泵浦成像. 泵浦光和探测光在目标表面的能量密度分别7 mJ/cm2和9 mJ/cm2, 扫描范围为81°, 步长为0.9°, 信号平均200次.
-
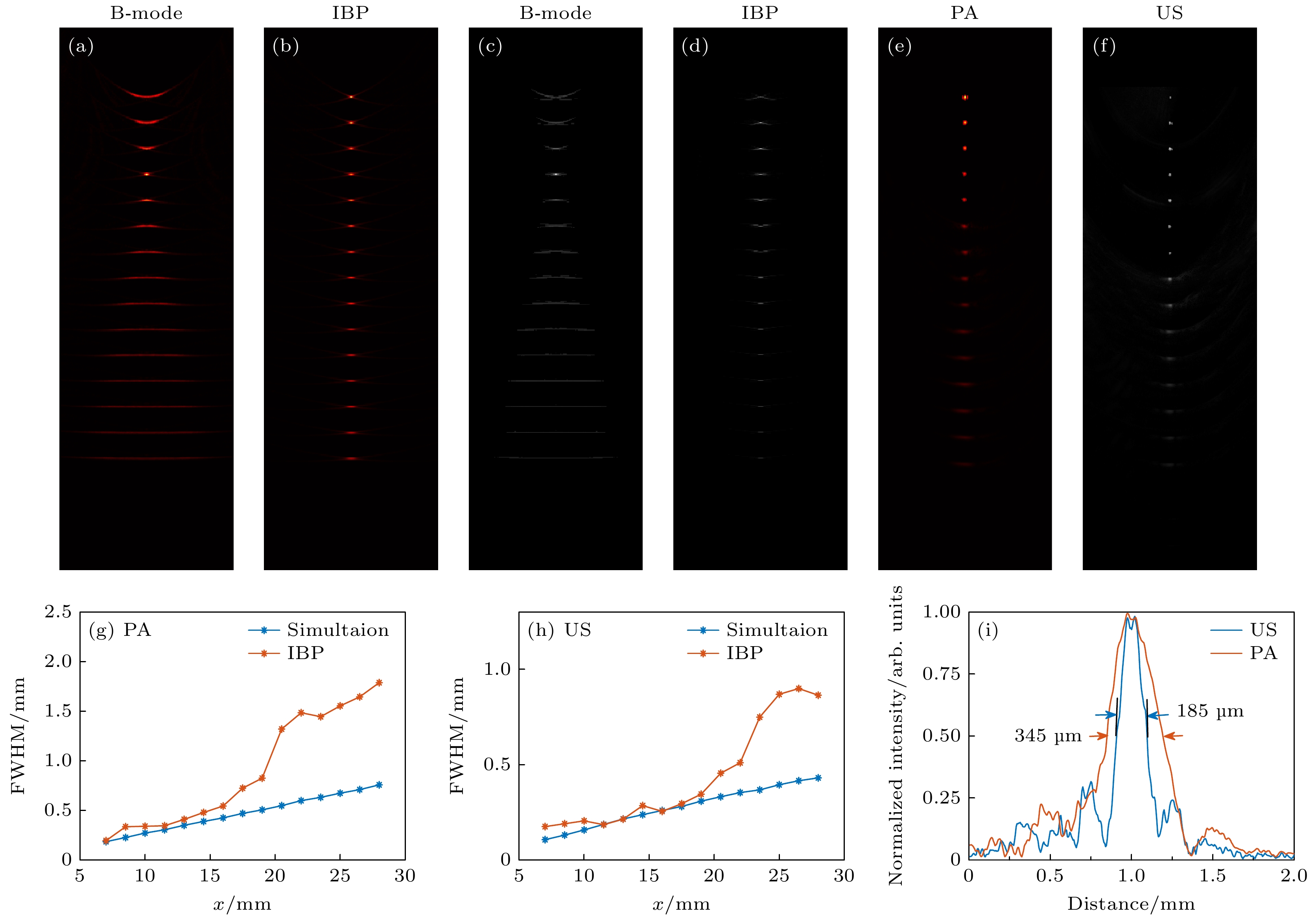
图2(a)—(d)分别展示了以探头轴心为参照原点, 模拟在不同深度的点目标图像. 这些图像是通过使用传统B-mode算法和IBP算法重建得到的光声和超声图像. 对比这些图像, 可以观察到采用IBP算法重建的点目标在成像效果上明显优于传统B-mode算法. 图2(e)和图2(f)分别展示了使用IBP算法对直径为50 μm的钨丝进行重建后的光声和超声图像. 在对原始光声信号滤波后, 得到的中心频率为19.4 MHz和–6 dB带宽为14.26—24.54 MHz的信号, 对应的横向分辨率约为0.12 mm. 本文提取了每个位置图像的横向轮廓, 并测量了其半峰全宽(full width at half maxima, FWHM)作为横向分辨率, 如图2(g)和图2(h)所示, 在7—20 mm的深度范围内, 实际测量结果与仿真模拟之间具有较高的一致性. 而在超过20 mm深度的实验中, 观察到两者之间存在较大偏差, 这一现象是由于实验中使用的探头声场无法简化为理论上的聚焦声场模型, 导致实验数据相较于仿真模拟表现出一定的偏差. 使用钨丝的测试数据, 通过IBP算法重建后, 其横向分辨率随着深度的增加而增加, 同时强度降低, 其在12 mm处的光声和超声横向轮廓信号分布, 如图2(i)所示. 其在该处的光声和超声横向分辨率分别达到345 μm和185 μm. 这些结果表明, 该探头具有厘米级别的成像景深, 在不同成像深度上都能实现良好的聚焦, 实现高分辨的光声和超声成像效果. 这些结果表明了探头具有高分辨双模态成像能力.
-
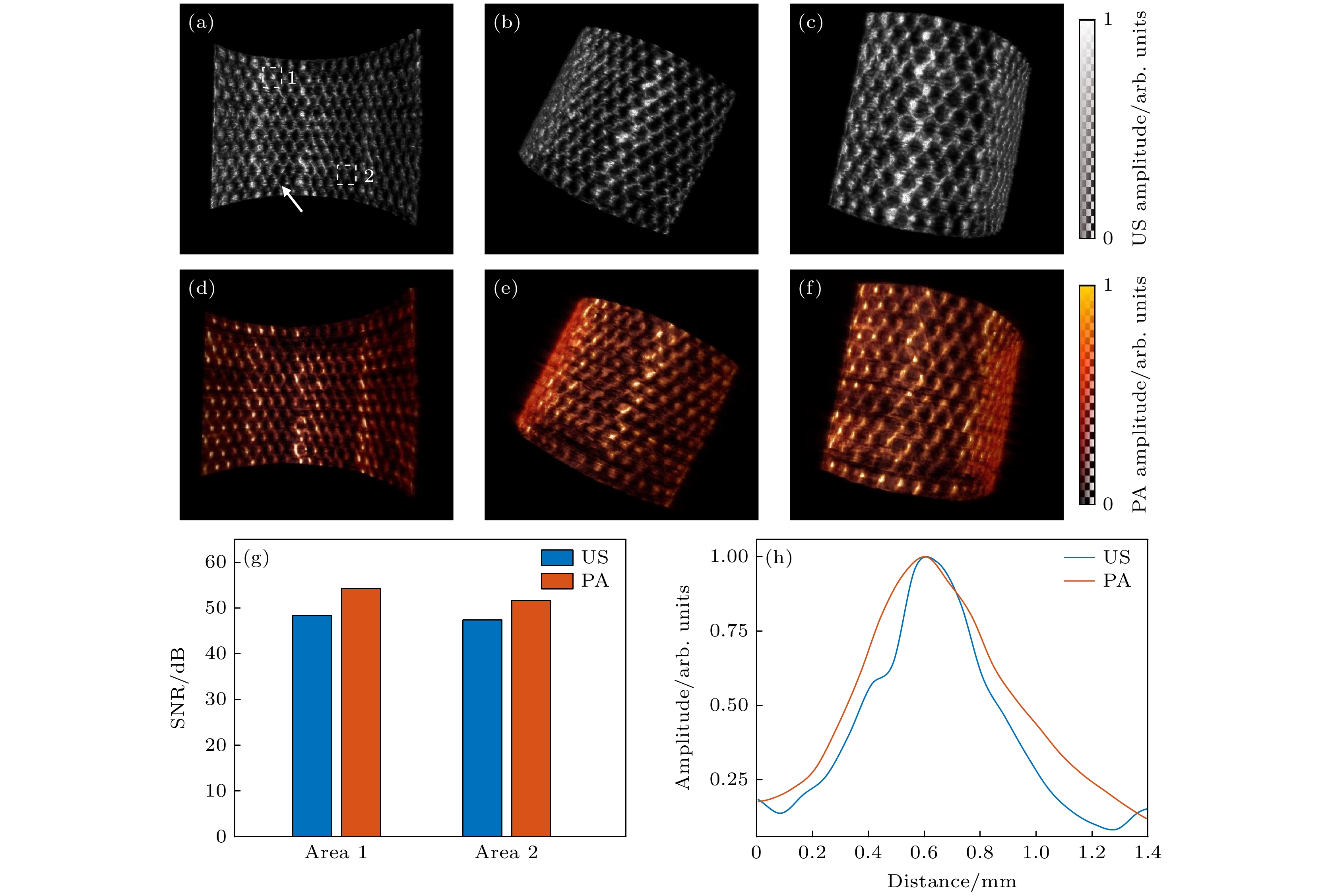
图3(a)—(f)显示了重建后的金属网三维超声和光声图像. 金属网距离旋转中心约15 mm, 其光声和超声图像中的网格细节均十分清晰. 为更好地评估该探头的结构成像能力, 选择了两个任意区域(如图3(a)中白色方框所示), 计算了这两个区域的峰值信噪比(peak signal-to-noise ratio, PSNR), 如图3(g)所示. 结果表明, 在单次平均条件下, 该探头光声图像的PSNR能够达到51.5 dB, 超声图像的PSNR也达到47.3 dB. 此外, 本文中还提取并分析了图像中单根金属丝横向轮廓的信号(如图3(a)中白色箭头标示), 相关结果如图3(h)所示. 光声图像中其横向轮廓为571 μm, 超声图像的横向轮廓为484 μm, 与金属丝的实际直径400 μm较为接近. 以上研究结果表明了探头具有高空间分辨率和大成像深度的特点, 具备对复杂物体成像的能力.
-
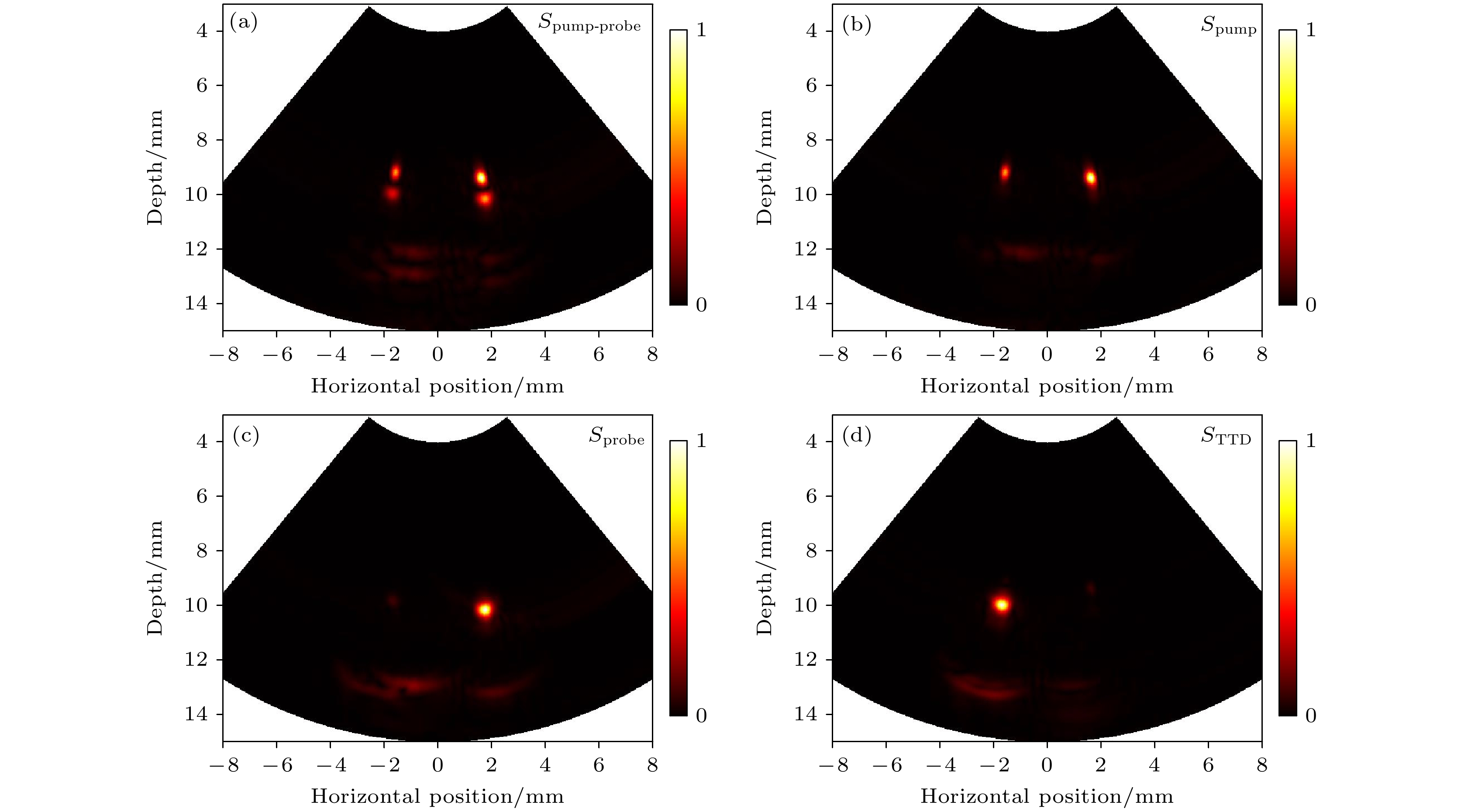
光声泵浦仿体成像实验结果如图4所示. 其中, 图4(a)为泵浦光和探测光都存在时的成像结果. 由于泵浦光和探测光在不同时间上激发, 间隔为0.25 μs, 所以管壁有上下的重影. 左侧管子内为MB溶液, 右侧管子则使用牛血红蛋白溶液作为对照. 由于MB和牛血红蛋白在660 nm的泵浦光下都有较强的光吸收, 所以两根管子都能在图4(b)中被观察到. 然而, 在图4(c)中仅能观察到牛血红蛋白管子, 这是由于在820 nm处, MB的光吸收系数相对于牛血红蛋白较弱, 导致其信号较弱. 经过TTD处理后, 泵浦光和探测光的背景信号被消除, 只保留了T1态的MB分子的光声信号, 因此只有MB管子被观察到, 如图4(d)所示. 上述实验结果表明, 该探头可以利用光声泵浦方法对MB目标分子进行高特异性的成像.
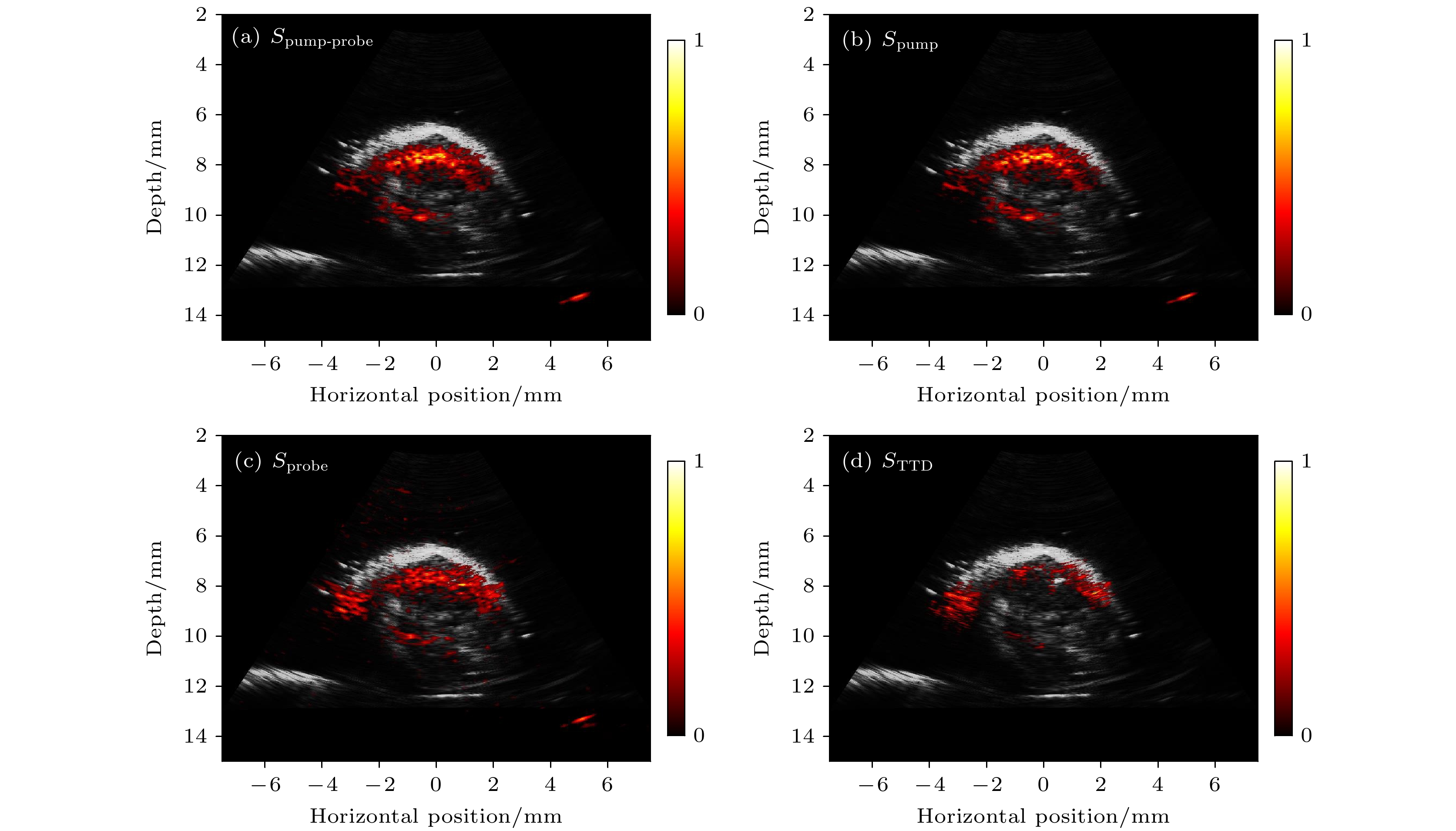
图5为小鼠腿部肿瘤的光声泵浦成像结果. 从图5(b)和图5(c)可观察到, 由于在Spump和Sprobe图像中血液信号和MB信号混合在一起难以区分. 而对其进行TTD处理后, 只剩下MB的信号, 从而观察到肿瘤内部MB的分布, 如图5(d)所示. 上述实验结果表明, 该探头可以结合光声泵浦成像技术, 有效地抑制血液等强背景信号, 在深层组织内实现高特异性的分子成像.
-
光声成像是一种重要的光学分子影像技术, 其在基础生命科学和临床前研究中至关重要. 与纯光学成像方式相比, 光声成像可以通过将脉冲激光转换成受组织散射影响较小的超声, 从而打破光学衍射极限的限制, 实现对深层组织的高分辨率分子成像. 然而, 现有的面向深层组织的光声分子影像技术大多采用体外扫描的方式, 其探测深度仍受到激光穿透深度的限制, 而对于内窥式的大深度光声分子影像技术的研究仍然很少. 另一方面, 光声内镜的设计因其需要同时考虑光学激发和超声耦合, 相较于单一的光学或超声内镜, 其结构设计更为复杂. 因此, 虽然光声内窥成像经过十几年的发展, 其在探头尺寸、扫描速度和图像分辨率等方面有了长足的进步, 但是现有的光声内镜研究主要集中在光聚焦光声内镜方向, 在穿透深度、多模态集成、多光谱成像及分子影像能力等方面仍有较大不足.
为此, 本文开发了一款单阵元的声聚焦光声内窥探头. 该探头采用可调谐OPO激光器作为激发光源, 通过机械臂进行扫描控制. 由于该探头采用声聚焦方式, 其具有厘米级的大成像深度, 以及多光谱分子成像的能力. 与典型的阵列式内窥探头(直径约2.5 cm)相比, 本文提出的基于单阵元的声聚焦光声内窥探头实现了小型化, 其直径仅为8 mm, 更适合于小动物消化道等器官的成像应用. 此外, 该探头还结合了超声成像模态, 为目标组 织的定位提供了有价值的解剖学信息. 该探头采用中心频率为20 MHz的微型超声换能器, 使用动态聚焦算法进行成像. 结果表明, 其在距离探头外表12 mm的处可实现约345 μm/185 μm的光声/超声横向分辨率. 三维金属网成像结果表明, 其可以在较大的景深范围内对复杂结构的物体进行高分辨的光声和超声双模态成像. 另外, 常规的光声成像通常受到血液背景的强干扰, 无法有效地对组织中微弱的目标分子进行成像. 而本文所提出的探头通过与泵浦探测技术相结合, 展现出深层组织高特异性分子成像的能力, 有望为结直肠癌等相关疾病的诊断提供重要的分子影像依据.
然而, 本文提出的小型化手持式光声/超声双模态内窥探头仍然存在一些局限, 需在后续的研究中加以改进. 首先, 该探头的总体尺寸受限于直径为6.25 mm的抛物面反射镜, 通过定制更小的反射镜, 有望进一步实现探头的尺寸缩减. 其次, 该探头的光声泵浦功能依赖于信号的多次平均, 这在一定程度上限制了成像速度. 为了克服这一问题, 需要发展相关的激光脉冲能量校正技术, 并结合基于深度学习的降噪算法, 以期大幅提高成像速度. 此外, 在本文中活体成像的应用仅限于体外肿瘤成像测试, 在后续研究应拓展至小动物直肠内窥成像, 以验证探头在体内环境中的性能和应用潜力. 最后, 为了增强探头的功能性, 可以考虑在探头前端集成小型CMOS传感器, 实现前视场的光学成像. 在使用该探头时, 能够首先通过光学宽场成像技术快速识别浅表组织中的微小形态学或光谱异常区域. 随后, 再利用光声和超声扫描技术深入探索这些区域, 以便精确揭示深层组织中的病变情况.
-
本文提出了一种新型的小型化手持式声聚焦光声/超声双模态内窥探头. 该探头直径为8 mm, 在12 mm处的光声/超声横向分辨率分别达到345 μm/185 μm, 从而对深层组织下的复杂目标进行高分辨的成像. 该探头还可以利用泵浦探测技术, 有效地排除血液吸收背景的干扰, 实现深层组织内目标分子的高特异性成像. 这些特性使其在消化道等器官的内窥成像中具有广泛的潜在应用前景, 特别是在小动物实验和临床前研究中具有重要的应用价值.
用于深层组织分子成像的小型化光声/超声内窥成像探头
Miniaturized photoacoustic/ultrasound endoscopic imaging probe for molecular imaging of deep tissues
-
摘要: 结直肠癌是全球癌症死亡的主要原因之一, 常用的光学或超声消化道内镜仍然存在穿透深度低、对比度差、功能/分子成像能力不足等问题. 本文介绍了一种小型化的手持式光声/超声双模态内窥探头, 旨在克服现有技术在穿透深度和分子成像能力方面的限制. 实验结果表明, 该探头在组织12 mm深度下分别达到了345 μm的光声横向分辨率和185 μm的超声横向分辨率, 并具有良好的对复杂结构目标成像的能力. 本文还利用泵浦探测技术排除了血液背景的干扰, 实现了肿瘤深层组织内亚甲基蓝分子的高特异性成像. 这种小型化手持式光声/超声双模态内窥探头兼具大成像深度、高空间分辨和高特异性分子成像的特点, 有望成为结直肠癌等消化道肿瘤诊断的重要工具, 为早期诊断和治疗监测提供强有力的支持.Abstract: Colorectal cancer is one of the leading causes of cancer-related deaths worldwide. Traditional gastrointestinal endoscopes for colorectal cancer mainly rely on optical endoscope and ultrasound endoscope. Owing to significant light scattering in tissues the optical endoscope is limited to superficial tissue imaging, while the ultrasound endoscope, despite deeper penetration, provides limited molecular imaging capabilities. In this work, we build a miniaturized handheld photoacoustic/ultrasound dual-modality endoscopic probe to address these problems. It has a small size of 8 mm, and presents the dual advantages of high penetration depth and superior molecular imaging capability, marking a significant advancement over traditional methods. Results show that this probe achieves a high lateral resolution of 345 μm for photoacoustic imaging and 185 μm for ultrasound imaging at a depth of 12 mm within tissues. It also exhibits the ability to effectively image complex structural targets, as demonstrated by the imaging of a phantom with an embedded metal mesh. Furthermore, the probe adopts an innovative pump-probe method, which effectively mitigates interference from blood and other background tissues, thereby achieving high-specificity photoacoustic molecular imaging. This ability is first confirmed by imaging the distribution of methylene blue (MB) in a phantom, and then by observing the distribution of MB in the depth of tumor in mice. This handheld photoacoustic/ultrasound endoscopic probe has the advantages of small size, high penetration depth, high spatial resolution, and superior molecular imaging ability, and is expected to become an important diagnostic tool for colorectal cancer and other gastrointestinal cancer. This study can provide strong support for early diagnosis and treatment monitoring, potentially revolutionizing the detection and management of these diseases.
-
Key words:
- photoacoustic endoscopy /
- multimode imaging /
- pump-probe /
- molecular imaging .
-

-
图 2 光声/超声分辨率测试实验结果 (a)—(d) 传统B-mode重建算法和IBP重建算法仿真结果对比; (e)—(f) 不同深度下点目标重建的光声/超声图像; (g) 从图(b), (e)中提取的光声模态下不同深度的FWHM; (h) 从图(d), (f)中提取的超声模态下不同深度的FWHM; (i) 在12 mm处获得的光声/超声横向轮廓及其横向分辨率
Figure 2. Field test experimental result: (a)–(d) Simulation comparison of traditional B-mode and IBP reconstruction algorithms; (e)–(f) the photoacoustic/ultrasound images of different depth of the point target; (g) FWHM in photoacoustic at different depth obtained from panel (b), (e); (h) FWHM in ultrasound at different depth obtained from panel (d), (f); (i) photoacoustic/ultrasound lateral profiles of the point target obtained at 12 mm.
图 3 金属网格三维光声/超声成像实验结果 (a)—(c) 不同视角下金属网格的光声图像; (d)—(f) 相应的超声图像; (g) 不同区域的光声/超声图像的PSNR; (h) 在光声/超声图像中提取的金属丝轮廓信号的横向分布
Figure 3. Experimental results of 3D photoacoustic/ultrasound imaging of a metal grid: (a)–(c) Photoacoustic images of metal grid from different perspectives; (d)–(f) corresponding ultrasound images of the same areas as in panel (a)–(c); (g) PSNR comparison of photoacoustic and ultrasound images in different regions; (h) contours of metal grid extracted from the photoacoustic/ultrasound images.
图 4 光声泵浦仿体成像实验结果 (a)—(d) 分别为Spump-probe, Spump, Sprobe, STTD重建的光声图像, 其中左侧管内为MB溶液, 右侧为牛血红蛋白溶液
Figure 4. Pump-probe photoacoustic imaging of phantom: (a)–(d) Reconstructed images of Spump-probe, Spump, Sprobe, and STTD. In the setup, the left tube contains methylene blue solution, while the right contains bovine hemoglobin solution.
-
[1] Bray F, Laversanne M, Sung H, Ferlay J, Siegel R L, Soerjomataram I, Jemal A 2024 CA-Cancer J. Clin. 74 229263 doi: 10.3322/caac.21834 [2] Gora M J, Suter M J, Tearney G J, Li X 2017 Biomed. Opt. Express 8 2405 doi: 10.1364/BOE.8.002405 [3] Rex D K, Boland C R, Dominitz J A, Giardiello F M, Johnson D A, Kaltenbach T, Levin T R, Lieberman D, Robertson D J 2017 Am. J. Gastroenterol. 112 10161030 doi: 10.1038/ajg.2017.174 [4] Gora M J, Simmons L H, Quénéhervé L, Grant C N, Carruth R W, Lu W, Tiernan A, Dong J, Walker-Corkery B, Soomro A, Rosenberg M, Metlay J P, Tearney G J 2016 J. Biomed. Opt. 21 104001 doi: 10.1117/1.JBO.21.10.104001 [5] Pahlevaninezhad H, Khorasaninejad M, Huang Y W, Shi Z, Hariri L P, Adams D C, Ding V, Zhu A, Qiu C W, Capasso F, Suter M J 2018 Nat. Photonics 12 540547 doi: 10.1038/s41566-018-0224-2 [6] Krill T, Baliss M, Roark R, Sydor M, Samuel R, Zaibaq J, Guturu P, Parupudi S 2019 J. Thorac. Dis. 11 16021609 doi: 10.21037/jtd.2019.06.50 [7] Wang X, Seetohul V, Chen R, Zhang Z, Qian M, Shi Z, Yang G, Mu P, Wang C, Huang Z, Zhou Q, Zheng H, Cochran S, Qiu W 2017 IEEE Trans. Med. Imaging 36 19221929 doi: 10.1109/TMI.2017.2699973 [8] Lin L, Wang L V 2022 Nat. Rev. Clin. Oncol. 19 365384 doi: 10.1038/s41571-022-00615-3 [9] Attia A B E, Balasundaram G, Moothanchery M, Dinish U S, Bi R, Ntziachristos V, Olivo M 2019 Photoacoustics 16 100144 doi: 10.1016/j.pacs.2019.100144 [10] Li Y, Lu G X, Zhou Q F, Chen Z P 2021 Photonics 8 281 doi: 10.3390/photonics8070281 [11] Wang L V, Hu S 2012 Science 335 14581462 doi: 10.1126/science.1216210 [12] Guo H, Li Y, Qi W, Xi L 2020 J. Biophotonics 13 e202000217 doi: 10.1002/jbio.202000217 [13] Xia J, Yao J, Wang L V 2014 Progr. Electromagnet. Res. 147 122 doi: 10.2528/PIER14032303 [14] Yang J M, Favazza C, Chen R, Yao J, Cai X, Maslov K, Zhou Q, Shung K K, Wang L V 2012 Nat. Med. 18 12971302 doi: 10.1038/nm.2823 [15] Leng X, Chapman W, Rao B, Nandy S, Chen R, Rais R, Gonzalez I, Zhou Q, Chatterjee D, Mutch M, Zhu Q 2018 Biomed. Opt. Express 9 51595172 doi: 10.1364/boe.9.005159 [16] Vu T, Razansky D, Yao J 2019 J. Opt. 21 103001 doi: 10.1088/2040-8986/ab3b1a [17] Wang L V 2009 Nat. Photonics 3 503509 doi: 10.1038/nphoton.2009.157 [18] He H, Wissmeyer G, Ovsepian S V., Buehler A, Ntziachristos V 2016 Opt. Lett. 41 27082710 doi: 10.1364/ol.41.002708 [19] Xiao J, Jiang J, Zhang J, Wang Y, Wang B 2022 Opt. Express 30 35014 doi: 10.1364/OE.469550 [20] Tan J W Y, Lee C H, Kopelman R, Wang X 2018 Sci. Rep. 8 9290 doi: 10.1038/s41598-018-27578-9 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: