-
色胺类新精神活性物质是一类含有色胺结构的化合物,可致幻[1],其主要通过影响人体中的5-羟色胺受体,对5-羟色胺神经递质的功能产生作用,进而引起感知、情绪和意识状态的变化[2-4],主要用于改善情绪、调节情绪波动、减轻抑郁和焦虑等症状的治疗[5]。然而,滥用色胺类新精神活性物质的情况愈发严重,由其产生的一系列社会问题也越来越多[6]。因此,研究色胺类新精神活性物质的作用机制、生理效应、行为表现以及代谢毒性等具有重要意义。
4-羟基-N-甲基-N-异丙基色胺(4-HO-MiPT)的结构示于图1。目前,尚未见4-HO-MiPT毒性效应的报道,但已有关于色胺类新精神活性物质的大量研究。黑海等[7]研究了色胺类新精神活性物质的结构、毒性、成瘾特性、滥用情况以及检验方法。李楠等[8]采用“上下增减剂量法”详细研究了5-甲氧基-2-甲基色胺(5-methoxy-alpha-methyltryptamine,5-MEO-AMT)的毒性,发现其与甲基苯丙胺类似,均能诱发强烈的精神活性作用。赵森等[9]以斑马鱼为模式生物进行自发活动行为测试及镜像反射行为模型,分析5-甲氧基-N-甲基-N-异丙基色胺(5-MeO-MiPT)对斑马鱼的毒性效应,发现斑马鱼先天的群集性发生改变,出现焦虑、思维紊乱等症状,表明药浴5-MeO-MiPT对斑马鱼的行为活动有较明显的抑制作用。
代谢组学法着重研究生物整体、器官或组织的内源性代谢物质的代谢途径及其所受内外在因素的影响和随时间变化的规律[10-11]。随着代谢组学技术的快速发展,基于代谢组学的研究方法已广泛用于不同生物体内代谢物的定性及定量分析[12]。
本工作拟采用代谢组学法研究4-HO-MiPT在斑马鱼体内的代谢产物,以斑马鱼为模式生物,建立行为学评价模型,通过观察行为运动的变化来反映模式生物内在的症状。同时,通过代谢产物差异探索斑马鱼行为变化的内在因素,以期从代谢角度解释4-HO-MiPT的毒性机理。
-
Scientific Dionex Ultimate 3000超高效液相色谱-四极杆/静电场轨道阱高分辨质谱联用仪、SCILOGEX D3024R离心机、Lab Tower纯水制备系统:美国Thermo Fisher Scientific公司产品;斑马鱼独立养殖单元、成鱼观测箱、梯形水箱:中国杭州纽蓝科技有限公司产品;Multi Reax全能型振荡器:德国Heidolph公司产品;JXFSTPRP-CL全自动样品冷冻研磨仪:中国上海净信实业发展有限公司产品;Etho Vision XT 14分析系统:荷兰 Noldus Information Technology公司产品;IV007视频侦查系统:中国浙江捷尚视觉科技股份有限公司产品;BIO-RAD CFX Connect Real-Time System 荧光定量PCR仪:美国bio-rad公司产品;普通 PCR仪、scandrop100超微量核酸蛋白测定仪:德国耶拿分析仪器公司产品。
移液器、低位白色PCR反应管、光学封膜:美国bio-rad公司产品;25 µL微量注射器:上海高鸽工贸有限公司产品;200 µL无RNA酶PCR反应管:美国AXGEN公司产品;移液枪枪头、1.5 mL无RNA酶EP管:美国Thermo Fisher Scientific公司产品。
-
4-HO-MiPT标准品:美国Cerilliant公司产品;甲醇、乙腈:美国Sigma-aldrich公司产品;3月龄斑马鱼(W/AB品系,雌雄比1∶1):由武汉国家斑马鱼资源中心提供;超纯水:中国杭州泽南科技有限公司产品;反转录试剂盒:北京艾德莱生物科技有限公司产品;2×SYBR® Green 预混液:美国 Thermo Fisher Scientific公司产品。
-
色谱柱:ACQUITY UPLC® HSS T3柱(2.1 mm×150 mm×1.8 µm);流动相:A为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液;柱温40 ℃;流速0.3 mL/min;进样量5 µL;梯度洗脱:1~3 min(99%A),3~5 min(99%~1%A),5~6 min(1%~99%A),6~7 min(99%A)。
-
电喷雾离子源(ESI),正、负离子检测模式;毛细管温度300 ℃;喷射电压3 000 V。采用Full MS-ddMS2模式采集数据,一级质谱分辨率35 000,动态增益控制目标1×106,质量扫描范围m/z 70~1 000;二级质谱分辨率17 500,动态增益控制目标2×105,质量筛选窗口m/z 1.5,碰撞能量17.5、35、52.5 eV[13]。
-
选取64条状态良好的3月龄斑马鱼,分为空白组和药物注射组,每组32条,进行成鱼代谢组学实验。采取腹腔注射法以角度30~45°注射腹鳍基部,深度以刚好没过针头为宜,其中空白组每条斑马鱼每3天注射10 µL超纯水,药物注射组每条斑马鱼每3天注射10 µL 10 mg/L 4-HO-MiPT。各组共注射10次,然后处死斑马鱼,解剖出其脑部,每4个斑马鱼脑置于1个研磨管,向每个研磨管中加入3颗研磨珠(直径3.5 mm)与1.5 mL乙腈,随后将研磨管放入全自动样品冷冻研磨仪中进行研磨,设置参数为:运行时间40 s,中断时间20 s,研磨10次,频率65 Hz,温度−50 ℃。研磨完毕后取出研磨管,冰水浴超声10 min,以12 000 r/min离心10 min。离心完毕后,取上清液于内插管,每个样品取5 µL混合于同一进样瓶内,制成质量控制样本QC,将样品和QC组进行UHPLC-Q/Orbitrap HRMS分析检测。QC进样规则:在整个注射过程中,每注射4次后对QC进行分析,以确保系统的稳定性和性能。在正、负离子模式下对QC样品结果的评估在±2SD范围内,表明建立的斑马鱼中毒模型数据符合稳定性要求。
-
选取40条状态良好的3月龄斑马鱼,分为空白组和药物注射组,每组20条,进行成鱼行为学实验。按照1.4节方法进行注射,空白组每条斑马鱼注射10 µL超纯水,药物注射组每条斑马鱼注射10 µL 10 µg/mL 4-HO-MiPT,30 min后分别将其放入矩形成鱼观察箱中,用成鱼观察箱顶端与侧面摄像头实时记录其5 min内的行为运动情况[14]。空白组与药物注射组均用IV007视频侦查系统和EthoVision XT14分析系统进行成鱼行为数据记录与处理。
-
选取18条状态良好的3月龄斑马鱼,分为空白组和药物注射组,每组9条,进行脑组织转录组分析。与代谢组学实验同时进行前期注射处理,处理完毕后处死,并解剖出脑部,每3个生物检材置于1个研磨管,向每个研磨管中加入300 µL裂解液与2颗研磨珠(直径3.5 mm),随后将研磨管放入全自动样品冷冻研磨仪中进行研磨,设置参数为:运行时间1 s,中断时间3 s,研磨次数60次,频率50 Hz,温度4 ℃。研磨完毕后,加入300 µL裂解液,3 min后,以12 000 r/min离心5 min,取上清液,加入同等体积75%乙醇,过柱后洗脱,提取RNA,使用超微量核酸蛋白测定仪检测RNA的OD值,采用A260/A280比值。根据RNA进行反转录,采用反转录试剂盒进行反转录操作,使用20 μL反应体系,反转录反应条件为:45 ℃、40 min,65 ℃、10 min,反应结束得到cDNA。得到cDNA后配置PCR扩增体系,采用的引物序列列于表1,最后得到了对应基因转录水平(mRNA)的变化数据。
-
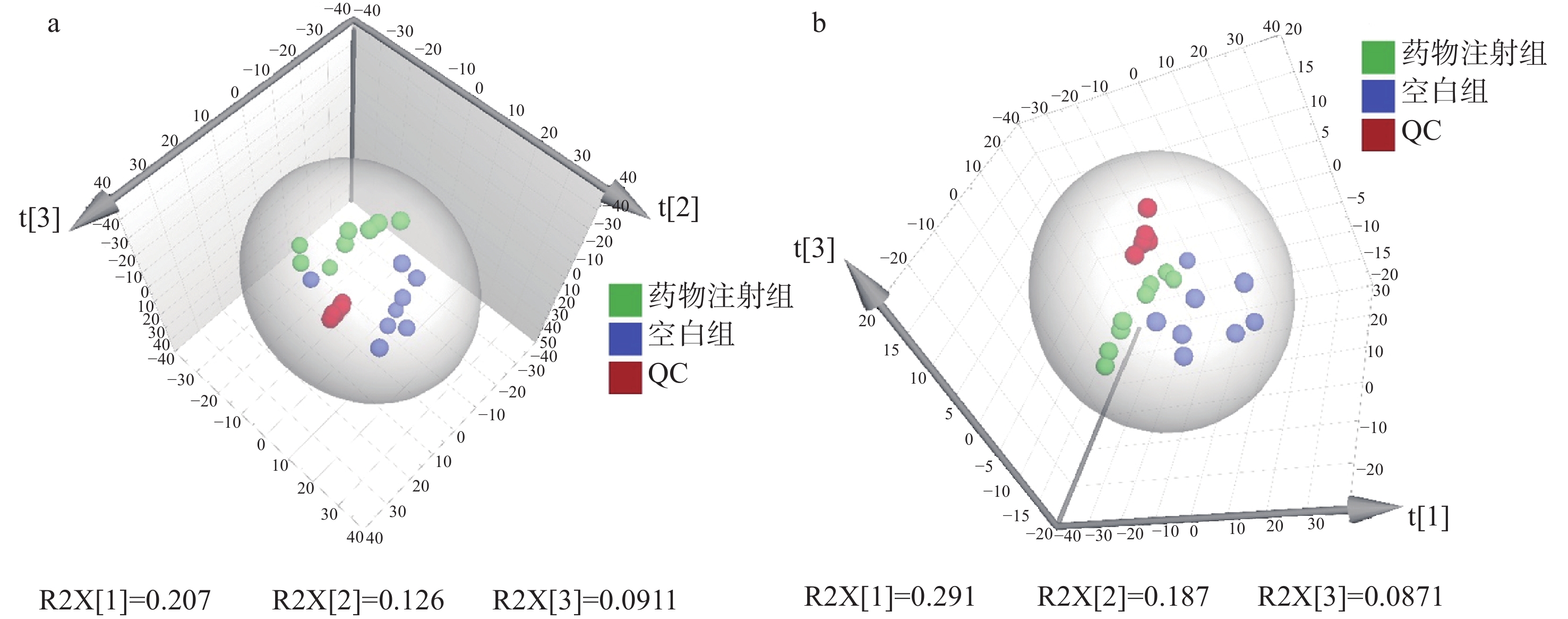
将QC样本导入SIMCA-P14.1软件中进行主成分分析(PCA)[15],结果表明,在正、负离子模式下对QC样本的差异峰面积重复率均在2倍标准差范围内,表明实验方法和仪器具有足够的稳定性。对实验组样本进行PCA分析的结果示于图2。在UHPLC-Q/Orbitrap HRMS正、负离子模式下分别检测出922、357种代谢物,将研究结果导入到CD软件中预处理,经PCA分析后,空白组与药物注射组的数据完全分离,表明注射4-HO-MiPT对斑马鱼代谢产生了明显影响。
-
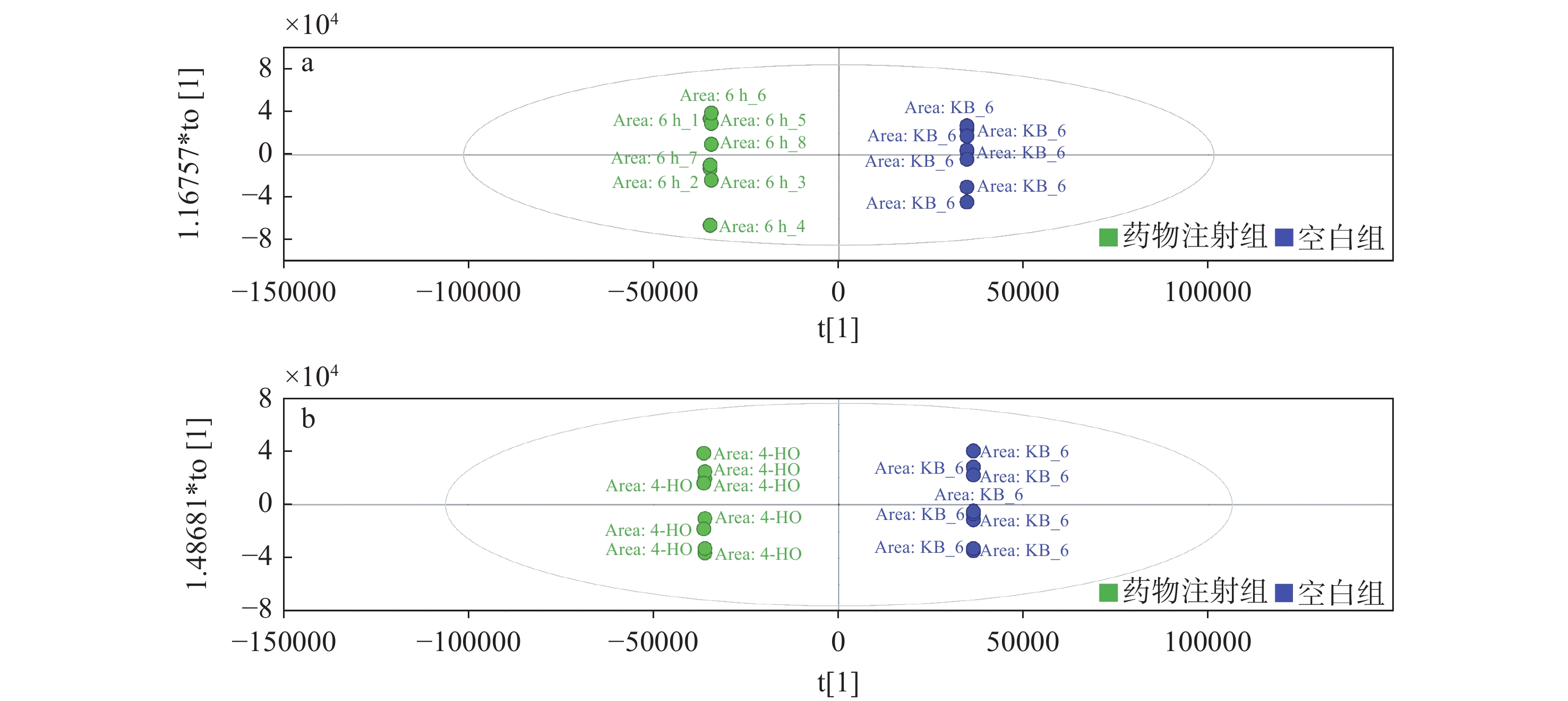
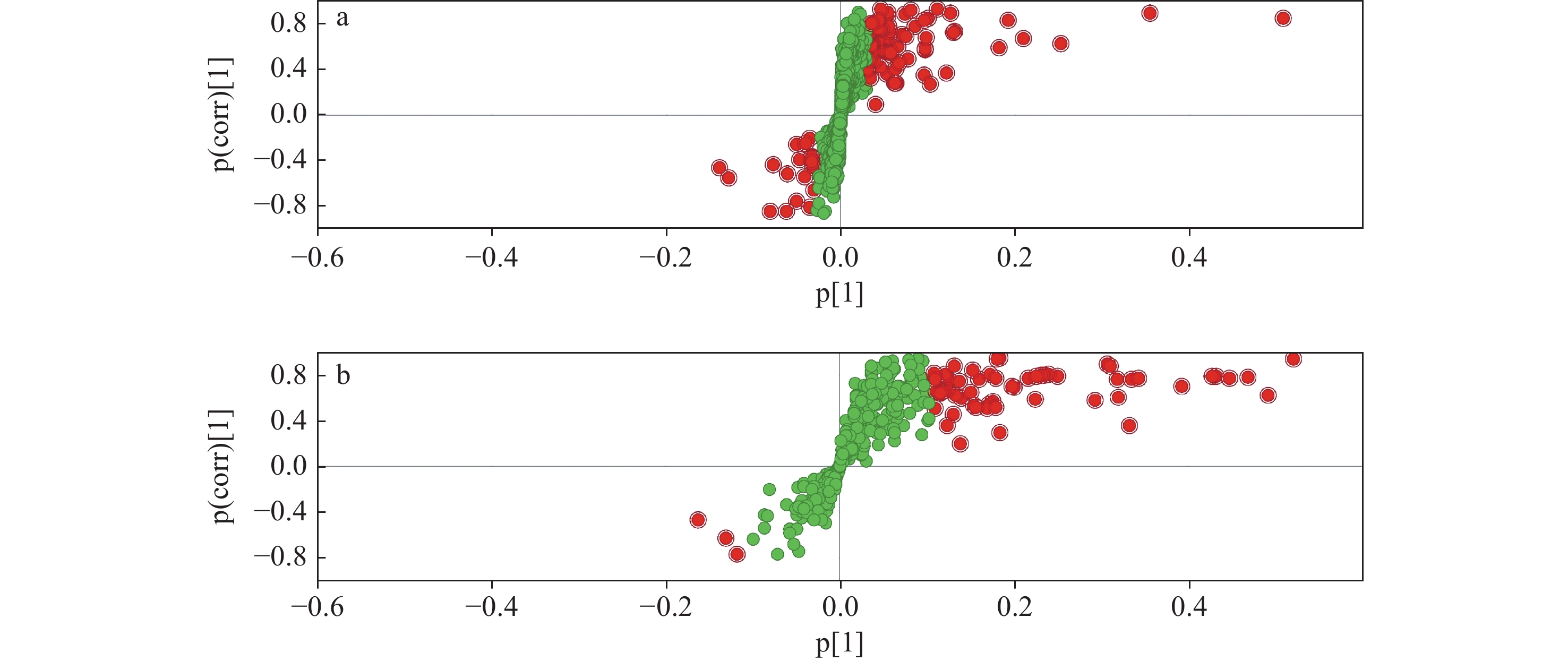
正交偏最小二乘法判别分析(OPLS-DA)是一种监督模型,可以降低系统噪声并提取可变信息,将各实验组间差异可视化,具有比PCA分析更强的分类能力[16]。药物注射组与空白组进行对照得到的OPLS-DA得分图示于图3。其中,横坐标表示各组主成分的得分值,可进行组间差异成分的判别;纵坐标表示正交成分的得分值,可进行组内差异成分的判别。由图3可见,组别之间的数据具有较好的区分度。为进一步确定差异代谢物,药物注射组与空白组对应的差异代谢物S-plot图示于图4,突出显示了几个潜在的生物标记(以VIP值前100且大于1为筛选条件),并将其标记为红色,图中每个点表示1种代谢物。将药物注射组与空白组进行对比,发现代谢物有显著变化,验证了PCA分析结果[17]。
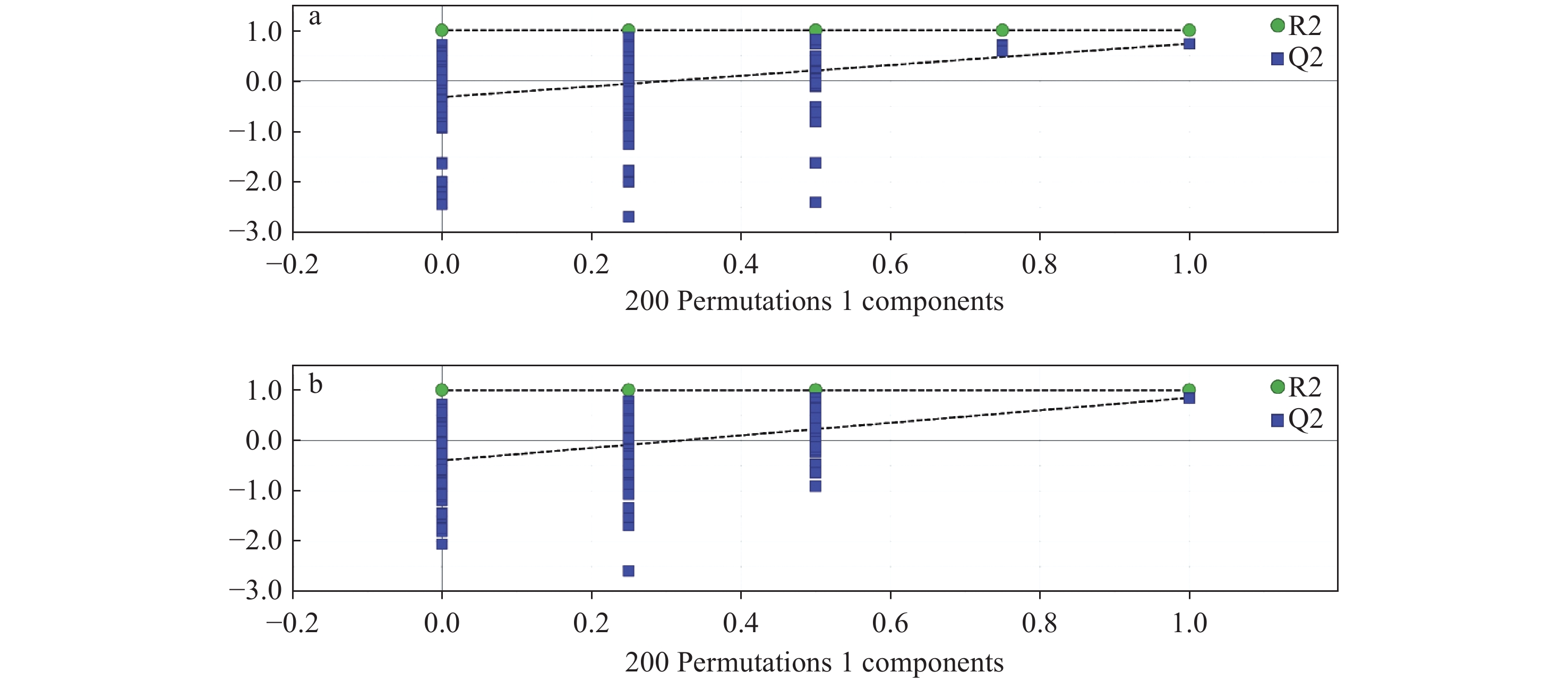
为防止OPLS-DA分析模型的过度拟合,对其进行了200次响应排序检验。通过对数据进行随机排序,再建立对应的OPLS-DA模型,以获取随机模型的R2(模型对X和Y矩阵的解释率)和Q2(模型的预测能力),与原模型进行线性回归,得到回归直线,并通过回归直线与y轴的截距,观察模型是否具有良好的可重复性和可预测性,结果示于图5。可以看出,R2回归直线的斜率在0.3~0.4之间,且Q2回归直线的截距均小于0,表明模型的拟合度较好[18]。
-
使用GraphPad Prism 8对代谢物数据进行统计分析,以平均标准偏差(SD)表示,并换算为帕累托方差。使用Student’s T检验分析组间的统计差异,以P<0.05作为第一步筛选条件。
在进行OPLS-DA分析的同时,以VIP值前100且大于1为条件进一步筛选出差异代谢物。将筛选出的差异代谢物与基因组百科全书(KEGG)和mzCloud数据库比对后,共鉴定出37种差异代谢物,正、负离子模式分别为23、14种,具体的代谢物信息列于表2、3。
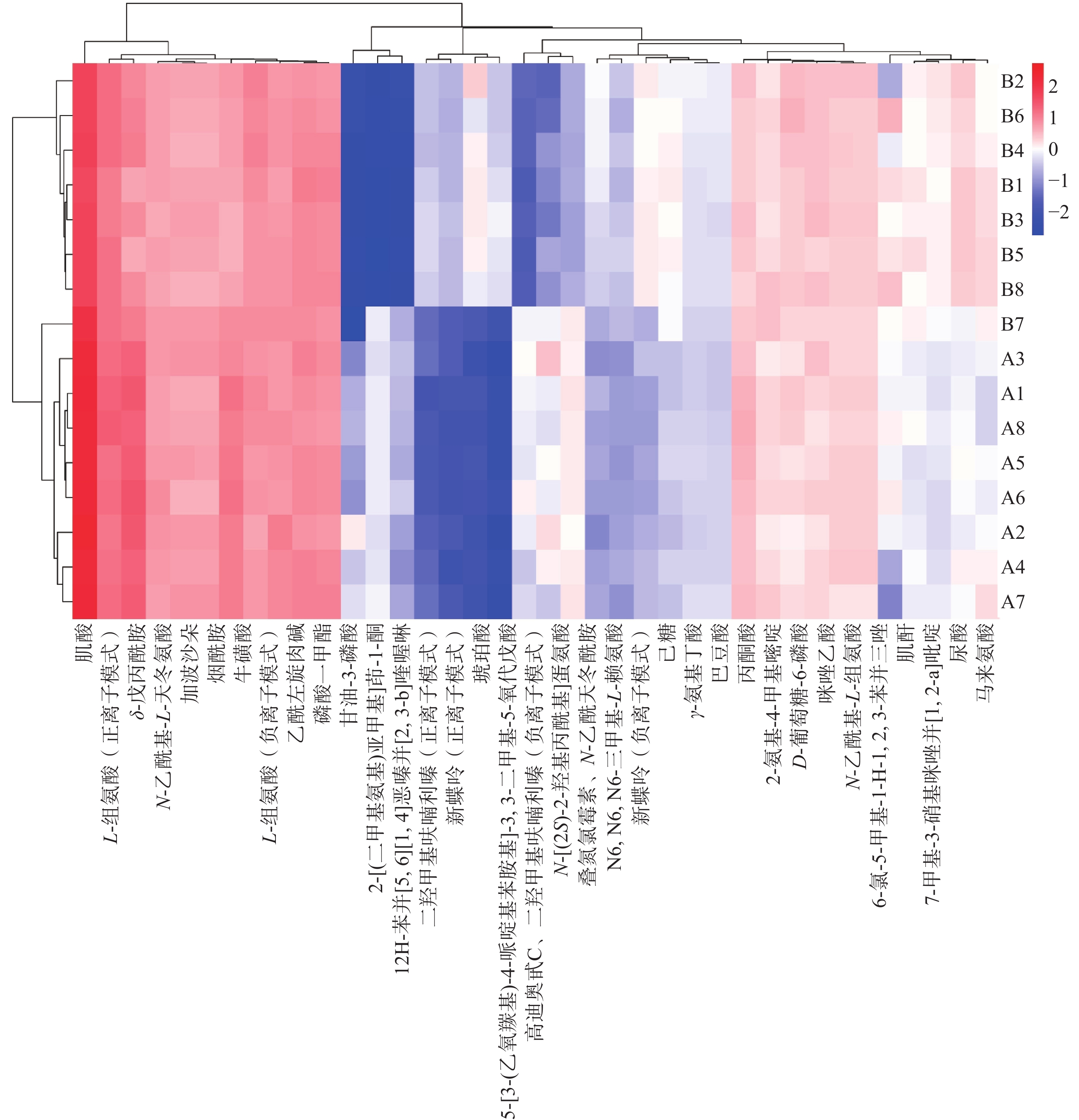
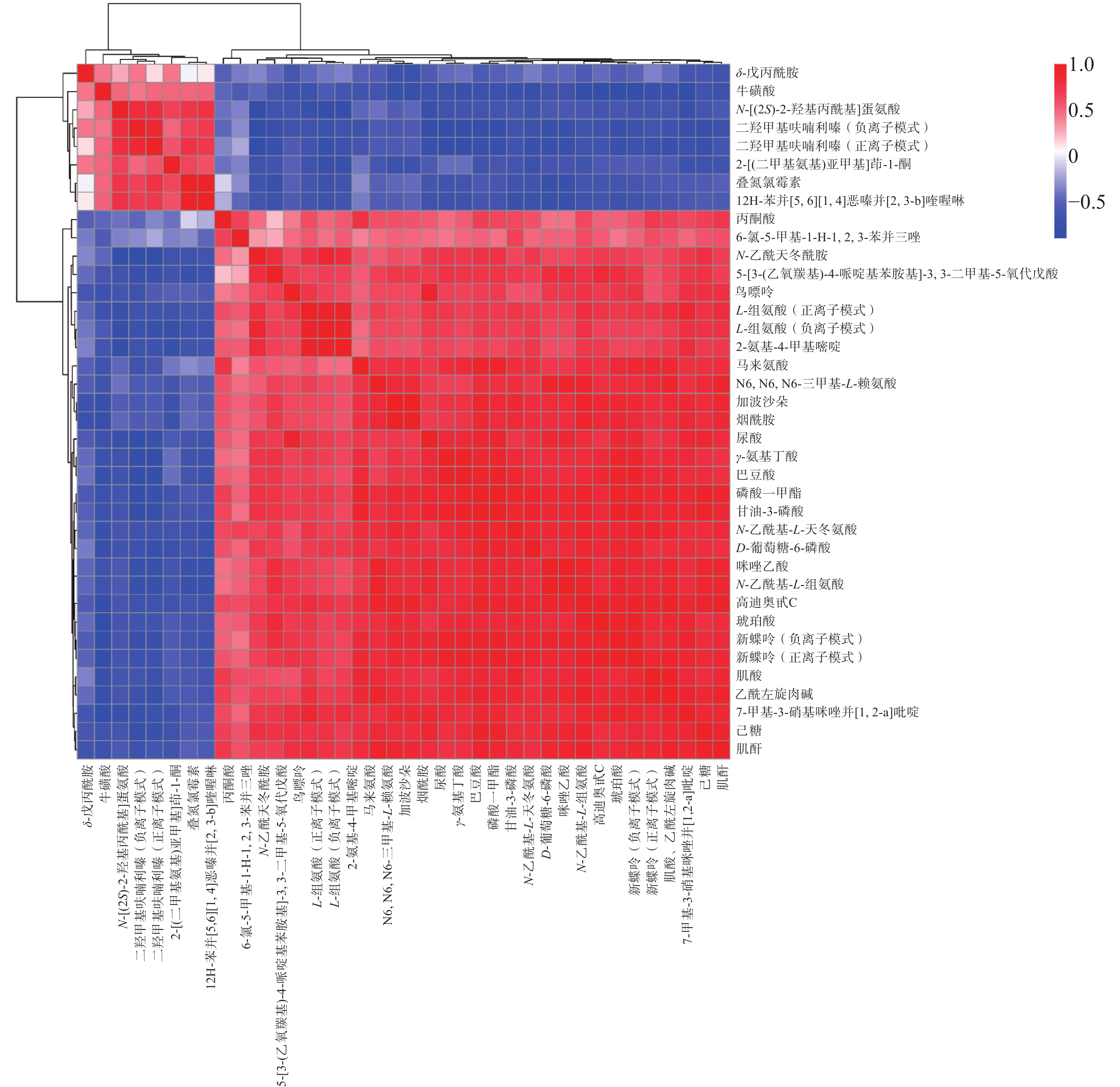
通过BioLadder网站(https://www.bioladder.cn)绘制实验组差异代谢物热图,示于图6,其中纵坐标A与B分别表示药物注射组与空白组,数字表示不同的组别,横坐标表示差异代谢物。由于不同组别之间含量差异较大,对组间含量的比值进行log2倍数变化,以更直观地展示结果。对筛选的差异代谢物之间的相互关系进行行列聚类分析,并利用Spearman算法绘制相关性热图,示于图7。横、纵坐标均为筛选出的差异代谢物,2种差异代谢物对应的方格越红,表示二者的关联性越强,对应的方格越蓝,表明二者的关联性越不明显[19]。从图6、7可知,染毒组与对照组的代谢物具有明显差异,且各差异代谢物的相对丰度差异明显。
-
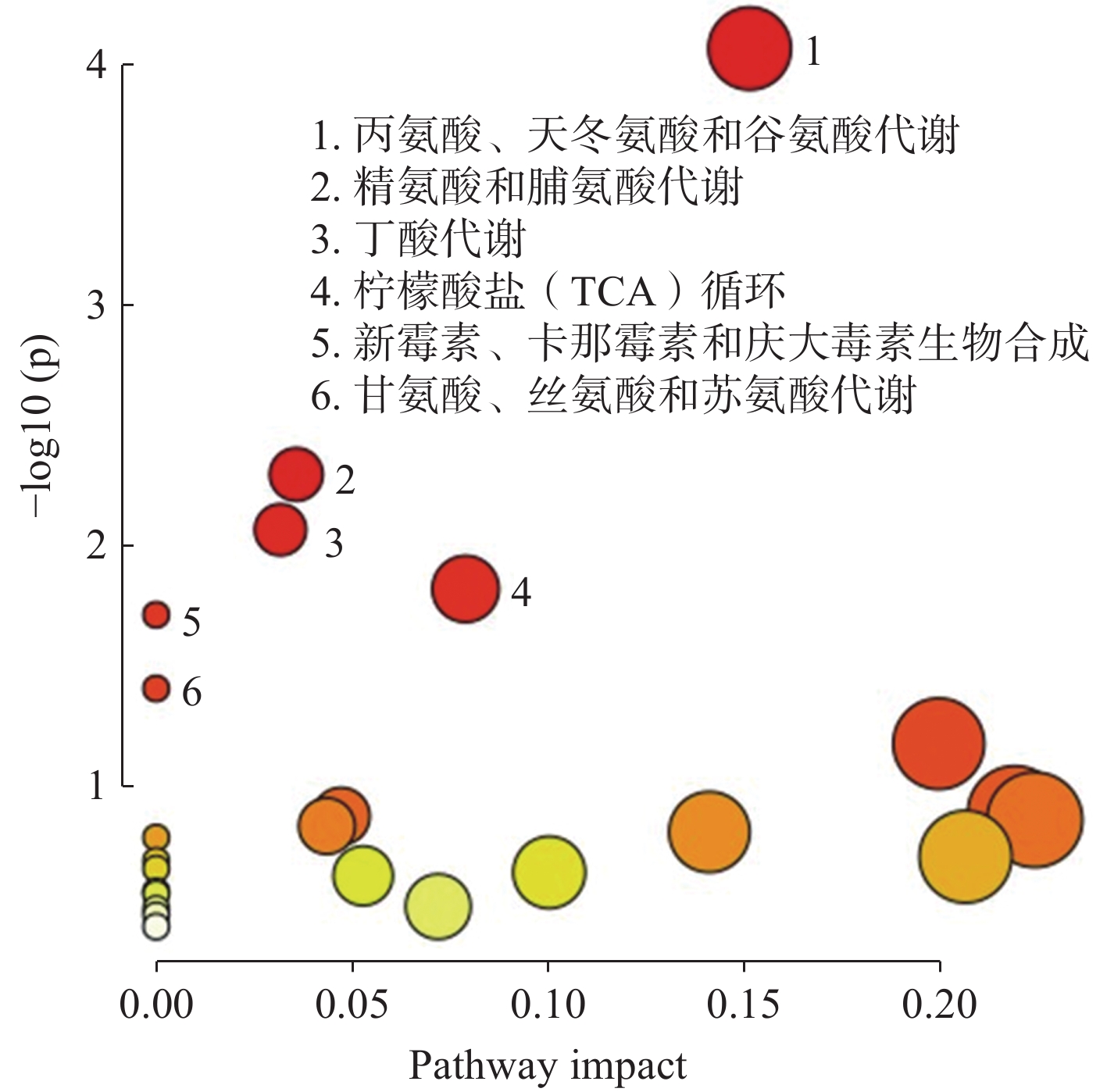
经OPLS-DA和统计学分析后,将筛选出的差异代谢物在MetaboAnalyst5.0网站(https://www.metaboanalyst.ca)进行代谢通路富集分析[20],结果示于图8。可见,4-HO-MiPT显著影响的代谢通路有6条:丙氨酸、天冬氨酸和谷氨酸代谢通路,精氨酸和脯氨酸代谢通路,丁酸代谢通路,柠檬酸盐(TCA)循环通路,新霉素、卡那霉素和庆大霉素生物合成通路,甘氨酸、丝氨酸和苏氨酸代谢通路。
-
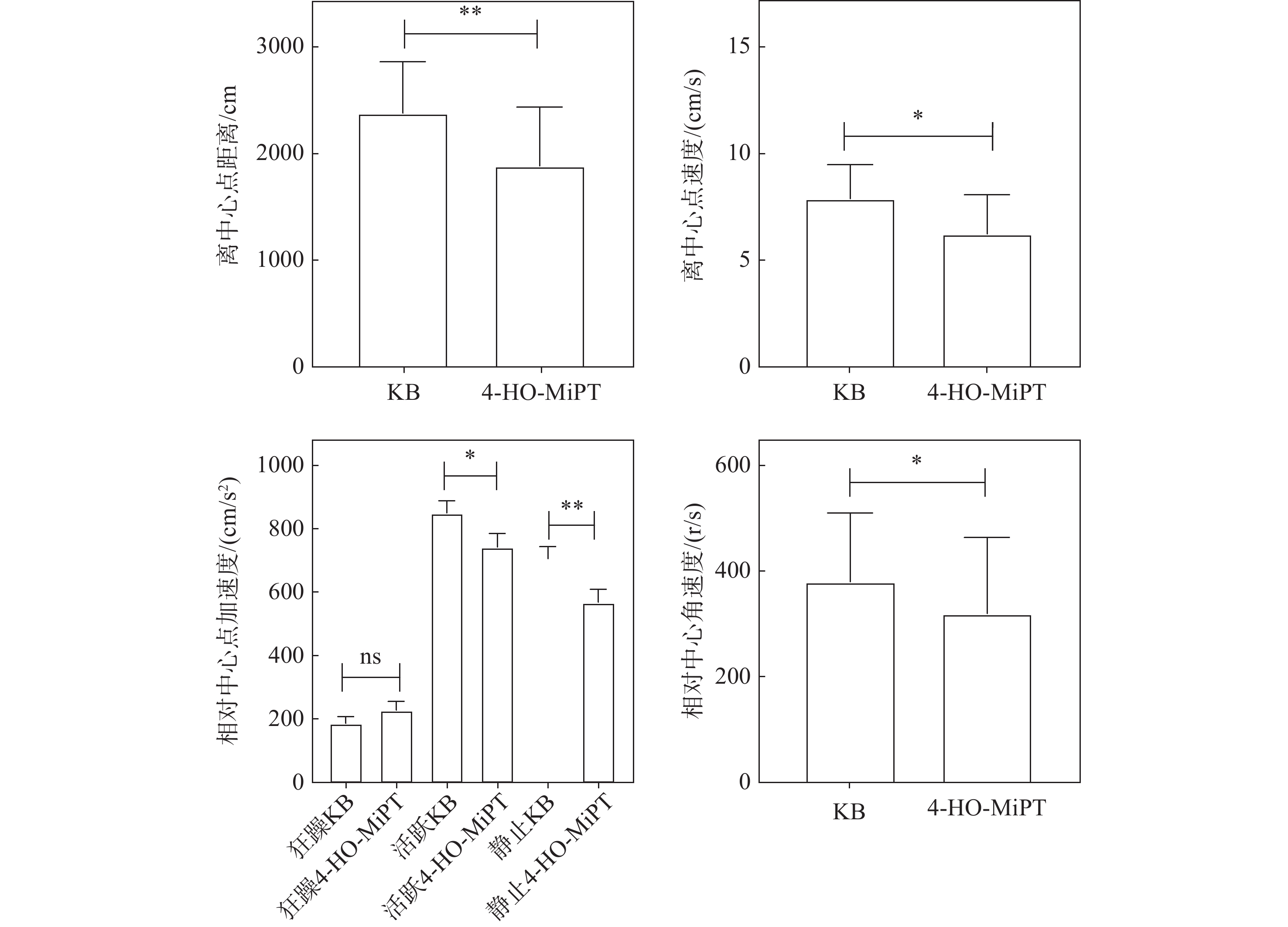
使用EthoVision XT14软件分析斑马鱼注射药物后5 min内的行为,发现斑马鱼的移动距离、速度、活跃度、角速度等指标均发生了明显变化。以标准偏差(mean,±SD)表示数据结果,示于图9。对比空白组与药物注射组的数据发现,药物注射后,斑马鱼移动距离缩短、速度显著下降、狂躁频率上升、活跃与静止频率均明显下降、运动角速度下降,表明其认知能力下降。
-
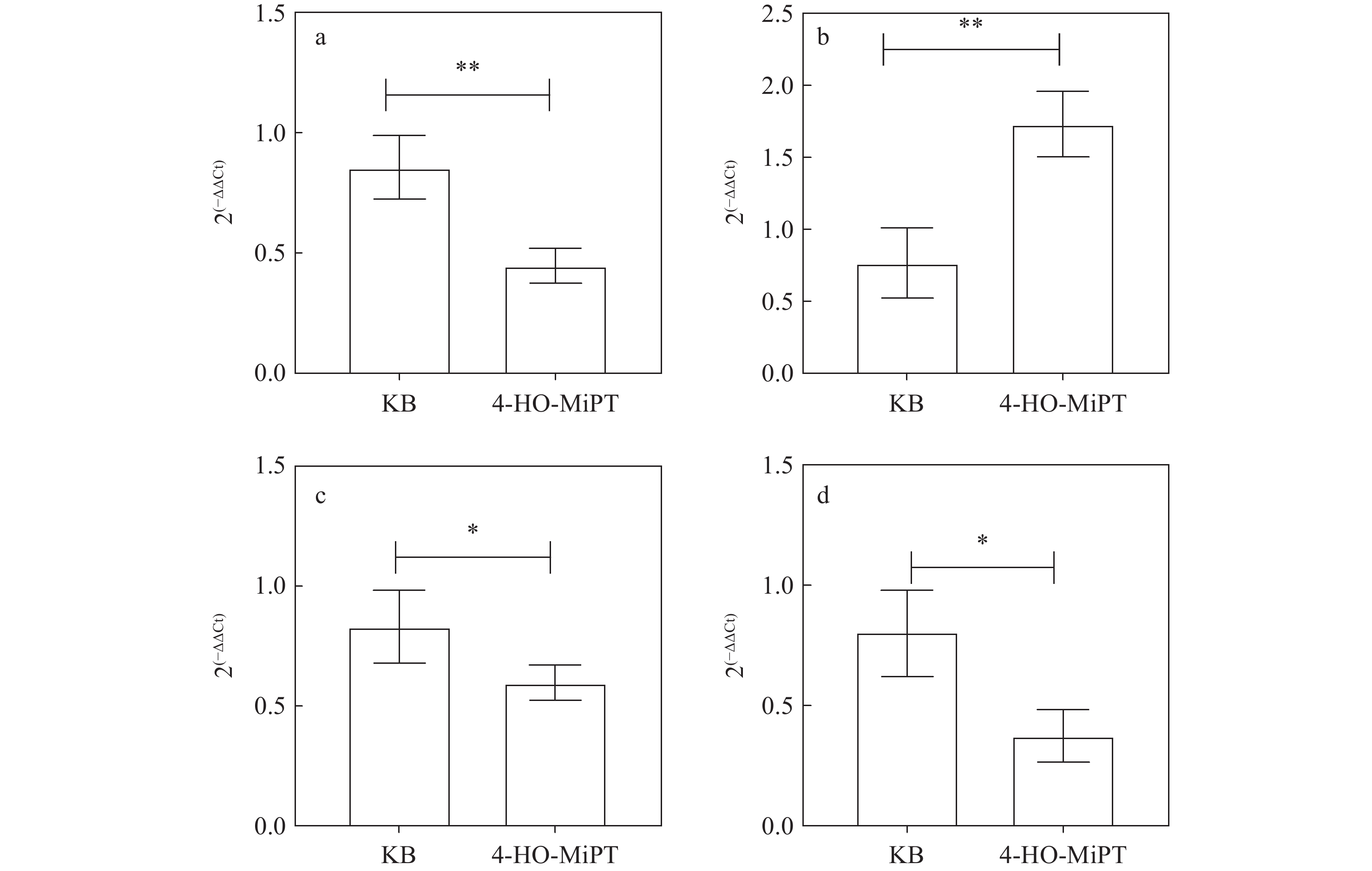
通过PCR技术对目标mRNA对应的DNA扩增后,使用超微量核酸测定仪测定各目标基因mRNA浓度,以Actin为内参,利用2-(∆∆Ct)计算各样品目标基因的相对转录水平,以±SD表示数据比较结果,示于图10。可以发现,实验组目标基因nr2a-a、nr2a-b、grik3、bcl-2的转录水平均明显下降(P<0.05)。
-
向斑马鱼注射4-HO-MiPT后,代谢物水平发生显著变化,其中,7种代谢物水平升高、30种代谢物水平降低。在水平升高的代谢物中, 2-[(二甲基氨基)亚甲基]茚-1-酮通常用作蛋白激酶的抑制剂,其水平升高表明斑马鱼体内蛋白激酶活性可能增加[21],该变化与某些癌症和发育相关疾病的风险增加相关。此外,二羟甲基呋喃利嗪的显著升高可能提示体内异常出血,而N-[(2S)-2-羟基丙酰基]蛋氨酸的升高表明机体正在通过增强抗氧化防御机制来应对膜脂质过度氧化造成的损伤。在水平降低的代谢物中,需要注意的是多种与机体免疫功能直接相关的物质,如新蝶呤的下降可能表明机体免疫活化能力降低,琥珀酸的减少表示机体抗炎和免疫功能减弱[22]。牛磺酸和N-乙酰天冬酰胺的降低进一步证实了免疫系统和中枢神经系统可能遭受影响[23]。另外,部分代谢物的变化还表明对机体代谢过程的广泛影响。如,L-组氨酸缺乏可能导致发育迟缓;N6,N6,N6-三甲基-L-赖氨酸减少则影响心脏能量代谢[24];尿酸和己糖降低能够减慢机体排出有毒物质的速率。
在代谢通路的调整中,多种氨基酸扮演着神经递质或神经调节剂的角色[25]。4-HO-MiPT对丙氨酸、天冬氨酸和谷氨酸的代谢通路影响尤为显著,可能对神经细胞和视感细胞产生显著的细胞毒性[26];天冬氨酸在嘧啶类物质的生产中发挥关键作用,而嘧啶是DNA和RNA的关键组成部分,该代谢通路的变化可能对遗传信息传递产生影响;天冬氨酸和谷氨酸在大脑中高度集中,作为主要的兴奋性神经递质,它们的代谢变化会对中枢神经系统的功能产生重要影响。此外,本研究发现,经4-HO-MiPT处理后,精氨酸-脯氨酸的代谢途径发生显著变化,精氨酸在多个代谢过程中发挥作用,其代谢途径的改变可能会干扰多种细胞功能,如,精氨酸在神经元中参与一氧化氮(NO)的合成,这可能导致神经毒性或呈现神经保护效应[27]。三羧酸循环(TCA)不仅对碳水化合物的分解至关重要,而且在脂肪酸和蛋白质的分解中也发挥重要作用。TCA为氨基酸合成提供中间产物,因此,该通路的改变会造成中间产物的变化,间接影响不同氨基酸的代谢路径。本研究结果揭示了4-HO-MiPT对生物体代谢网络的广泛影响,表明其对细胞功能和神经系统可能产生深远影响。
目标基因nr2-a作为脑部NMDA受体的关键跨膜亚基,在脑发育和维持正常生理功能中发挥着重要作用。本实验发现,nr2a-a、nr2a-b转录水平降低,表明4-HO-MiPT对NMDA受体产生了负面影响,使脑部神经元的树突和轴突结构发生显著变化。同样,grik3作为一种重要的兴奋性神经递质受体,其转录水平下降,表明斑马鱼在药物作用后对外界刺激的反应敏感度减弱,其感知能力遭受损害[28]。此外,bcl-2基因的转录水平降低,表明斑马鱼脑部细胞凋亡速度加快,从而加速了神经元的退化过程,对大脑功能造成损伤。水平显著升高的二羟甲基呋喃三嗪与致癌性直接关联[29],这与bcl-2转录水平的下降相互印证。
-
本研究分析了注射4-HO-MiPT后斑马鱼的代谢产物、代谢通路和基因变化。结果表明,4-HO-MiPT会对斑马鱼产生内源性影响,引起脲基乙酸、哌啶-2-酮、甲氧基膦酸等物质的相对含量发生变化,从而对斑马鱼产生毒性效应。此外,确定了受4-HO-MiPT影响的6条代谢通路。通过分析斑马鱼脑部基因发现,nr2a-a、nr2a-b、grik3、bcl-2等与脑部神经系统相关的基因转录水平均明显下降,证明4-HO-MiPT对斑马鱼大脑产生影响,进而影响其行为表现。应用行为学、代谢组学、基因学研究新精神活性物质对斑马鱼的毒理效应,可为其他领域提供研究思路,也为实际生产生活中新精神活性物质的研究与治疗提供数据支撑和思路。
超高效液相色谱-四极杆/静电场轨道阱高分辨质谱探究4-HO-MiPT染毒斑马鱼脑部代谢组学变化
Study on the Brain Metabolomic Changes of 4-HO-MiPT Infected Zebrafish by UHPLC-Q/Orbitrap HRMS
-
摘要: 为评价色胺类新精神活性物质4-羟基-N-甲基-N-异丙基色胺(4-HO-MiPT)对大脑的毒性效应,本实验以斑马鱼为模式生物进行自发活动行为记录分析,采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UHPLC-Q/Orbitrap HRMS)分析斑马鱼大脑长期染毒后的代谢产物,并在转录水平上检测斑马鱼脑部目标基因的变化。结果表明,注射药物4-HO-MiPT后,斑马鱼运动速度明显减慢,运动范围明显缩小。从斑马鱼大脑检测出37种差异代谢产物,其中7种升高,30种降低,并导致6条代谢通路改变。脑部基因转录水平检测发现,4个神经系统的基因转录水平下降,对大脑细胞产生影响。本实验证明了4-HO-MiPT对斑马鱼大脑产生毒性效应,对神经系统、免疫功能造成损害并影响体内代谢,对斑马鱼行为产生明显的抑制效果,同时从4-HO-MiPT造成的内源性影响推测其可能致癌。Abstract: This study aimed to assess the neurotoxic effects of the novel psychoactive substance 4-hydroxy-N-methyl-N-isopropyltryptamine (4-HO-MiPT) on brain. By employing zebrafish as a model organism, the study applied a multifaceted approach, including the recording and analysis of spontaneous behavioral activities, identification of brain metabolic products via ultra-high performance liquid chromatography coupled with quadrupole-Orbitrap high resolution mass spectrometry (UHPLC-Q/Orbitrap HRMS), and examination of changes in the transcriptional level of target genes. Following the injection of 4-HO-MiPT, zebrafish exhibites a pronounced reduction in movement speed and range, indicating a significant alteration in locomotor activity. The subsequent analysis of brain metabolic products finds 37 differential metabolites, including 7 elevated and 30 reduced ones, alongside notable alterations in 6 metabolic pathways. Moreover, the examination of transcriptional level of key genes in zebrafish brain underscores a discernible decrease in transcriptional level of genes associated with the nervous system, implying a substantial impact on neuronal function and synaptic transmission. The experimental findings substantiate the neurotoxic effects of 4-HO-MiPT on the zebrafish brain, shedding light on its deleterious repercussions on both the nervous and immune systems. Furthermore, the perturbations observed in metabolic processes and behavioral responses emphasize the profound impact of 4-HO-MiPT exposure on fundamental physiological functions. The identification of potential carcinogenicity associated with 4-HO-MiPT further underscores the urgent need for comprehensive risk assessment and regulatory scrutiny. This study represents a crucial step towards unraveling the intricate neurotoxic mechanisms underlying 4-HO-MiPT exposure. The research has far-reaching implications, not only in advancing our understanding of the adverse health effects associated with novel psychoactive substances, but also in guiding the development of targeted interventions and regulatory strategies aiming at safeguarding public health and well-being. Continued exploration into the long-term consequences of 4-HO-MiPT exposure, alongside comprehensive toxicological evaluations, holds promise in mitigating its potential hazards and ensuring the safety of individuals and communities exposed to this emerging threat.
-

-
表 1 引物信息
Table 1. Primer information
基因序号 No. 引物名称 Primer name 序列 Sequence (5' to 3') 退火温度 Annealing temperature/℃ 1 NR2A-a-F CGCAGAGACATACGACAC 60 NR2A-a-R TGGGATACATTGGTTTGAGG 2 NR2A-b-F CTCCTATCGGCACATATACC 60 NR2A-b-R CTCGGCATCCTCTTGTAG 3 GRIK3-F CGCAGAGACATACGACAC 60 GRIK3-R TGGGATACATTGGTTTGAGG 4 bcl-2-F GAGATGAGTCCGCTTGTG 60 bcl-2-R CATCCTCCTTGGCTTTGG 表 2 正离子模式下差异代谢物信息
Table 2. Information of metabolic differentiator under positive ion mode
代谢物
Metabolite化学式
Chemical
formula保留时间
Retention
time/min差异倍数取log2
log2 transformation of fold changeP值
P-valueVIP值
VIP-value趋势
Trend肌酸 C4H9N3O2 0.757 −0.4 0.01 16.7 ↓ L-组氨酸 C6H9N3O2 0.385 −1.38 0.01 11.6 ↓ δ-戊丙酰胺 C5H9NO 1.331 0.41 0.02 4.2 ↑ 乙酰左旋肉碱 C9H17NO4 0.525 −0.93 0.004 6.3 ↓ 加波沙朵 C6H8N2O2 0.692 −0.53 0.01 4.3 ↓ 烟酰胺 C6H6N2O 0.693 −0.53 0.01 4.3 ↓ 2-氨基-4-甲基嘧啶 C5H7N3 0.382 −1.39 0.009 4.1 ↓ 咪唑乙酸 C6H8N2O3 0.535 −0.9 0.006 3.3 ↓ N-乙酰基-L-组氨酸 C8H11N3O3 0.552 −0.86 0.008 3.1 ↓ 肌酐 C4H7N3O 0.54 −0.89 0.01 2.3 ↓ 7-甲基-3-硝基咪唑并[1,2-a]吡啶 C8H7N3O2 0.384 −1.38 0.006 2.6 ↓ 2-[(二甲基氨基)亚甲基]茚-1-酮 C12H13NO 1.529 7.26 0.000000000001 1.3 ↑ 叠氮氯霉素 C11H13N5O5 9.117 3.19 0.0009 2.6 ↑ 高迪奥甙 C C25H42O9 0.012 −6.36 0.0002 1.8 ↓ γ-氨基丁酸 C4H9NO2 0.673 −0.57 0.001 1.2 ↓ 12H-苯并[5,6][1,4]恶嗪并[2,3-b]喹喔啉 C14H9N3O 7.605 9.57 0.0001 2.0 ↑ 巴豆酸 C4H6O2 0.696 −0.52 0.005 1.1 ↓ N6,N6,N6-三甲基-L-赖氨酸 C9H20N2O2 0.46 −1.12 0.004 1.0 ↓ 新蝶呤 C9H11N5O4 0.09 −3.47 0.002 1.4 ↓ 二羟甲基呋喃利嗪 C11H11N5O5 1.352 7.08 0.0002 1.1 ↑ 琥珀酸 C4H6O4 0.069 −3.86 0.004 1.1 ↓ 鸟嘌呤 C5H5N5O 0.644 −0.64 0.01 1.8 ↓ 牛磺酸 C2H7NO3S 0.123 −3.02 0.0006 1.2 ↓ 表 3 负离子模式下差异代谢物信息
Table 3. Information of metabolic differentiator under negative ion mode
代谢物
Metabolite化学式
Chemical
formula保留时间
Retention
time/min差异倍数取log2
log2 transformation
of fold changeP值
P-valueVIP值
VIP-value趋势
Trend磷酸一甲酯 CH5O4P 0.391 −1.36 0.0004 4.4 ↓ L-组氨酸 C6H9N3O2 0.336 −1.57 0.004 4.9 ↓ 甘油-3-磷酸 C3H9O6P 0.376 −1.41 0.0003 4.2 ↓ 马来氨酸 C4H5NO3 0.654 −0.61 0.0003 2.8 ↓ N-乙酰基-L-天冬氨酸 C6H9NO5 0.604 −0.73 0.00008 2.9 ↓ 丙酮酸 C3H4O3 0.577 −0.79 0.02 1.3 ↓ D-葡萄糖-6-磷酸 C6H13O9P 0.449 −1.15 0.02 2.2 ↓ 尿酸 C5H4N4O3 0.276 −1.86 0.0009 2.1 ↓ 己糖 C6H12O6 0.288 −1.8 0.0004 1.4 ↓ 二羟甲基呋喃利嗪 C11H11N5O5 5.665 5.82 0.0003 1.1 ↑ N-[(2S)-2-羟基丙酰基]蛋氨酸 C8H15NO4S 11.31 3.5 0.004 1.2 ↑ 新蝶呤 C9H11N5O4 0.128 −2.97 0.0002 1.6 ↓ N-乙酰天冬酰胺 C6H10N2O4 0.244 −2.03 0.01 1.0 ↓ 6-氯-5-甲基-1-H-1,2,3-苯并三唑 C7H6ClN3 0.05 −4.32 0.001 1.3 ↓ -
[1] ANASTOS N, BARNETT N W, PFEFFER F M, LEWIS S W. Investigation into the temporal stability of aqueous standard solutions of psilocin and psilocybin using high performance liquid chromatography[J]. Science &Justice, 2006, 46(2): 91 -96 .[2] FITZGERALD K T, BRONSTEIN A C. Selective serotonin reuptake inhibitor exposure[J]. Topics in Companion Animal Medicine, 2013, 28(1): 13 -17 . doi: 10.1053/j.tcam.2013.03.003[3] ANDERSON I M. Selective serotonin reuptake inhibitors versus tricyclic antidepressants: a meta-analysis of efficacy and tolerability[J]. Journal of Affective Disorders, 2000, 58(1): 19 -36 . doi: 10.1016/S0165-0327(99)00092-0[4] HEILS A, TEUFEL A, PETRI S, STÖBER G, RIEDERER P, BENGEL D, LESCH K P. Allelic variation of human serotonin transporter gene expression[J]. Journal of Neurochemistry, 1996, 66(6): 2 621-2 624. [5] DINGER J, WOODS C, BRANDT S D, MEYER M R, MAURER H H. Cytochrome P450 inhibition potential of new psychoactive substances of the tryptamine class[J]. Toxicology Letters, 2016, 241: 82 -94 . doi: 10.1016/j.toxlet.2015.11.013[6] MALACA S, LO FARO A F, TAMBORRA A, PICHINI S, BUSARDÒ F P, HUESTIS M A. Toxicology and analysis of psychoactive tryptamines[J]. International Journal of Molecular Sciences, 2020, 21(23): 9 279. [7] 黑海, 王继芬. 色胺类新精神活性物质检验方法研究进展[J]. 化学研究与应用, 2019, 31(11): 1 869-1 878. HEI Hai, WANG Jifen. Advances in the methods for detecting new psychoactive substances of tryptamine[J]. Chemical Research and Application, 2019, 31(11): 1 869-1 878(in Chinese). [8] 李楠, 李锋, 魏佳韵, 乔艳玲, 李香豫, 王优美, 徐鹏, 狄斌. 新型色胺类毒品的急性毒性分析1例[J]. 中国药物滥用防治杂志, 2021, 27(4): 549 -551, 573 . LI Nan, LI Feng, WEI Jiayun, QIAO Yanling, LI Xiangyu, WANG Youmei, XU Peng, DI Bin. Acute toxicity analysis of novel tryptamine drugs: a case report[J]. Chinese Journal of Drug Abuse Prevention and Treatment, 2021, 27(4):549 -551, 573 (in Chinese).[9] 赵森, 徐蒙晨, 姚伟宣, 杨志超, 孟梁. 5-MeO-MiPT对斑马鱼毒性及生物转化途径研究[J]. 中国法医学杂志, 2022, 37(2): 194 -197 . ZHAO Sen, XU Mengchen, YAO Weixuan, YANG Zhichao, MENG Liang. Analysis of the toxic effects and biotransformation pathways of N-methyl, N-isopropyl-5-methoxytryptamine in zebrafish[J]. Chinese Journal of Forensic Medicine, 2022, 37(2):194 -197 (in Chinese).[10] FERNIE A R, SCHAUER N. Metabolomics-assisted breeding: a viable option for crop improvement?[J]. Trends in Genetics, 2009, 25(1): 39 -48 . doi: 10.1016/j.tig.2008.10.010[11] MOCO S, VERVOORT J, BINO R J, de VOS R C H, BINO R. Metabolomics technologies and metabolite identification[J]. TrAC-Trends in Analytical Chemistry, 2007, 26(9): 855 -866 . doi: 10.1016/j.trac.2007.08.003[12] 李运, 周德来, 王苗. 基于代谢组学分析揭示白花前胡和紫花前胡的差异代谢物[J]. 特产研究, 2023, 136: 1 -11 . LI Yun, ZHOU Delai, WANG Miao. Metabolomics analysis revealed the differential metabolites of Peucedani radix and Peucedani decursivi radix[J]. Special Wild Economic Animal and Plant Research, 2023, 136:1 -11 (in Chinese).[13] 李丽, 张英秀, 赵日杂, 蔡汶甫, 张志锋. 基于GC-MS代谢组学的云南紫菀和臭蚤草的多元统计分析及抑菌活性研究[J]. 药学学报, 2021, 56(11): 3 118-3 129. LI Li, ZHANG Yingxiu, ZHAO Riza, CAI Wenfu, ZHANG Zhifeng. Multivariate statistical analysis based on GC-MS metabolomics and antibacterial activity of Aster yunnanensis and Pulicaria insignis[J]. Acta Pharmaceutica Sinica, 2021, 56(11): 3 118-3 129(in Chinese). [14] 张鹏宇, 王宝堃, 刘可春, 靳梦. 双酚芴对斑马鱼神经行为的影响及毒性作用机制[J]. 生态毒理学报, 2022, 17(3): 157 -166 . ZHANG Pengyu, WANG Baokun, LIU Kechun, JIN Meng. Toxic effects of bisphenol fluorene on zebrafish neurobehavior and its underlying mechanism[J]. Asian Journal of Ecotoxicology, 2022, 17(3):157 -166 (in Chinese).[15] NICHOLSON J K, LINDON J C, HOLMES E. ‘Metabonomics’: understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1 181-1 189. [16] TRYGG J, WOLD S. Orthogonal projections to latent structures (O-PLS)[J]. J Chemometr, 2002, 16: 119 -128 . doi: 10.1002/cem.695[17] KANG C, ZHANG Y, ZHANG M, QI J, ZHAO W, GU J, GUO W, LI Y. Screening of specific quantitative peptides of beef by LC-MS/MS coupled with OPLS-DA[J]. Food Chemistry, 2022, 387: 132 932. [18] BOCCARD J, RUTLEDGE D N. A consensus orthogonal partial least squares discriminant analysis (OPLS-DA) strategy for multiblock Omics data fusion[J]. Analytica Chimica Acta, 2013, 769: 30 -39 . doi: 10.1016/j.aca.2013.01.022[19] LIVINGSTON E H. Who was student and why do we care so much about his t-test?[J]. The Journal of Surgical Research, 2004, 118(1): 58 -65 . doi: 10.1016/j.jss.2004.02.003[20] 韩春月, 任红微, 王影, 刘二伟, 付志飞. 基于代谢组学和肠道菌群研究褐藻寡糖对脂多糖诱导的何首乌致大鼠肝损伤的影响[J]. 中南药学, 2023, 21(7): 1 700-1 706. HAN Chunyue, REN Hongwei, WANG Ying, LIU Erwei, FU Zhifei. Protective effect of alginate oligosaccharide on live injury induced by Polygoni multiflori radix in lipopolysaccharide activated rats based on gut microbiota and metabonomics[J]. Central South Pharmacy, 2023, 21(7): 1 700-1 706(in Chinese). [21] LIU C, KE P, ZHANG J, ZHANG X, CHEN X. Protein kinase inhibitor peptide as a tool to specifically inhibit protein kinase A[J]. Frontiers in Physiology, 2020, 11: 574 030. [22] 黄松华. 健脾益肾汤联合甲泼尼龙琥珀酸钠治疗慢性肾小球肾炎及对肾功能指标的改善作用[J]. 吉林医学, 2023, 44(8): 2 266-2 269. HUANG Songhua. Jianpi Yishen Decoction combined with methylprednisolone sodium succinate in the treatment of chronic glomerulonephritis and its improvement on renal function index[J]. Jilin Medical Journal, 2023, 44(8): 2 266-2 269(in Chinese). [23] 孙晓敬, 田甜, 马茜, 张磊, 李薇, 姚佳, 汪洋. 弓形虫天冬氨酸蛋白酶2(TgASP2)的生物信息学分析及多克隆抗体的制备[J]. 黑龙江畜牧兽医, 2023(15): 18 -24, 129-130 . SUN Xiaojing, TIAN Tian, MA Xi, ZHANG Lei, LI Wei, YAO Jia, WANG Yang. Bioinformatics analysis and preparation of polyclonal antibody against Toxoplasma gondii aspartic protease 2 (TgASP2)[J]. Heilongjiang Animal Science and Veterinary Medicine, 2023(15):18 -24, 129-130 (in Chinese).[24] KAZAKS A, MAKRECKA-KUKA M, KUKA J, VORONKOVA T, AKOPJANA I, GRINBERGA S, PUGOVICS O, TARS K. Expression and purification of active, stabilized trimethyllysine hydroxylase[J]. Protein Expression and Purification, 2014, 104: 1 -6 . doi: 10.1016/j.pep.2014.09.002[25] SANTOS D, BATOREU M C, ALMEIDA I, RAMOS R, SIDORYK-WEGRZYNOWICZ M, ASCHNER M, MARREILHA dos SANTOS A P. Manganese alters rat brain amino acids levels[J]. Biological Trace Element Research, 2012, 150(1): 337 -341 .[26] ENGSKOG M K R, ERSSON L, HAGLÖF J, ARVIDSSON T, PETTERSSON C, BRITTEBO E. β-N-Methylamino-l-alanine (BMAA) perturbs alanine, aspartate and glutamate metabolism pathways in human neuroblastoma cells as determined by metabolic profiling[J]. Amino Acids, 2017, 49(5): 905 -919 . doi: 10.1007/s00726-017-2391-8[27] TRIPATHY D, CHAKRABORTY J, MOHANAKUMAR K P. Antagonistic pleiotropic effects of nitric oxide in the pathophysiology of Parkinson’s disease[J]. Free Radical Research, 2015, 49(9): 1 129-1 139. [28] 吴伊雪, 肖斌, 孙朝晖, 陈丽丹, 黄晓燕, 李林海. 稳定表达GRIK3乳腺癌MDA-MB-231细胞株的筛选及鉴定[J]. 临床肿瘤学杂志, 2018, 23(11): 973 -977 . WU Yixue, XIAO Bin, SUN Zhaohui, CHEN Lidan, HUANG Xiaoyan, LI Linhai. Screening and identification of breast cancer cell line MDA-MB-231 stably expressing GRIK3[J]. Chinese Clinical Oncology, 2018, 23(11):973 -977 (in Chinese).[29] TAKAHASHI M, NAGASE S, TAKAHASHI S, EMI Y, NAKAE D, UCHIDA K, KONISHI Y. Carcinogenic effects of 3-di(hydroxymethyl)-amino-6-(5-nitro-2-furylethenyl)-1,2,4-triazine in the small intestine of Ishibashi and Wistar rats[J]. Experimental Pathology, 1984, 26(4): 213 -219 . doi: 10.1016/S0232-1513(84)80052-3 -


 首页
首页 登录
登录 注册
注册




 下载:
下载: