-
由禾谷镰孢(Fusarium graminearum)引起的小麦赤霉病是世界性的真菌病害。随着近年来气候变暖、雨带北移以及耕作制度的改变,导致赤霉病的发生区域呈现北扩西移的态势,大流行风险显著增加[1]。除造成严重的作物减产外,禾谷镰孢还会产生真菌毒素污染谷物。根据病原菌产毒的种类和能力可分为雪腐镰刀菌醇(NIV)化学型、3-乙酰基脱氧雪腐镰刀菌烯醇(3-ADON)化学型(产生3-ADON和脱氧雪腐镰刀菌烯醇(DON))和15-乙酰基脱氧雪腐镰刀菌烯醇(15-ADON)化学型(产生15-ADON和DON)[2-3],其中,15-ADON是引起全球赤霉病发生的主要化学型[4]。目前,尚无免疫和高抗赤霉病的小麦品种,其防治主要依赖于化学药剂[5]。然而,部分杀菌剂虽具有良好的防控效果,但会刺激病菌产生更多的DON,加重毒素污染[6]。
DON具有细胞毒性和致癌性,被国际癌症研究机构(IARC)列为第3类致癌物,被联合国粮农组织和世界卫生组织认定为最危险的食品污染物之一。人类或牲畜摄入含有DON的食物或饲料后,肠细胞会发生凋亡、肠道结构改变、肠上皮屏障功能受损、营养吸收受阻[7]。DON还能够影响免疫细胞的增殖与凋亡、干扰免疫因子的释放。高浓度DON可以抑制免疫细胞和淋巴细胞增殖,使免疫系统紊乱和受损[8]。此外,DON还具有明显的胚胎毒性和致畸作用[9]。
DON毒素的生物合成酶和调控蛋白由15个TRI基因编码产生[6]。DON毒素的生物合成始于法尼基焦磷酸的环化,由单端孢霉二烯合酶tri5催化,产生单端孢霉二烯,随后在催化酶Tri4、Tri101、Tri1、Tri3、Tri1、Tri8的作用下形成DON[10]。现有关于DON毒素检测方法的研究大多为粮食及相关食品。其中,谷物中DON的快速检测方法主要有薄层色谱法[11]、高效液相色谱-质谱法[12]、超高效液相色谱-质谱法[13]、酶联免疫法[14-15]、侧流免疫层析法[16-17]、拉曼光谱法[18]、近红外光谱法[19]、电化学法[20]、表面等离子共振法[21]等。在禾谷镰孢的基因功能研究中,通常需要在实验室利用LTB培养基培养菌丝,进而检测对DON毒素合成的调控作用。目前,常用的菌丝内DON毒素检测的方法有薄层色谱法[22]、高效液相色谱法[23]、气相色谱-质谱法[24]、酶联免疫法[25]等。与谷物和食品中DON毒素的检测相比,菌丝中DON的检测仍存在局限,且多为胞外DON毒素检测,少有胞内DON检测。
本研究拟建立气相色谱-质谱(GC-MS)法检测禾谷镰孢产毒菌丝胞内外的DON和15-ADON,希望为小麦赤霉病的基础研究提供技术支持。
-
GCMS-QP2010气相色谱-质谱联用仪:日本Shimadzu公司产品;Savant ISS110 SpeedVac真空旋转浓缩仪、Heto Powerdryer PL3000真空冷冻干燥仪:美国Thermo公司产品; Thermomixer comfort振荡器、移液枪:德国Eppendorf公司产品;Milli-Q超纯水仪:美国Millipore公司产品;恒温培养箱:常州润华电器公司产品;FL1022离心机:中国徽科方领公司产品;Heal Force超净工作台:力康集团公司产品;DHZ-DA冷冻恒温振荡器:苏州培英实验设备有限公司产品;KH-250DB超声仪:昆山禾创超声仪器有限公司产品;SCIENTE-48高通量组织研磨仪:宁波新芝生物科技有限公司产品;C18 SPE固相萃取柱:天津博瑞健合色谱技术有限公司产品。
-
本研究采用禾谷镰孢野生型PH-1[26]和tri5突变体[27]菌株。
DON和15-ADON:加拿大Toronto Research Chemicals(TRC)公司产品;三甲基甲硅烷基咪唑(TMSI)、三甲基氯硅烷(TMCS):美国Sigma-Aldrich公司产品;0.22 μm微孔滤膜:日本Shimadzu公司产品;甲醇和异辛烷(色谱级):美国Merck公司产品;液体单端孢霉烯合成培养基(LTB)所用的试剂蔗糖、KH2PO4、MgSO4·7H2O、KCl、FeSO4·7H2O、精氨酸、柠檬酸、ZnSO4·7H2O、MnSO4·H2O、CuSO4·5H2O、H3BO3、NaMoO4·2H2O、腐胺和植物凝胶:美国Sigma-Aldrich公司产品;PDA培养基:索莱宝公司产品;酵母提取物:美国Thermo公司产品;NH4NO3:上海化学试剂厂产品;KH2PO4和MgSO4·7H2O:广东光华科技股份有限公司产品;羧甲基纤维素(CMC):阿拉丁公司产品;超纯水为实验室自制。
-
分别将DON和15-ADON配制成1 g/L储备液,储存于−20 ℃。各取25 μL储备液混合,加入1 950 μL乙腈-水溶液(84:16,V/V),制备12.5 mg/L标准品混合溶液。将混合溶液逐级稀释成5、2.5、1.0、0.5和0.25 mg/L标准品溶液,取乙腈水溶液作为对照。吸取800 μL不同浓度的混合标准品溶液进行真空浓缩蒸干,加入50 μL硅烷化试剂(三甲基甲硅烷基咪唑-三甲基氯硅烷(100:1,V/V)),充分涡旋,使硅烷化试剂与样品充分混合,并于振荡器振荡10 min;然后加入800 μL异辛烷,轻微上下颠倒充分混匀,再加入800 μL超纯水,轻微上下颠倒并静置分层;上清液过0.22 μm微孔滤膜,转移至进样瓶中。
-
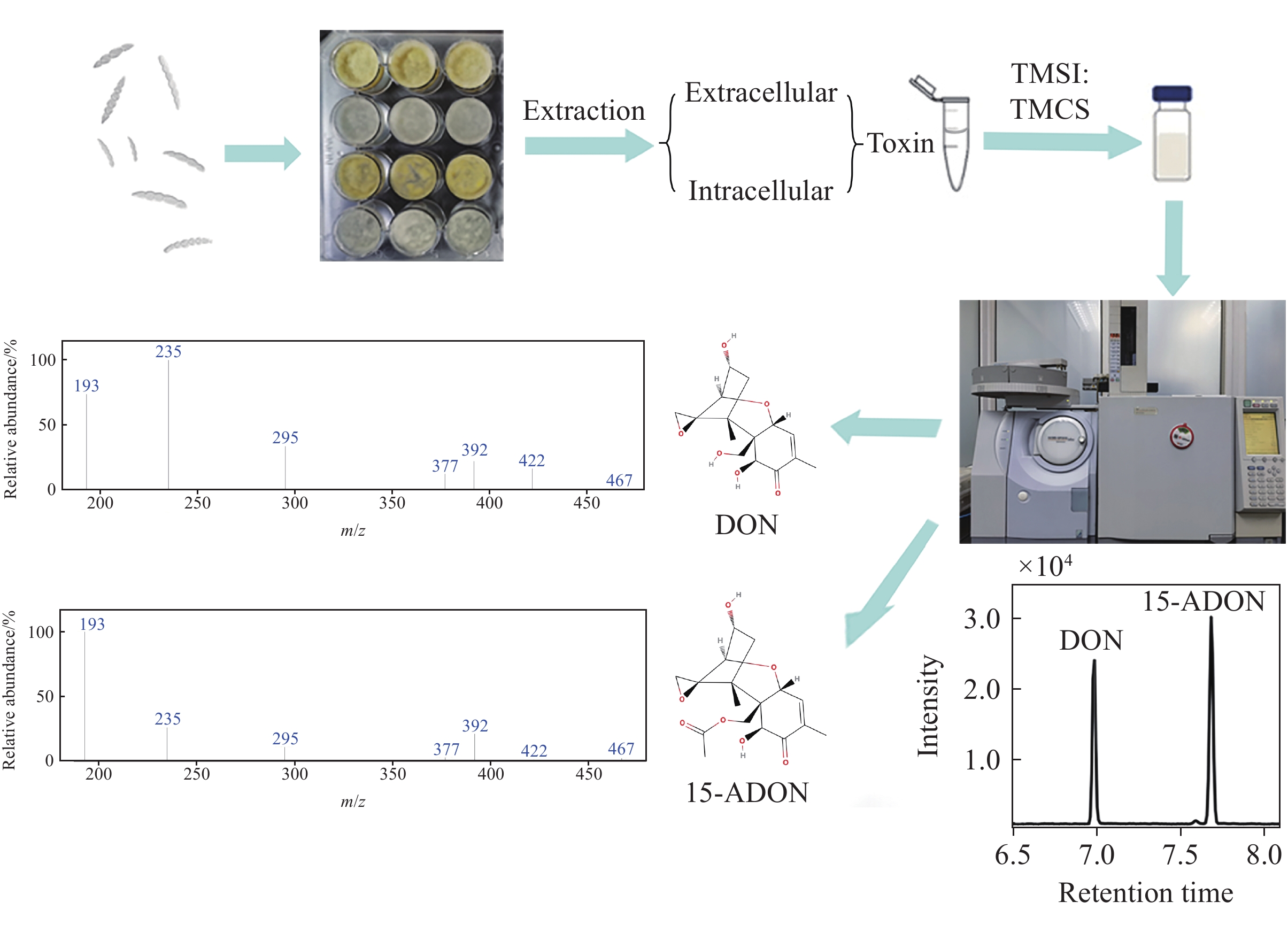
将PH-1和tri5突变体活化至PDA皿中生长3天。将菌块搅碎转移至CMC培养基中,在25 ℃于175 r/min摇床中摇培3天,以3 500 r/min离心后弃去上清液,收集孢子液。在无菌条件下,向24孔板中加入2 mL LTB培养基[28],加入孢子液并吹打混匀至终浓度为1×104个/mL。用锡箔纸将24孔板包好,置于25 ℃培养箱中避光静置培养7天,然后将培养基表面的菌膜迅速置于液氮中,冷冻干燥24 h,称重。
-
胞外DON毒素提取:吸取400 μL培养7天的LTB培养基,加入1 600 μL甲醇,混匀。用1 000 μL乙腈活化C18 SPE固相萃取柱,加入提取液过滤,再用1 000 μL乙腈-水溶液(84:16,V/V)淋洗萃取柱。吸取800 μL滤液真空浓缩蒸干,加入50 μL硅烷化试剂(三甲基甲硅烷基咪唑-三甲基氯硅烷(100:1,V/V)),充分涡旋,使硅烷化试剂与样品充分混合,并于振荡器振荡10 min;然后加入800 μL异辛烷,轻微上下颠倒充分混匀,再加入800 μL超纯水,轻微上下颠倒并静置分层,转移上清液至进样瓶中[28]。
胞内DON毒素提取:将冷冻干燥的菌膜称重,于组织研磨仪中粉碎,加入1 600 μL乙腈-水溶液(84:16,V/V),于(25±2) ℃超声提取30 min,以12 000 r/min离心5 min,收集上清液。向菌丝沉淀中加入1 400 μL乙腈-水溶液重复超声提取,合并上清液,过C18 SPE固相萃取柱。吸取1 800 μL萃取液至新的2 mL离心管中,真空浓缩蒸干,加入50 μL硅烷化试剂(三甲基甲硅烷基咪唑-三甲基氯硅烷(100:1,V/V)),充分涡旋,使硅烷化试剂与样品充分混合,并于振荡器振荡10 min;然后加入200 μL异辛烷,轻微上下颠倒充分混匀,再加入超纯水200 μL,轻微上下颠倒并静置分层,将上清液吸至内衬管中,上样分析。
-
Rxi-5MS色谱柱(30 m×0.25 mm×0.25 μm);分流比50∶1;进样口温度260 ºC;载气为氦气,流速1 mL/min;程序升温:初始柱温150 ºC,保持1 min,以30 ºC/min升至280 ºC,并保持15 min。
-
质谱仪接口温度280 ºC;离子源温度250 ºC;进样量1 μL;在单离子检测(SIM)模式下,利用m/z 295、235和193定性分析DON,利用m/z 392、235和193定性分析15-ADON;分别利用m/z 235、193定量分析DON和15-ADON;质谱采集时间5~10 min。
-
统计数据均包含6次生物学重复,柱状图的误差棒为标准差。采用Graphpad prism 8软件绘制柱状图,Visio 2019和Photoshop 2020软件绘制图片。
-
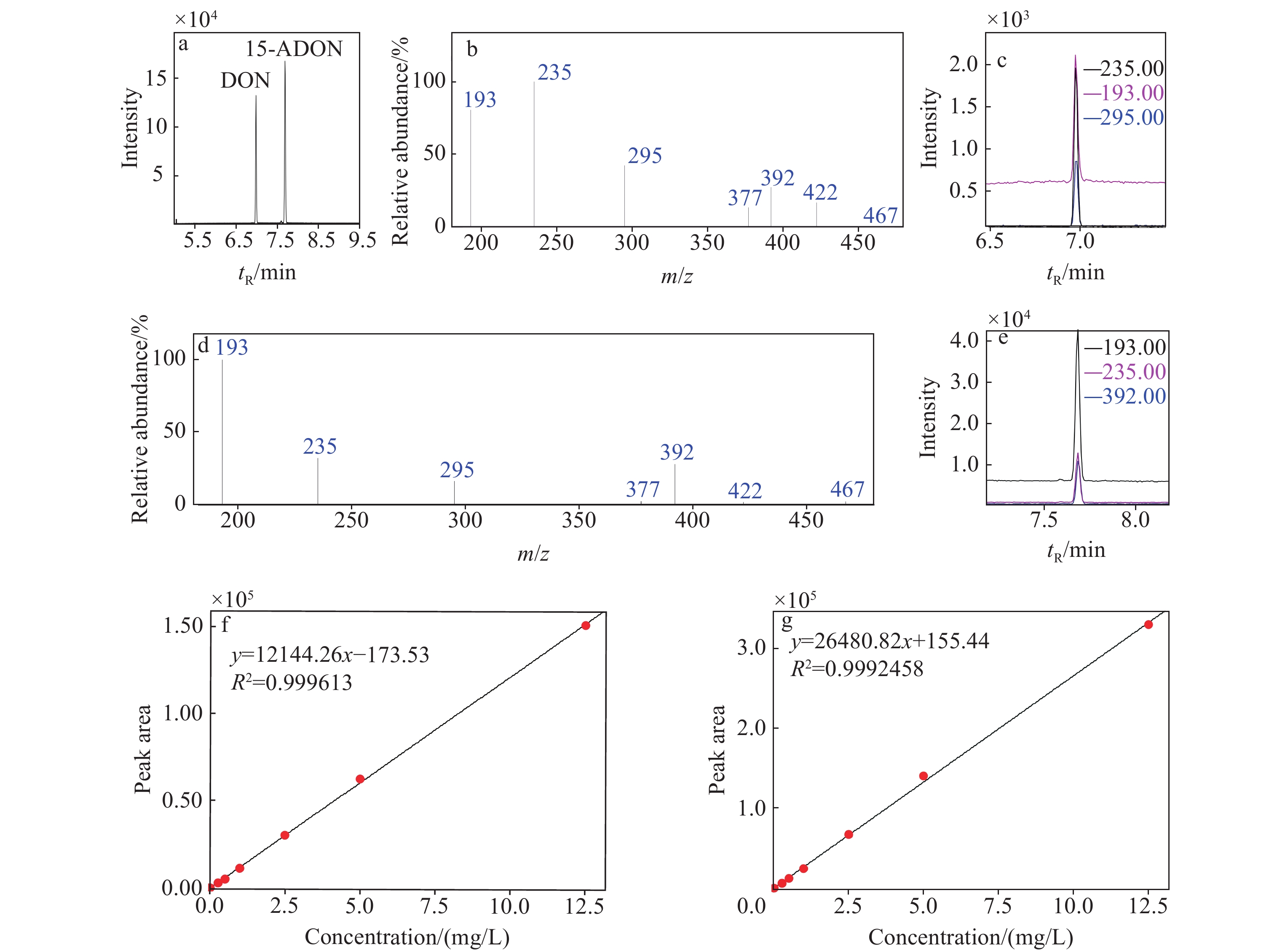
将DON和15-ADON混合标准溶液进样分析,其保留时间分别为6.98和7.68 min,示于图1a。在全扫描模式下,DON的质谱图示于图1b;选取响应强度较高的3个离子m/z 295、235和193进行定性分析,特征离子色谱图示于图1c;选取响应强度最高的离子m/z 235进行定量分析。15-ADON的质谱图示于图1d;选取响应强度较高的3个离子m/z 392、235和193进行定性分析,特征离子色谱图示于图1e;选取响应强度最高的离子m/z 193进行定量分析。将不同浓度的混合标准溶液衍生化后过0.22 μm微孔滤膜,依次进样1 μL,获得各质量浓度标准品的质谱峰强度数据,以标准品浓度(x)为横坐标,峰面积(y)为纵坐标,绘制标准曲线。DON的标准曲线为y=
12144.26 x−173.53,示于图1f;15-ADON的标准曲线为y=26480.82 x+155.44,示于图1g。可见,线性相关系数均高于0.999。 -
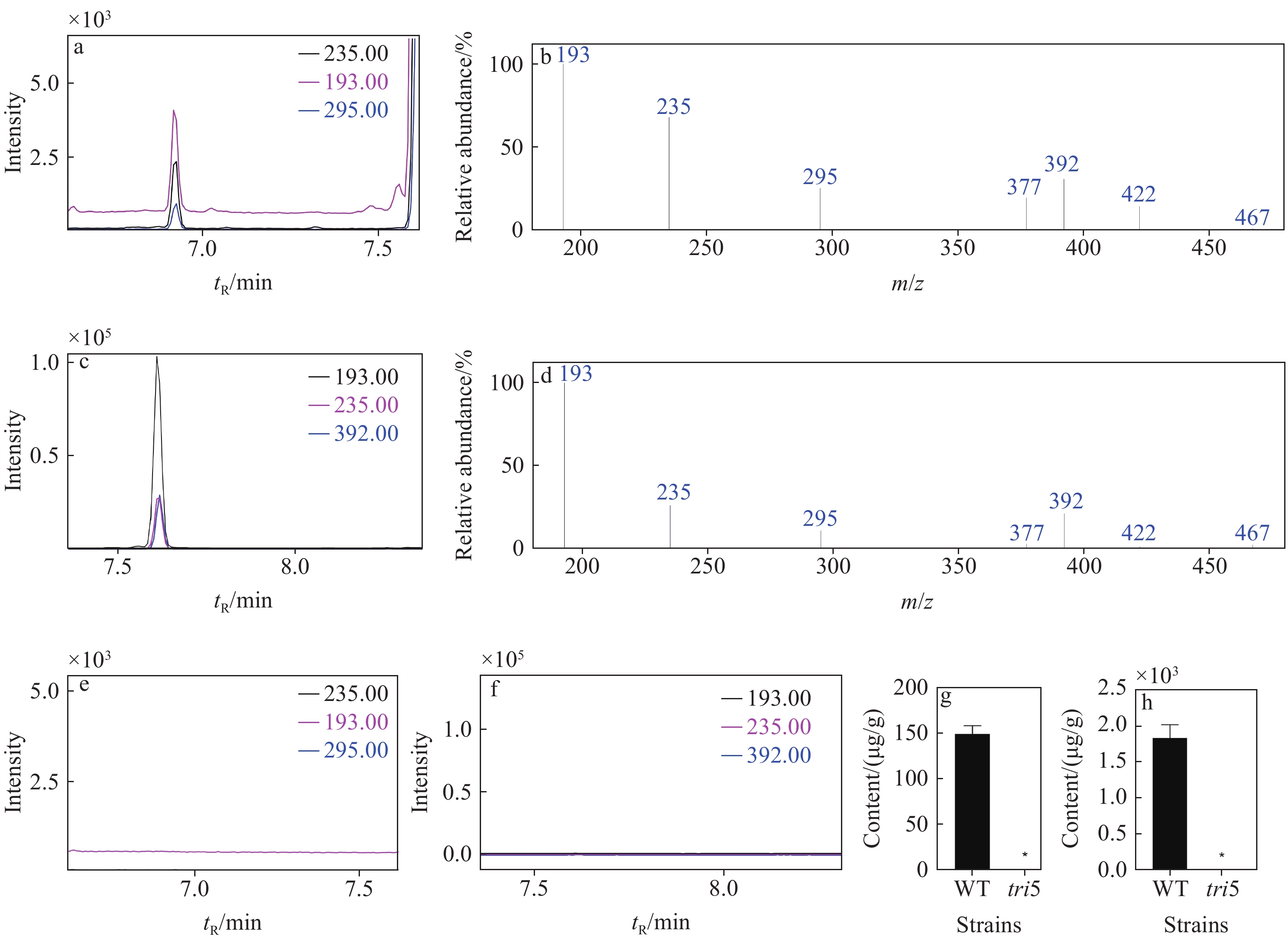
将野生型菌株(WT)以及tri5突变体的孢子置于LTB培养基中静置培养7天,挑取培养基上层的菌膜经冷冻干燥后称其质量,并提取DON毒素进行GC-MS检测。结果表明,野生型PH-1中DON的色谱峰保留时间为6.92 min,3个特征离子的色谱图与标准品相似,示于图2a。菌丝胞内DON的质谱图示于图2b,m/z 295、235和193离子峰的信号强度较高,与DON标准品相同。15-ADON的色谱峰保留时间为7.61 min,3个特征离子的色谱图与标准品相似,示于图2c。15-ADON的质谱图示于图2d,m/z 392、235和193离子峰的信号强度较高,与15-ADON标准品相同。而tri5突变体中未检测到DON和15-ADON的色谱峰,分别示于图2e和2f。将菌膜提取液中DON和15-ADON的含量除以菌膜的质量,得到PH-1胞内DON含量为(149.13±9.15) μg/g,15-ADON含量为(
1833.31 ±185.33) μg/g。tri5突变体胞内DON和15-ADON均未检出,分别示于图2g和2h。 -
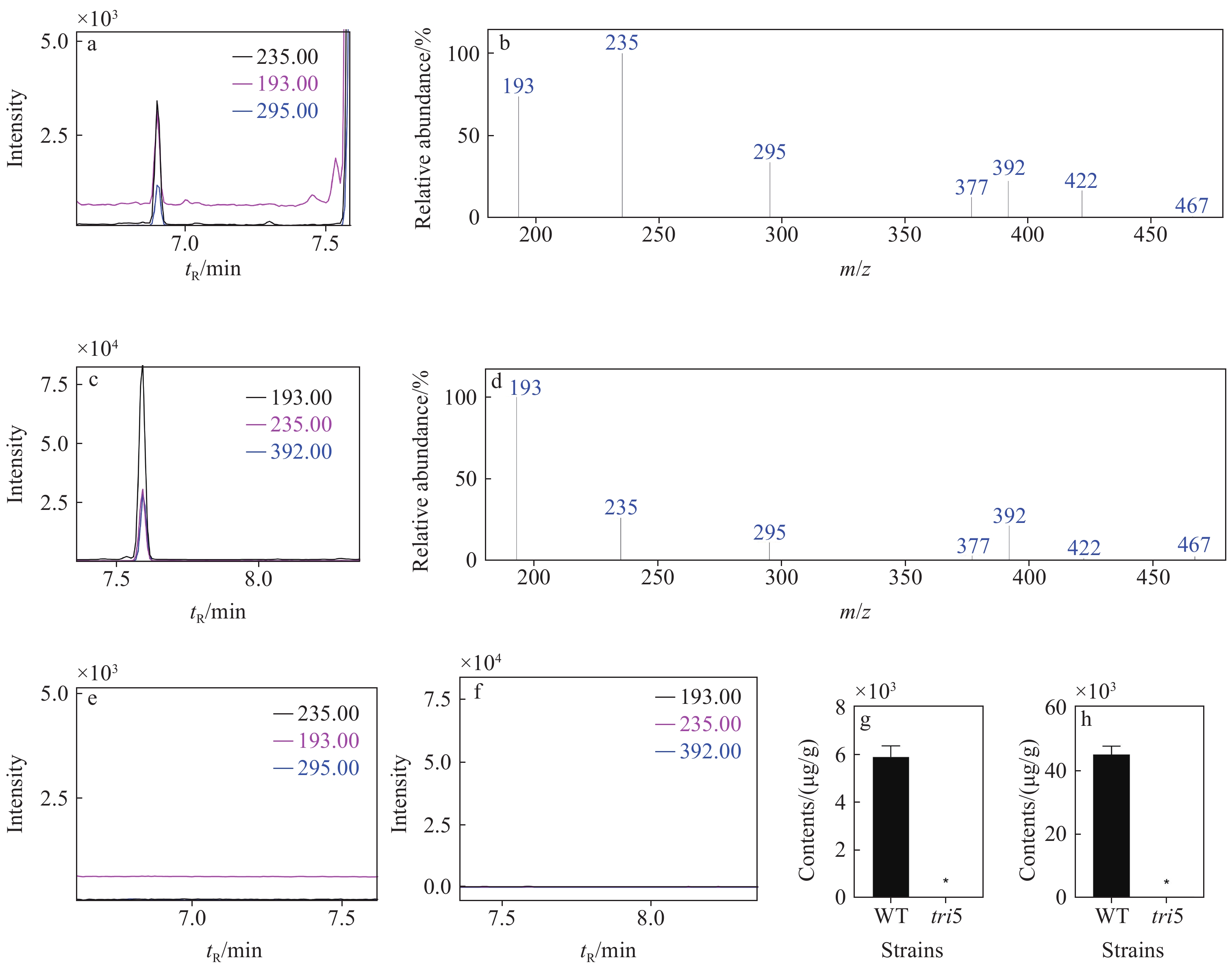
将野生型菌株PH-1和tri5突变体置于LTB培养基中静置培养7天,挑开培养基上层的菌膜后,吸取下层培养基,加入甲醇萃取,过C18柱,衍生化后上样分析。结果表明,野生型PH-1中,胞外DON和15-ADON的色谱峰保留时间分别为6.90、7.58 min,示于图3a、图3c。胞外DON和15-ADON的质谱图及3个特征离子的色谱图均与标准品相似。tri5突变体中未检测到DON和15-ADON的色谱峰。将提取液中DON和15-ADON的含量除以菌膜的质量,换算出PH-1胞外DON含量为(5 910.35±468.23) μg/g,15-ADON含量为(45 222.12±2 726.81) μg/g。tri5突变体的胞外DON和15-ADON均未检出,示于图3g和3h。
-
对DON和15-ADON的混合标准品溶液进行GC-MS分析,连续进样4次,考察保留时间及峰面积的重复性,结果列于表1。DON和15-ADON峰面积的相对标准偏差(RSD)在1.47%~4.96%之间,保留时间RSD为0.01%,表明仪器的精密度良好。
将配制好的混合标准品溶液置于4 ℃冰箱中保存,每隔6 h测量1次,连续测定3次,考察混合样品中各标准品的稳定性。DON和15-ADON的峰面积RSD在4.96%~5.70%之间,保留时间RSD为0.06%,表明混合标准品在测定时间内的性质稳定。
取3份样品,按1.5节方法制得供试品溶液,分别进样1 µL进行重复性实验。DON和15-ADON的峰面积RSD在3.34%~5.27%之间,保留时间RSD在0.01%~0.06%之间,表明该方法的重复性较好。
分别向样品中加入已知浓度的混合标准品溶液,充分混匀后提取,进样1 µL,每个水平测定3次,DON和15-ADON的平均回收率在100.45%~106.85%之间,表明本方法的准确度较高。
-
本研究建立了GC-MS法快速测定禾谷镰孢产毒菌丝胞内外DON及其衍生物15-ADON。通过优化实验条件,各目标化合物均生成较强离子化效应的离子。该方法操作简单、分析快速、定性定量结果准确,可满足产毒菌丝胞内外DON及15-ADON的检测要求。同时,利用该方法检测出参与DON毒素合成途径的第一个酶单端孢霉二烯合酶的缺失突变体tri5不能合成DON毒素,证实了该方法的可靠性。此外,本研究还证实了LTB培养基中培养7天后,野生型胞内外的15-ADON含量均高于DON,且DON和15-ADON在胞外的含量大于胞内。
基于气相色谱-质谱法检测禾谷镰孢菌丝胞内外的脱氧雪腐镰刀菌烯醇和15-乙酰基脱氧雪腐镰刀菌烯醇
Detection of Intracellular and Extracellular Deoxynivalenol and 15-Acetyl Deoxynivalenol of Fusarium graminearum by GC-MS
-
摘要: 禾谷镰孢(Fusarium graminearum)是引起小麦赤霉病的主要病原真菌,不仅会造成严重的作物减产,还会产生脱氧雪腐镰刀菌烯醇(DON)等真菌毒素污染谷物,威胁人畜健康。为探究禾谷镰孢产毒菌丝胞内外的毒素含量,本文建立了气相色谱-质谱联用法同时检测DON和15-乙酰基脱氧雪腐镰刀菌烯醇(15-ADON)。通过质谱特征扫描,DON和15-ADON均获得了较高离子化效应的离子。在单离子检测(SIM)模式下,利用m/z 295、235和193离子定性分析DON,m/z 392、235和193离子定性分析15-ADON。选择其中响应强度最高的m/z 235离子定量分析DON,m/z 193离子定量分析15-ADON。利用该方法检测禾谷镰孢野生型PH-1和DON合成缺陷突变体tri5胞内外的DON和15-ADON含量,PH-1胞内的DON和15-ADON含量分别为(149.13±9.15) μg/g和(
1833.31 ±185.33) μg/g,胞外含量分别为(5910.35 ±468.23) μg/g和(45222.12 ±2726.81 ) μg/g;tri5突变体的胞内外均未检测到DON和15-ADON。该方法可用于菌丝胞内外DON和15-ADON的同时分析。-
关键词:
- 脱氧雪腐镰刀菌烯醇(DON) /
- 15-乙酰基脱氧雪腐镰刀菌烯醇(15-ADON) /
- 禾谷镰孢 /
- 气相色谱-质谱(GC-MS) /
- 真菌毒素
Abstract: Fusarium graminearum is the main pathogenic fungus causing wheat head blight. It not only causes severe crop yield reduction, but also produces fungal toxins such as deoxynivalenol (DON) and 15-acetyl deoxynivalenol (15-ADON), which are dangerous food pollutants to people and livestock. For the genetic functional study of Fusarium graminearum, it is often necessary to culture mycelium on LTB medium in the laboratory to investigate its regulatory effect on DON and 15-ADON synthesis. However, the detection of DON and 15-ADON in the mycelium is focused on extracellular, with less focus on the detection of intracellular. Simultaneous detection of intracellular and extracellular DON and 15-ADON can provide more in-depth information of fungal toxin production and secretion functions. In the study, a method based on gas chromatography-mass spectrometry (GC-MS) for simultaneous detection of DON and 15-ADON was developed. The solvents for extracting DON and 15-ADON can be completely separated and the calibration curves of each extract show good linear relationship within a certain range. The mass spectrometric characteristic scan shows high ionization efficiency for both DON and 15-ADON. The retention time of DON and 15-ADON in chromatogram are 6.98 and 7.68 min, respectively. Qualitative analysis of DON was performed using m/z 295, 235, and 193 under single ion monitor (SIM) mode, while m/z 392, 235, and 193 were used for 15-ADON. The highest intensity ion m/z 235 was selected for the quantification of DON, and m/z 193 for the quantification of 15-ADON. This method was used to detect the intracellular and extracellular levels of DON and 15-ADON in wild-type PH-1 and tri5 mutant with DON biosynthesis deficiency. The intracellular DON and 15-ADON levels in PH-1 are determined to be (149.13±9.15) μg/g and (1833.31 ±185.33) μg/g, extracellular levels are (5910.35 ±468.23) μg/g and (45222.12 ±2726.81 ) μg/g, respectively. The study identified a mutant strain with the deletion of the first enzyme involved in the synthesis pathway of DON and 15-ADON, both DON and 15-ADON are not detected in the extracellular and intracellular of the tri5 mutant. Additionally, this research confirms that after 7 days of cultivation in LTB medium, the wild-type strain exhibits higher levels of 15-ADON in both intracellular and extracellular compared to DON, with extracellular levels of DON and 15-ADON being higher than intracellular levels. This method can provide a methodological reference for the functional study of toxin synthesis in Fusarium graminearum. -

-
表 1 DON和15-ADON检测方法的精密度、稳定性及样品的重复性、加标回收率
Table 1. Precision, stability of DON and 15-ADON assays and repeatability, recovery of spiked sample
标准品
Standard sample精密度 Precision (RSD/%) 稳定性 Stability (RSD/%) 重复性 Repeatability (RSD/%) 回收率
Recovery/%保留时间
Retention
time/min峰面积
Peak area保留时间
Retention
time/min峰面积
Peak area保留时间
Retention
time/min峰面积
Peak areaDON 0.01 4.96 0.06 5.70 0.01 5.27 100.45 15-ADON 0.01 1.47 0.06 4.96 0.06 3.34 106.85 -
[1] 张国辉, 杨晓玲, 吴小毛, 李荣玉, 李明. 脱氧雪腐镰刀菌烯醇(DON)的毒素污染分析及防控研究进展[J]. 农业灾害研究, 2022, 12(9): 22 -24 . ZHANG Guohui, YANG Xiaoling, WU Xiaomao, LI Rongyu, LI Ming. Analysis of toxin contamination and research progress on prevention and control of deoxynivalenol (DON)[J]. Journal of Agricultural Catastrophology, 2022, 12(9):22 -24 (in Chinese).[2] GOSWAMI R S, KISTLER H C. Pathogenicity and in planta mycotoxin accumulation among members of the Fusarium graminearum species complex on wheat and rice[J]. Phytopathology, 2005, 95(12): 1 397-1 404. [3] WARD T J, BIELAWSKI J P, KISTLER H C, SULLIVAN E, O’DONNELL K. Ancestral polymorphism and adaptive evolution in the trichothecene mycotoxin gene cluster of phytopathogenic Fusarium[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(14): 9 278-9 283. [4] PALACIOS S A, ERAZO J G, CIASCA B, LATTANZIO V M T, REYNOSO M M, FARNOCHI M C, TORRES A M. Occurrence of deoxynivalenol and deoxynivalenol-3-glucoside in durum wheat from Argentina[J]. Food Chemistry, 2017, 230: 728 -734 . doi: 10.1016/j.foodchem.2017.03.085[5] 马忠华, 陈云, 尹燕妮. 小麦赤霉病流行成灾原因分析及防控对策探讨[J]. 中国科学基金, 2020, 34(4): 464 -469 . MA Zhonghua, CHEN Yun, YIN Yanni. Epidemiological analysis and management strategies of fusarium head blight of wheat[J]. Bulletin of National Natural Science Foundation of China, 2020, 34(4):464 -469 (in Chinese).[6] CHEN Y, KISTLER H C, MA Z. Fusarium graminearum trichothecene mycotoxins: biosynthesis, regulation, and management[J]. Annual Review of Phytopathology, 2019, 57: 15 -39 . doi: 10.1146/annurev-phyto-082718-100318[7] HOLANDA D M, KIM S W. Mycotoxin occurrence, toxicity, and detoxifying agents in pig production with an emphasis on deoxynivalenol[J]. Toxins, 2021, 13(2): 171 . doi: 10.3390/toxins13020171[8] GHAREEB K, AWAD W A, BÖHM J, ZEBELI Q. Impacts of the feed contaminant deoxynivalenol on the intestine of monogastric animals: poultry and swine[J]. Journal of Applied Toxicology, 2015, 35(4): 327 -337 . doi: 10.1002/jat.3083[9] TU Y, LIU S, CAI P, SHAN T. Global distribution, toxicity to humans and animals, biodegradation, and nutritional mitigation of deoxynivalenol: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2023, 22(5): 3951 -3983 . doi: 10.1111/1541-4337.13203[10] HUANG P, YU X, LIU H, DING M, WANG Z, XU J R, JIANG C. Regulation of TRI5 expression and deoxynivalenol biosynthesis by a long non-coding RNA in Fusarium graminearum[J]. Nature Communications, 2024, 15(1): 1216 . doi: 10.1038/s41467-024-45502-w[11] 魏润蕴, 李文艳. 小麦中雪腐镰刀菌烯醇(NIV)和脱氧雪腐镰刀菌烯醇(DON)的薄层色谱测定方法[J]. 中国食品卫生杂志, 1994, 6(1): 19 -22 . WEI Runyun, LI Wenyan. Thin layer chromatography method for the determination of NIV and DON in wheat[J]. Chinese Journal of Food Hygiene, 1994, 6(1):19 -22 (in Chinses).[12] SIMOES C T, VIDAL J K, SILVA C D R D, SARTURI J A, LABER I F, MADALOSSO T, MALLMANN C A. A two-year study on the occurrence and concentration of mycotoxins in corn varieties with different endosperm textures[J]. Journal of the Science of Food and Agriculture, 2023, 103(14): 7 199-7 206. [13] WANG R, LI M, JIN R, LIU Y, GUAN E, MOHAMED S R, BIAN K. Interactions among the composition changes in fungal communities and the main mycotoxins in simulated stored wheat grains[J]. Journal of the Science of Food and Agriculture, 2024, 104(1): 373 -382 . doi: 10.1002/jsfa.12928[14] LI Y, SHI W, SHEN J, ZHANG S, CHENG L, WANG Z. Development of a rapid competitive indirect ELISA procedure for the determination of deoxynivalenol in cereals[J]. Food and Agricultural Immunology, 2012, 23(1): 41 -49 . doi: 10.1080/09540105.2011.589046[15] HAN L, LI Y T, JIANG J Q, LI R F, FAN G Y, LV J M, ZHOU Y, ZHANG W J, WANG Z L. Development of a direct competitive ELISA kit for detecting deoxynivalenol contamination in wheat[J]. Molecules, 2019, 25(1): 50 . doi: 10.3390/molecules25010050[16] TIAN M, XIE W, ZHANG T, LIU Y, LU Z, LI C M, LIU Y. A sensitive lateral flow immunochromatographic strip with Prussian blue nanoparticles mediated signal generation and cascade amplification[J]. Sensors and Actuators B: Chemical, 2020, 309: 127 728. [17] LIU Z, HUA Q, WANG J, LIANG Z, LI J, WU J, SHEN X, LEI H, LI X. A smartphone-based dual detection mode device integrated with two lateral flow immunoassays for multiplex mycotoxins in cereals[J]. Biosensors and Bioelectronics, 2020, 158: 112 178. [18] LI J, YAN H, TAN X, LU Z, HAN H. Cauliflower-inspired 3D SERS substrate for multiple mycotoxins detection[J]. Analytical Chemistry, 2019, 91(6): 3 885-3 892. [19] HE X, ZHAO T, SHEN F, LIU Q, FANG Y, HU Q. Online detection of naturally DON contaminated wheat grains from China using Vis-NIR spectroscopy and computer vision[J]. Biosystems Engineering, 2021, 201: 1 -10 . doi: 10.1016/j.biosystemseng.2020.11.001[20] WEI K, SUN J, GAO Q, YANG X, YE Y, JI J, SUN X. 3D “honeycomb” cell/carbon nanofiber/gelatin methacryloyl (GelMA) modified screen-printed electrode for electrochemical assessment of the combined toxicity of deoxynivalenol family mycotoxins[J]. Bioelectrochemistry, 2021, 139: 107 743. [21] WEI T, REN P, HUANG L, OUYANG Z, WANG Z, KONG X, LI T, YIN Y, WU Y, HE Q. Simultaneous detection of aflatoxin B1, ochratoxin A, zearalenone and deoxynivalenol in corn and wheat using surface plasmon resonance[J]. Food Chemistry, 2019, 300: 125 176. [22] THEISEN S, BERGER S. Screening of epoxide hydrolase producing microorganisms for biotransformation of deoxynivalenol[J]. Mycotoxin Research, 2005, 21(1): 71 -73 . doi: 10.1007/BF02954823[23] JIANG J, YUN Y, FU J, SHIM W B, MA Z. Involvement of a putative response regulator FgRrg-1 in osmotic stress response, fungicide resistance and virulence in Fusarium graminearum[J]. Molecular Plant Pathology, 2011, 12(5): 425 -436 . doi: 10.1111/j.1364-3703.2010.00684.x[24] DYER R B, PLATTNER R D, KENDRA D F, BROWN D W. Fusarium graminearum TRI14 is required for high virulence and DON production on wheat but not for DON synthesis in vitro[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9 281-9 287. [25] JIANG C, ZHANG C, WU C, SUN P, HOU R, LIU H, WANG C, XU J R. TRI6 and TRI10 play different roles in the regulation of deoxynivalenol (DON) production by cAMP signalling in Fusarium graminearum[J]. Environmental Microbiology, 2016, 18(11): 3 689-3 701. [26] CUOMO C A, GÜLDENER U, XU J R, TRAIL F, TURGEON B G, Di PIETRO A, WALTON J D, MA L J, BAKER S E, REP M, ADAM G, ANTONIW J, BALDWIN T, CALVO S, CHANG Y L, DECAPRIO D, GALE L R, GNERRE S, GOSWAMI R S, HAMMOND-KOSACK K, HARRIS L J, HILBURN K, KENNELL J C, KROKEN S, MAGNUSON J K, MANNHAUPT G, MAUCELI E, MEWES H W, MITTERBAUER R, MUEHLBAUER G, MÜNSTERKÖTTER M, NELSON D, O’DONNELL K, OUELLET T, QI W, QUESNEVILLE H, RONCERO M I G, SEONG K Y, TETKO I V, URBAN M, WAALWIJK C, WARD T J, YAO J, BIRREN B W, KISTLER H C. The Fusarium graminearum genome reveals a link between localized polymorphism and pathogen specialization[J]. Science, 2007, 317(5 843): 1 400-1 402. [27] PROCTOR R H, HOHN T M, McCORMICK S P. Reduced virulence of Gibberella zeae caused by disruption of a trichothecene toxin biosynthetic gene[J]. Molecular Plant-Microbe Interactions, 1995, 8(4): 593 -601 . doi: 10.1094/MPMI-8-0593[28] DUAN K, SHEN Q, WANG Y, XIANG P, SHI Y, YANG C, JIANG C, WANG G, XU J R, ZHANG X. Herbicide 2,4-dichlorophenoxyacetic acid interferes with MAP kinase signaling in Fusarium graminearum and is inhibitory to fungal growth and pathogenesis[J]. Stress Biology, 2023, 3(1): 31 . doi: 10.1007/s44154-023-00109-x -


 首页
首页 登录
登录 注册
注册



 下载:
下载: