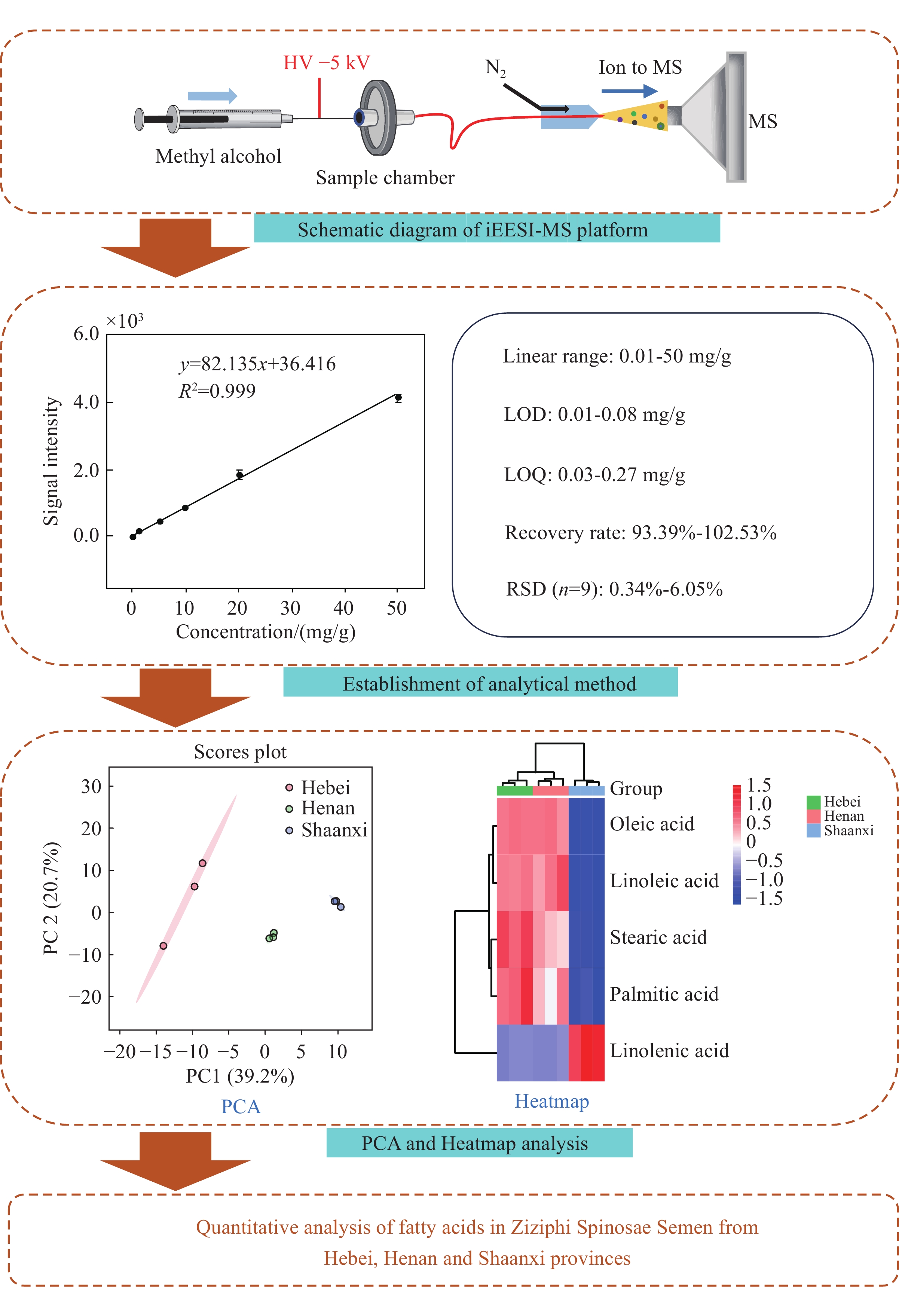
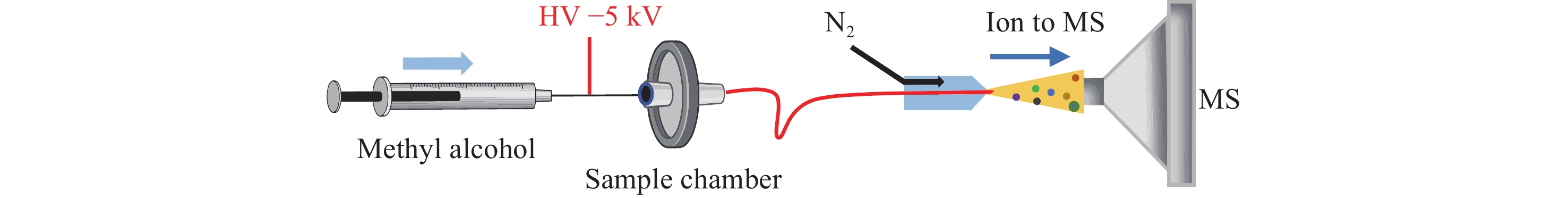
-
酸枣仁为鼠李科植物酸枣Ziziphus jujuba Mill. var. spinosa (Bunge) Hu ex H.F.Chou的干燥成熟种子[1]。由于酸枣树的适应性强,能够在不同环境条件下生长,使得酸枣仁的产地分布非常广泛,尤其是河北、陕西、河南等省份的酸枣仁具有较高的药用价值,临床上主要用于镇静[2]、调节免疫[3]以及调理神经系统[4]等。近年来,酸枣仁显著的药效逐渐被人们所熟知,其需求量一度增大,市场上开始出现了假冒伪劣产品[5]。研究表明,酸枣仁的药用价值很大一部分来源于丰富的不饱和脂肪酸[6],如油酸、亚油酸、亚麻酸等,这些脂肪酸能够增强心脏活性[7]、降低胆固醇水平[8]、维持皮肤健康[9]、缓解焦虑[10]、调节食欲[11]、抗高血压[12],对人体健康有着诸多方面的调节作用。因此,建立酸枣仁中脂肪酸的快速、准确检测方法,对酸枣仁的质量控制有着重要意义。
目前,生物样品中脂肪酸含量的检测方法主要有气相色谱-质谱(GC-MS)法[13-14]、高效液相色谱-质谱(HPLC-MS)法[15]、近红外光谱(NIRS)法[16]、核磁共振波谱(NMR)法[17]等。其中,GC-MS、HPLC-MS灵敏度高,但需要将脂肪酸甲酯化形成脂肪酸甲酯才能被质谱检测,耗时且复杂;NIRS无法准确定量分析且灵敏度较低;NMR操作繁琐、设备维护难度大,限制了其应用范围[18]。
内部萃取电喷雾电离质谱(iEESI-MS)是一种常压质谱技术,能够在无需样品预处理的情况下直接对样品进行质谱分析。首先,高压下的萃取剂作为能荷转移的载体,经毛细管引入到固体样品内部[19],促进能荷转移到样品基质的目标分子中,使其发生萃取、电荷转移等过程,从而实现对样品中特定化学成分的选择性萃取[20]。iEESI-MS具有无需样品预处理、操作简便、分析速度快等优点,且能够直接分析生物体组织等复杂基质,最大程度保留样品的原始状态,减少分析过程中的成分损失,广泛应用于生物样本检测[21]、食品安全检测[22]、环境监测[23]等领域。
本研究基于iEESI-MS技术建立酸枣仁脂肪酸的快速、准确分析方法,旨为中药材中脂肪酸检测提供方法参考。
-
内部萃取电喷雾电离源:本实验室自制,示于图1;LTQ-XL型线性离子阱质谱仪:美国Thermo Scientific公司产品,配有Xcalibur数据处理系统;微量注射泵:保定兰格恒流泵有限公司产品;FA1004B型电子天平:上海精密科学仪器有限公司产品;FW135型中药粉碎机:天津市泰斯特仪器有限公司产品;Smart-DUVF综合型超纯水机:上海和泰仪器有限公司产品。
-
酸枣仁:购自正规中药材市场,经江西中医药大学中药炮制学科组鉴定为鼠李科植物酸枣(Ziziphus jujuba var. spinosa)的干燥成熟种子;甲醇(色谱纯):德国默克公司产品;高纯氮气(纯度99.999%):南昌国滕气体有限公司产品;超纯水(电阻率18.2 MΩ·cm):由上海和泰仪器有限公司的超纯水机制得。
分别称取10.0 mg脂肪酸标准样品,加入1 mL甲醇,配制成10 g/L标准溶液母液。按照梯度稀释法,将5种脂肪酸标准溶液母液依次稀释至不同浓度,然后取20 µL每个标准溶液加入2.0 mg样品中,待检测,详细情况列于表1。
-
精确称取2.0 mg酸枣仁粉末,用滤纸包裹,置于样品仓中。萃取剂甲醇带−5 kV高压电,以10 μL/min流速通过毛细管注入样品仓,对酸枣仁中的脂肪酸成分进行萃取。
-
负离子模式检测,质量扫描范围m/z 50~300,电离电压−5 kV,离子传输管温度400 ℃,毛细管电压−30 V,透镜电压−110 V,电喷雾溶剂流速10 μL/min,雾化气(N2)压强0.6 MPa。在串联质谱检测时,母离子隔离宽度1.0 u,碰撞能量6%,活化值Q为0.25,碰撞时间40 ms,其他检测参数由LTQ-Tune系统自动优化。
-
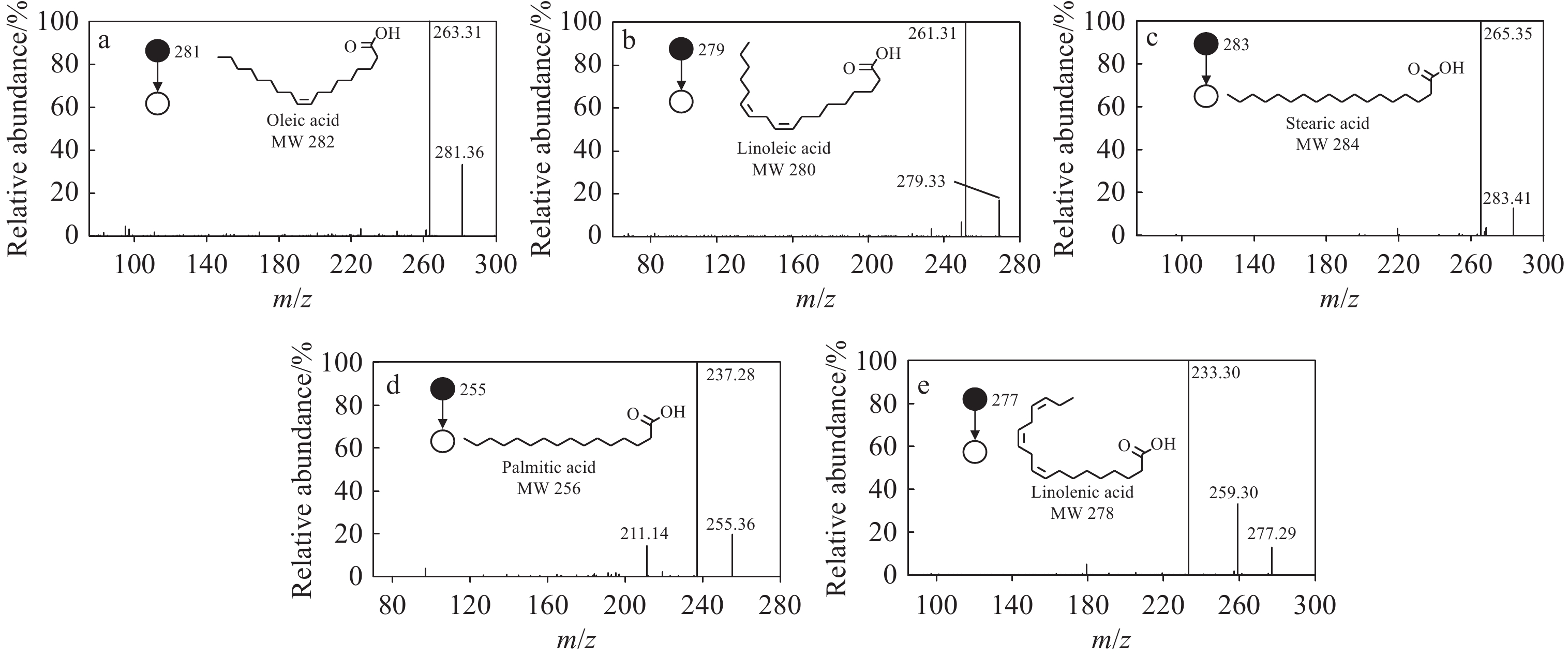
取20 µL 10 g/L油酸、亚油酸、硬脂酸、软脂酸、亚麻酸标准溶液滴加到滤纸上,放入样品仓中进行iEESI-MS定性分析。在负离子模式下,可检测到m/z 281、279、283、255、277离子峰,分别为油酸、亚油酸、硬脂酸、软脂酸、亚麻酸去质子化准分子离子峰。为避免假阳性结果,对m/z 281、279、283、255、277进行碰撞诱导解离分析,可检测到m/z 263、261、265、237、233特征离子碎片,示于图2,与文献[24]报道一致。其中,m/z 263、261、265、237分别为去质子化油酸、亚油酸、硬脂酸、软脂酸丢失1分子水而形成,m/z 233为去质子化亚麻酸丢失CO2而形成,表明采用iEESI-MS技术可以实现脂肪酸的检测。
-
为使酸枣仁在iEESI-MS条件下的分析效果达到最佳,本实验对萃取剂种类、离子传输管温度、喷雾电压和萃取剂流速进行优化。由于5种脂肪酸的质谱行为未必一致,故对其进行综合分析,采用5种脂肪酸二级定量离子的3次平均信号强度进行条件优化。
-
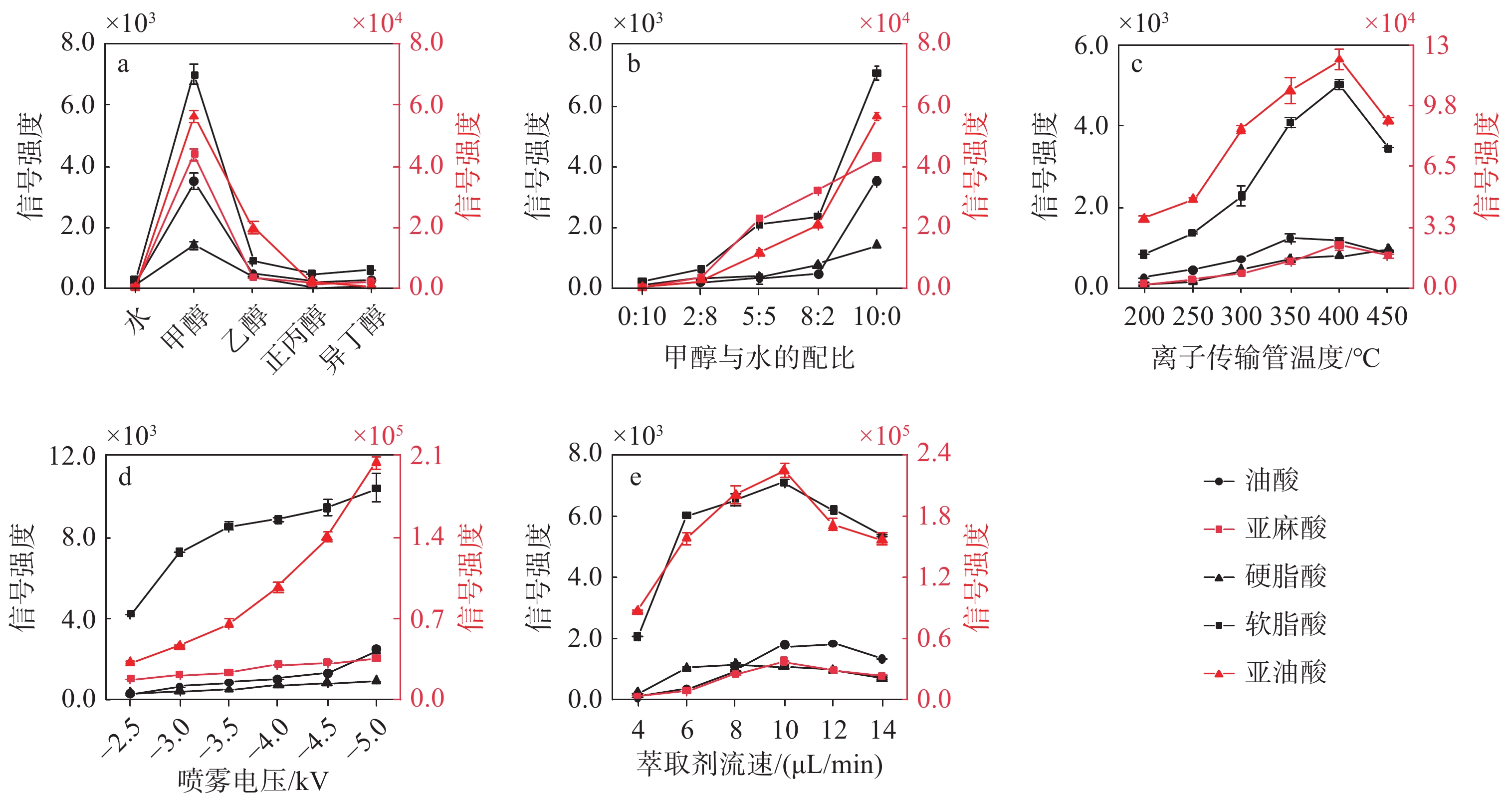
本实验所使用的萃取剂既可作为解吸液,将脂肪酸从酸枣仁中解吸出来,也可作为电喷雾溶液,且不同萃取剂对样品的提取效果相差甚大,选择水、甲醇、乙醇、正丁醇、异丙醇作为考察对象,对萃取剂种类进行优化,结果示于图3a。可见,当甲醇作为萃取剂时,5种脂肪酸的信号强度均最高。考虑到萃取剂的选择可能影响方法的灵敏度,从而间接影响实验结果的精度和可靠性,分别采用不同配比(0:10,2:8,5:5,8:2,10:0)的甲醇-水溶液作为萃取剂对5种脂肪酸进行iEESI-MS检测。可见随着甲醇比例的提高,二级离子的信号强度呈上升趋势,示于图3b。当甲醇含量达100%时,5种脂肪酸目标离子的信号强度均为最高值,对样品的萃取效果最好。因此,选择纯甲醇作为萃取剂。
-
离子传输管温度决定了离子去溶剂化效率,影响目标离子的信号强度。当离子传输管温度从200 ℃升至400 ℃时,亚油酸、软脂酸、亚麻酸3种脂肪酸的信号强度达到最高,随即开始下降;相比之下,油酸信号强度在350 ℃时达到最高,在350~400 ℃时略微下降,大于400 ℃时呈明显下降趋势;硬脂酸的信号强度随着温度的升高始终呈上升趋势,示于图3c。考虑到极高的温度(>450 ℃)会导致脂肪酸分子发生热解离,使信号强度下降,且会使仪器线圈受损。综合对比5种脂肪酸的去溶剂化效率,选择离子传输管温度为400 ℃。
-
喷雾电压对质谱信号强度有着显著影响,示于图3d。当喷雾电压从−2.5 kV开始增加时,5种脂肪酸目标离子的信号强度均逐渐增加,随着喷雾电压的持续升高,会产生更多的二级离子;当电压升高至−5 kV时,目标离子的信号强度进一步提高。出于安全性考虑,本实验没有测试高于−5 kV的电压。因此,选择−5 kV作为电喷雾电压。
-
为了获得更高的萃取效率和电离效率,本实验考察了4、6、8、10、12、14 μL/min萃取剂流速对质谱信号强度的影响,示于图3e。随着萃取剂流速从4 μL/min增加到8 μL/min,5种脂肪酸目标离子的信号强度均逐渐增强;当流速从8 μL/min增大至10 μL/min时,油酸、亚油酸、亚麻酸、软脂酸的信号强度继续增强,其中亚油酸、软脂酸、亚麻酸的信号强度从最高点10 μL/min开始下降,可能由于流速过快,导致离子化效率降低;油酸在10、12 μL/min时的信号强度相差很小;硬脂酸的二级离子信号强度在8 μL/min时达到最佳,但与10 μL/min时的信号强度相差不大,优势不明显。因此,选择萃取剂流速为10 μL/min。
-
以河北产地酸枣仁为样品,滴加不同浓度的脂肪酸标准溶液,采用iEESI-MS测定,选择油酸、亚油酸、硬脂酸、软脂酸、亚麻酸的二级特征碎片离子作为定量离子进行分析。以脂肪酸含量为横坐标,目标离子的3次平均质谱信号强度为纵坐标绘制定量曲线,使用相关系数(R2)评估标准曲线的线性关系。
称取2.0 mg酸枣仁粉末,用滤纸包裹放入样品仓,吸取20 μL不同浓度的标准溶液,滴加在酸枣仁粉末上。根据公式C=C1×20×10−3/2.0×10−3,计算得到滴加脂肪酸标准溶液后酸枣仁样品中脂肪酸标准样品的浓度(C为滴加脂肪酸标准溶液后酸枣仁样品中脂肪酸标准样品的浓度,即mg/g;C1为表1中脂肪酸标准溶液浓度,即g/L)。以5.00 g/L油酸标准溶液为例,向2.0 mg酸枣仁粉末中加入20 μL脂肪酸标准溶液,即酸枣仁中油酸标准溶液的最终浓度为50.00 mg/g。此外,考虑到酸枣仁样品原有脂肪酸本底值对检测的影响,故标准曲线各浓度的信号强度均已减去原有酸枣仁样品本底值的信号强度。分别以3倍和10倍信噪比(S/N)计算方法的检出限(LOD)[25]和定量限(LOQ)[26],结果列于表2。可见,油酸、亚油酸、亚麻酸、硬脂酸4种脂肪酸在0.01~50.00 mg/g浓度范围内的线性关系良好,软脂酸在0.01~20.00 mg/g浓度范围内的线性关系良好,R2值均在0.992~0.999之间,表明iEESI-MS法可以满足同时检测酸枣仁中5种脂肪酸的要求。
-
为了测试上述标准曲线的可靠性,进行加标回收实验。对于每种脂肪酸,分别采用3个不同的加标量,即2.00、10.00、50.00 mg/g油酸,20.00、30.00、45.00 mg/g亚油酸,0.20、1.00、5.00 mg/g亚麻酸,2.00、10.00、50.00 mg/g硬脂酸,1.00、4.00、16.00 mg/g软脂酸,每个加标量分析3次,得到5种脂肪酸不同浓度的加标回收率,结果列于表3。可见,平均回收率在93.39%~102.53%之间,相对标准偏差(RSD)均低于6.05%,表明该方法的精密度和重复性良好。
-
为了获得酸枣仁样品中脂肪酸的定量信息,采用iEESI-MS法直接测定河北、河南、陕西3个不同产地酸枣仁的5种脂肪酸含量。通过碰撞诱导解离(CID)检测,分别得到二级离子的净响应信号强度;通过脂肪酸溶液的标准曲线,由线性回归方程计算出酸枣仁中每种脂肪酸的具体含量,分别进行3次平行测定,结果列于表4。可见,不同产地酸枣仁中主要的脂肪酸为亚油酸和油酸,与文献报道[27]一致。
-
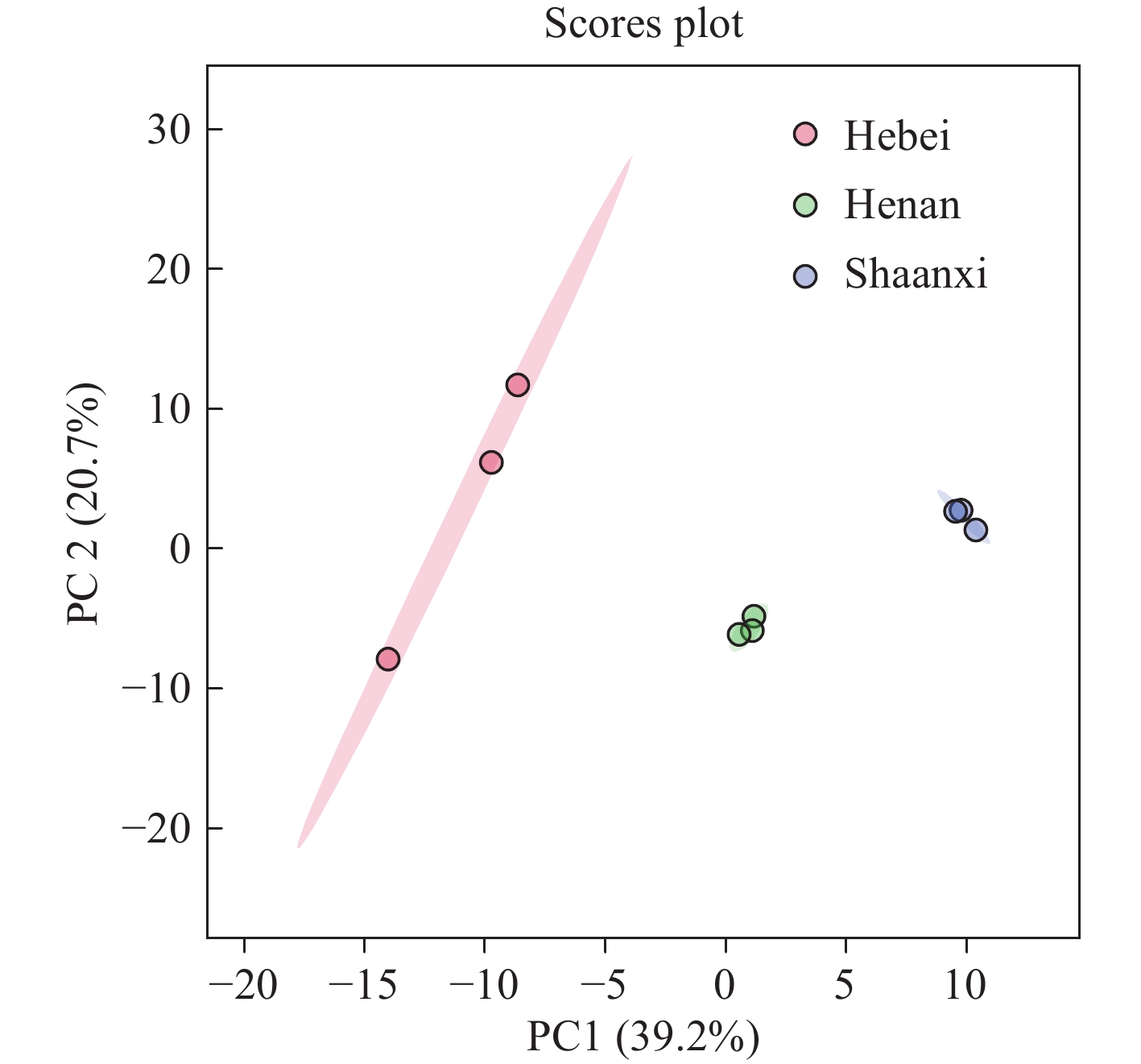
为了分析不同产地酸枣仁中脂肪酸含量的差异,本研究采用主成分分析(PCA)比较了河北、河南、陕西3个产地的5种脂肪酸含量,结果示于图4。PCA评分图显示,三地样品的脂肪酸分布存在显著差异;河北样品的组内差异较大,而河南和陕西样品的组内相似度较高。PC1和PC2的方差贡献率分别为39.2%和20.7%,表明第一主成分(PC1)在解释样品间的差异性方面具有重要作用。在PC1轴上,河南与陕西样品呈正向分布,而河北样品呈负向分布,且3组样品之间的差异显著。
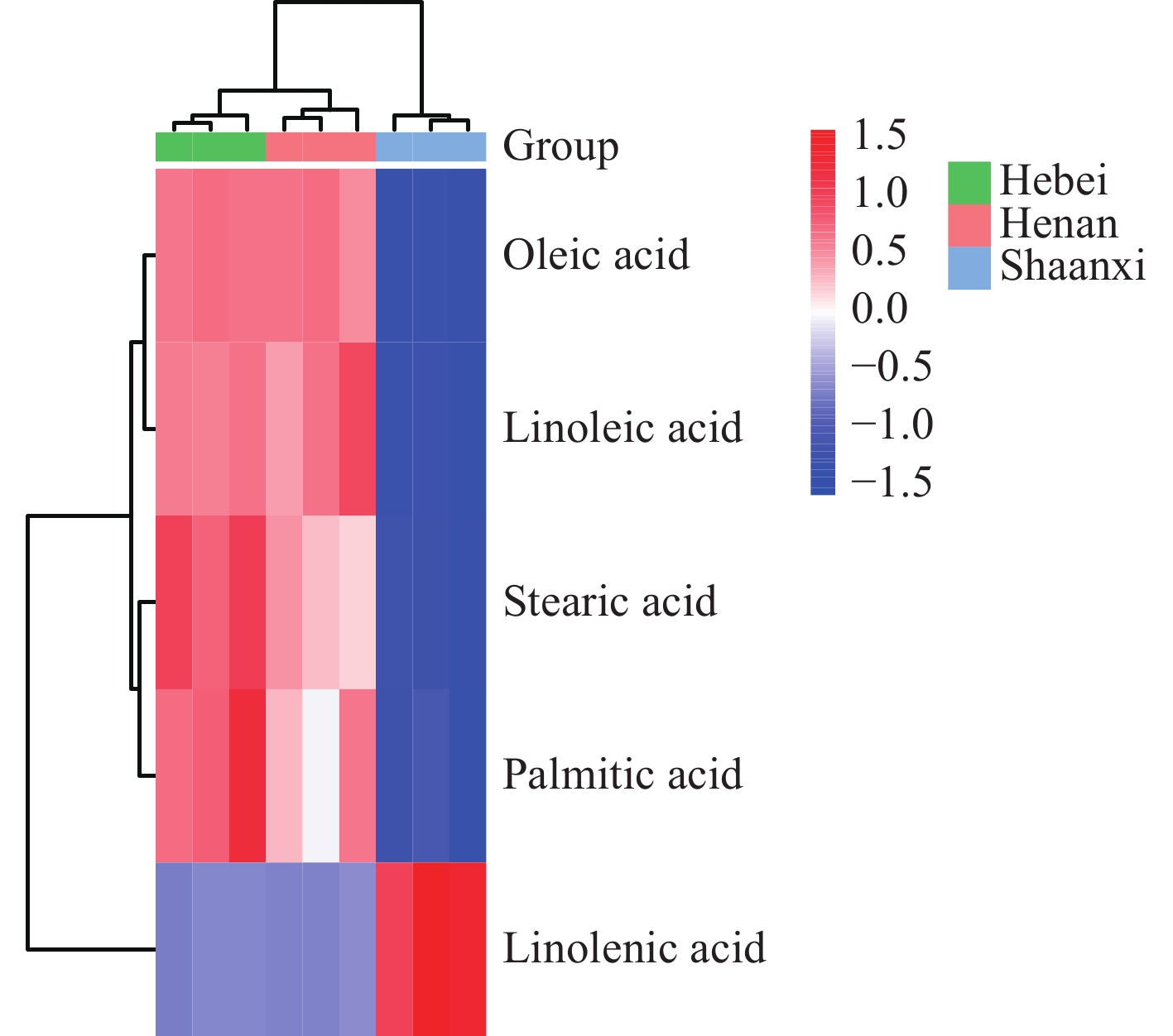
为进一步分析5种脂肪酸在不同产地之间的差异,选择河北、河南、陕西3个产地的酸枣仁进行分析,并描绘热图,结果示于图5。总体来说,不同产地酸枣仁中脂肪酸含量不一致;河北、河南产地酸枣仁中油酸、亚油酸、硬脂酸、软脂酸含量高于陕西;陕西产地酸枣仁中亚麻酸含量高于河北、河南,且脂肪酸总含量偏低。文献[28]表明,酸枣仁的脂肪酸含量与其仁厚度呈正相关,陕西产地的酸枣仁普遍厚度偏小、成分功能含量低,这与本研究的结论基本一致。同时,不同产地酸枣仁脂肪酸含量的差异反映了其药效品质与产地存在较大的关联性。
-
本研究通过对萃取剂种类、离子传输管温度、喷雾电压和萃取剂流速等条件进行优化和方法学考察,建立了iEESI-MS法直接测定不同产地酸枣仁中脂肪酸含量。该方法操作简单、分析速度快,解决了GC-MS等传统检测方法预处理时间长的问题,实现了对酸枣仁脂肪酸的直接定性和定量分析。将该方法应用于河北、河南和陕西产地的酸枣仁分析,可为酸枣仁的质量控制提供思路。
内部萃取电喷雾电离质谱法快速测定不同产地酸枣仁中脂肪酸含量
Rapid Determination of Fatty Acids in Ziziphi Spinosae Semen from Different Origins by Internal Extractive Electrospray Ionization Mass Spectrometry
-
摘要: 酸枣仁是经典中药材,其品质与所含脂肪酸有关。本文建立了内部萃取电喷雾电离质谱(iEESI-MS)法同时测定不同产地酸枣仁中亚油酸、油酸、亚麻酸、硬脂酸、软脂酸等脂肪酸含量。通过对萃取剂种类、离子传输管温度、喷雾电压和萃取剂流速等参数进行优化,5种脂肪酸在0.01~50.00 mg/g浓度范围内的线性关系良好,相关系数(R2)大于0.992,方法检出限(LOD)和定量限(LOQ)分别为0.01~0.08 mg/g和0.03~0.27 mg/g,平均回收率在93.39%~102.53%之间,相对标准偏差(RSD,n=3)均低于6.05%。经主成分分析(PCA)和热图分析发现,河北、河南和陕西3个产地酸枣仁的品质差异与脂肪酸含量差异一致。该方法无需样品预处理、灵敏度高、通量高,可用于不同产地酸枣仁中脂肪酸的直接、快速、定量分析。
-
关键词:
- 内部萃取电喷雾电离质谱(iEESI-MS) /
- 酸枣仁 /
- 脂肪酸 /
- 快速测定
Abstract: Ziziphi Spinosae Semen is a traditional Chinese herbal medicine, which has attracted increasing attention for its unique medicinal value and nutritional effects, and occupies a pivotal position in Chinese traditional medicine. In the clinic, it is mainly used to sedate, modulate the immune and nervous systems. In recent years, due to the increasing demand of Ziziphi Spinosae Semen, numerous counterfeit and inferior products have emerged in the market, posing a significant threat to human health. Therefore, evaluation of the quality of Ziziphi Spinosae Semen is important for its safety and efficacy. Researches have indicated that the medicinal value of Ziziphi Spinosae Semen is attributed to its abundant fatty acid components. In this study, a method of internal extractive electrospray ionization mass spectrometry (iEESI-MS) was established for simultaneous quantification of five fatty acids, including linoleic acid, oleic acid, linolenic acid, stearic acid, and palmitic acid in Ziziphi Spinosae Semen from various origins. After the conditions were optimized, methanol was chosen as the extraction solvent, the temperature of the ion transport tube was set at 400 ℃, and the spray voltage was fixed at −5 kV. The flow rate of the extraction solvent was set to 10 μL/min. The analysis was carried out under negative ion mode with mass scanning of m/z 50-300. The results showed that the linear relationships of these fatty acids are good within the range of 0.01-50.00 mg/g, with the correlation coefficient (R²) exceeding 0.992. The limits of detection (LODs) and limits of quantification (LOQs) are 0.01-0.08 mg/g and 0.03-0.27 mg/g, respectively. The average recoveries are 93.39%-102.53%, with the relative standard deviations (RSD, n=3) of all fatty acids below 6.05%. Principal component analysis (PCA) and heat map analysis revealed that quality differences among Ziziphi Spinosae Semen sourced from Hebei, Henan, and Shaanxi correspond to variations in their fatty acid contents. This method has the advantages of no needing sample pretreatment, high sensitivity, and high throughput, which can rapidly quantify the contents of fatty acids of Ziziphi Spinosae Semen in different sources. -

-
表 1 5种脂肪酸标准溶液浓度
Table 1. Concentrations of five fatty acid standard solutions
序号
No.脂肪酸
Fatty acid浓度
Concentration/(g/L)1 油酸 0.001, 0.01, 0.10, 0.50, 1.00, 2.00, 5.00 2 亚油酸 0.001, 0.01, 0.10, 0.50, 1.00, 2.00, 5.00 3 亚麻酸 0.001, 0.01, 0.10, 0.50, 1.00, 2.00, 5.00 4 硬脂酸 0.001, 0.10, 0.50, 1.00, 2.00, 5.00 5 软脂酸 0.001, 0.01, 0.10, 0.50, 1.00, 2.00 表 2 5种脂肪酸的回归方程、检出限和定量限
Table 2. Regression equations, LODs and LOQs of five FAs
序号
Number样本
Sample线性范围
Linear range/(mg/g)回归方程
Regression equation相关系数
Correlation coefficient (R2)检出限
LOD/(mg/g)定量限
LOQ/(mg/g)1 油酸 0.01~50.00 y=196.26x+53.86 0.999 0.04 0.15 2 亚油酸 0.01~50.00 y=651.52x+347.71 0.998 0.01 0.03 3 亚麻酸 0.01~50.00 y=82.135x+36.416 0.999 0.03 0.10 4 硬脂酸 0.01~50.00 y=38.159x−19.395 0.992 0.08 0.27 5 软脂酸 0.01~20.00 y=41.717x+10.655 0.999 0.07 0.22 表 3 加标样品的测定结果(n=3)
Table 3. Analytical results of spiked samples (n=3)
样本
Sample本底值
Background value/(mg/g)加标量
Added value/(mg/g)测定值
Measured value/(mg/g)回收率
Recovery/%相对标准偏差
RSD/%油酸 23.20 2.00 25.19 99.58 5.93 10.00 32.61 94.10 1.33 50.00 74.47 102.53 0.51 亚油酸 30.37 20.00 50.65 101.43 1.75 30.00 59.57 97.35 6.05 45.00 73.36 95.54 0.38 亚麻酸 0.45 0.20 0.65 98.08 1.19 1.00 1.42 96.72 2.31 5.00 5.27 96.42 1.13 硬脂酸 14.65 2.00 16.65 99.44 1.54 10.00 24.38 97.25 2.41 50.00 61.36 93.39 0.34 软脂酸 6.13 1.00 7.09 95.94 2.22 4.00 10.11 99.49 1.06 16.00 21.69 97.29 1.30 表 4 不同产地样品的分析结果(n=3)
Table 4. Analytical results of samples from different origins (n=3)
产地
Place of production油酸 Oleic acid 亚油酸 Linoleic acid 亚麻酸 Linolenic acid 软脂酸 Palmitic acid 硬脂酸 Stearic acid 含量
Content/
(mg/g)相对
标准偏差
RSD/%含量
Content/
(mg/g)相对
标准偏差
RSD/%含量
Content/
(mg/g)相对
标准偏差
RSD/%含量
Content/
(mg/g)相对
标准偏差
RSD/%含量
Content /
(mg/g)相对
标准偏差
RSD/%河北 30.24 37.78 0.21 8.23 12.43 30.12 0.42 38.04 0.50 0.20 3.41 8.30 0.87 12.46 0.32 29.98 37.67 0.20 8.37 12.51 河南 26.26 46.26 0.25 7.15 6.09 26.63 0.79 46.00 0.42 0.25 2.76 7.15 0.39 5.75 2.96 26.60 45.88 0.26 7.20 5.85 陕西 19.19 11.88 0.48 3.98 4.07 19.09 0.27 11.78 1.28 0.48 1.45 4.01 1.60 4.10 1.35 19.14 12.08 0.49 3.89 3.99 -
[1] WANG D, HO C T, BAI N. Ziziphi Spinosae Semen: an updated review on pharmacological activity, quality control, and application[J]. Journal of Food Biochemistry, 2022, 46(7): e14153. [2] ZHU C, ZHANG Z, WANG S, SUN Z. Study on the mechanism of Gastrodiae Rhizoma, Lycii Fructus, and Ziziphi Spinosae Semen in sedation and tranquillising mind[J]. Molecular Diversity, 2024, 28(5): 3 279-3 294. [3] XIE J, GUO L, PANG G, WU X, ZHANG M. Modulation effect of Semen Ziziphi Spinosae extracts on IL-1β, IL-4, IL-6, IL-10, TNF-α and IFN-γ in mouse serum[J]. Natural Product Research, 2011, 25(4): 464 -467 .[4] ZHANG M, LIU J, ZHANG Y, XIE J. Ziziphi Spinosae Semen: a natural herb resource for treating neurological disorders[J]. Current Topics in Medicinal Chemistry, 2022, 22(17): 1 379-1 391. [5] 刘薇, 李明华, 余坤子, 程显隆, 魏锋, 马双成. 中药酸枣仁的真伪鉴别方法研究[J]. 药物分析杂志, 2015, 35(9): 1 629-1 634. LIU Wei, LI Minghua, YU Kunzi, CHENG Xianlong, WEI Feng, MA Shuangcheng. Quality analysis of Ziziphi Spinosae Semen and identification of adulterants[J]. Chinese Journal of Pharmaceutical Analysis, 2015, 35(9): 1 629-1 634(in Chinese). [6] DU C, HAN R, WU J, ZHAO N, PEI X, QIN X, YAN Y. Study on the antidepressive effects and mechanism of raw and fried Ziziphi Spinosae Semen via metabolomics and gut microbiota analysis[J]. Biomedical Chromatography, 2024, 38(7): e5873. [7] XIE J, ZHANG Y, WANG L, QI W, ZHANG M. Composition of fatty oils from Semen Ziziphi Spinosae and its cardiotonic effect on isolated toad hearts[J]. Natural Product Research, 2012, 26(5): 479 -483 .[8] ABDO A, ZHANG C, AL-DALALI S, HOU Y, GAO J, YAHYA M A, SALEH A, ALERYANI H, AL-ZAMANI Z, SANG Y. Marine chitosan-oligosaccharide ameliorated plasma cholesterol in hypercholesterolemic hamsters by modifying the gut microflora, bile acids, and short-chain fatty acids[J]. Nutrients, 2023, 15(13): 2 923. [9] SIMARD M, TREMBLAY A, MORIN S, MARTIN C, JULIEN P, FRADETTE J, FLAMAND N, POULIOT R. α-Linolenic acid and linoleic acid modulate the lipidome and the skin barrier of a tissue-engineered skin model[J]. Acta Biomaterialia, 2022, 140: 261 -274 .[10] ZHAO X, YU D, ZHOU W, YU L, ZHOU H, LIU Y, GUO Z, SHEN A, HAN Z, WANG C, WANG J, LIANG X. Chemical profiling of Ziziphi Spinosae Semen using on-line comprehensive two-dimensional liquid chromatography-mass spectrometry based on a novel phthalic anhydride bonded stationary phase[J]. Journal of Separation Science, 2023, 46(10): 2 200 704. [11] MORADI S, ALIVAND M, KHAJEBISHAK Y, ASGHARIJAFARABADI M, ALIPOUR M, CHILIBECK P D, ALIPOUR B. The effect of omega3 fatty acid supplementation on PPARγ and UCP2 expressions, resting energy expenditure, and appetite in athletes[J]. BMC Sports Science, Medicine & Rehabilitation, 2021, 13(1): 48. [12] IMIG J D. Bioactive lipids in hypertension[J]. Advances in Pharmacology, 2023, 97: 1 -35 .[13] MORANO C, DEI CAS M, BERGAMASCHI R F, PALMISANO E, PALLAVICINI M, BOLCHI C, RODA G, CASATI S. Fractioning and compared 1H NMR and GC-MS analyses of lanolin acid components[J]. Molecules, 2023, 28(4): 1 635. [14] LI Y J, BI K S, LIANG X M, XIAO H B. Analysis of fatty oil in Semen Ziziphi Spinosae by capillary gas chromatography[J]. Journal of Chromatographic Science, 2003, 41(1): 41 -43 .[15] YOUNIS I Y, KHATTAB A R, SELIM N M, SOBEH M, ELHAWARY S S, BISHBISHY M H E. Metabolomics-based profiling of 4 avocado varieties using HPLC-MS/MS and GC/MS and evaluation of their antidiabetic activity[J]. Scientific Reports, 2022, 12(1): 4 966. [16] GARCÍA MARTÍN J F. Potential of near-infrared spectroscopy for the determination of olive oil quality[J]. Sensors, 2022, 22(8): 2 831. [17] QIAN J, ZHAO C, ZHU H, TONG J, ZHAO X, YANG H, GUO H. NMR detection of fatty acidscontent in walnut oil and compared with liquid chromatography[J]. Journal of Food Measurement and Characterization, 2021, 15(3): 2 716-2 726. [18] BAVISKAR K P, JAIN D V, PINGALE S D, WAGH S S, GANGURDE S P, SHARDUL S A, DAHALE A R, JAIN K S. A review on hyphenated techniques in analytical chemistry[J]. Current Analytical Chemistry, 2022, 18(9): 956 -976 .[19] 陈焕文. 内部萃取电喷雾电离质谱研究进展[C]//2018年中国质谱学术大会(CMSC 2018)论文集. 广州, 2018: 225. [20] QIN M, QIAN Y, HUANG L, ZHONG C, LI M, YU J, CHEN H. Extractive electrospray ionization mass spectrometry for analytical evaluation and synthetic preparation of pharmaceutical chemicals[J]. Frontiers in Pharmacology, 2023, 14: 1 110 900. [21] ZHANG H, CHINGIN K, LI J, LU H, HUANG K, CHEN H. Selective enrichment of phosphopeptides and phospholipids from biological matrixes on TiO2 nanowire arrays for direct molecular characterization by internal extractive electrospray ionization mass spectrometry[J]. Analytical Chemistry, 2018, 90(20): 12 101-12 107. [22] XIAO Y P, LU H Y, LÜ S J, XIE S X, WANG Z Z, CHEN H W. Rapid analysis of trace salbutamol and clenbuterol in pork samples by mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2016, 44(11): 1 633-1 638. [23] KOU W, ZHANG H, BIBI A, KE M, HAN J, XIONG J, SU R, LIANG D. Fast quantification of fluoroquinolones in environmental water samples using molecularly imprinted polymers coupled with internal extractive electrospray ionization mass spectrometry[J]. RSC Advances, 2018, 8(31): 17 293-17 299. [24] TAMURA P, FRUEHAN C, JOHNSON D K, HINKES P, WILLIAMS T D, WELTI R. Fatty acid composition by total acyl lipid collision-induced dissociation time-of-flight (TAL-CID-TOF) mass spectrometry[M]//Plant Lipids. New York, NY: Springer US, 2021: 117-133. [25] DING J, GU H, YANG S, LI M, LI J, CHEN H. Selective detection of diethylene glycol in toothpaste products using neutral desorption reactive extractive electrospray ionization tandem mass spectrometry[J]. Analytical Chemistry, 2009, 81(20): 8 632-8 638. [26] SHRIVASTAVA A, GUPTA V. Methods for the determination of limit of detection and limit of quantitation of the analytical methods[J]. Chronicles of Young Scientists, 2011, 2(1): 21 .[27] ZHAO J, LI S P, YANG F Q, LI P, WANG Y T. Simultaneous determination of saponins and fattyacids in Ziziphus jujuba (Suanzaoren) by high performance liquid chromatography-evaporative light scattering detection and pressurized liquid extraction[J]. Journal of Chromatography A, 2006, 1 108(2): 188-194. [28] 琚思伟. 陕北黄河沿岸酸枣种源研究[D]. 杨凌: 西北农林科技大学, 2023. -


 首页
首页 登录
登录 注册
注册



 下载:
下载: