-
氮元素既是生物体生长和代谢过程必需的主要营养元素,也是气候变化的敏感响应者和关键参与者[1-2]。相关研究表明[3-6],氮循环对温度等气候变化具有响应机制,在季节、亚轨道、轨道尺度上存在周期性变化。因此,精确测定自然环境中氮稳定同位素的变化,对于科学探究全球氮循环具有重要作用[7-8]。
通过元素分析仪-同位素质谱(EA-IRMS)基于高温燃烧(combustion method,CM)法分析固体样品,可同时测定总有机碳(TOC)、总氮(TN)含量及13C和15N同位素比值[9-11]。方法原理如下[12-13]:在元素分析仪燃烧炉富氧高温的氛围下,有机化合物经燃烧完全氧化为CO2、N2和H2O,含氮化合物在燃烧过程中形成少量的氮氧化合物(NOx),在后续的还原段被单质铜还原为N2,同时过量的O2被吸收,除去水蒸气后,经色谱柱分离出N2和CO2,依次进入同位素质谱仪分析。目前,基于EA-IRMS联用的碳、氮同位素在线分析技术已得到广泛应用。但相对于碳同位素,氮同位素比值测定的灵敏度通常较低,主要有以下几个原因:1)自然界中15N的自然丰度比13C低(15N、13C的丰度分别为0.36 atom %、1.11 atom %);2)有机化合物分子中氮含量通常远低于碳含量,如沉积物中氮含量只有碳含量的约1/10;3)形成1 mol N2分子需要2 mol氮原子;4)N2的离子化概率低于CO2的离子化概率;5)空气中的N2含量较高,即使是微小的气体泄漏,也会导致背景值偏高;6)氮同位素测定时存在同量异位素干扰。当有机化合物燃烧生成CO2,在离子源中形成CO2+,其发生单分子分解产生[CO]+碎片,12C16O+和13C16O+分别是14N2+和14N15N+的同量异位素干扰,质荷比分别为m/z 28、29。此外,含氢物质(如H2O)与N2发生质子化反应,形成的N2H+会导致少量m/z 29离子束在检测时出现偏差。
应用EA-IRMS采用CM法测定氮同位素时,上述因素严重制约着同位素测试的精度和准确性。燃烧过程中样品转化不充分、氮氧化物未充分还原为N2、CO2离子化干扰以及氮本底过高等问题,都会不同程度影响15N的测试精度。Bahlmann等[14]对比了不同实验室间通过EA-IRMS测定海洋和湖泊沉积物中氮同位素的结果,研究表明,氮同位素的分析精度(1σ)平均约为±0.24‰,各实验室间的测试精度存在一定差异。Lott等[15]研究发现,对于一些含有氮氧化物的纯化学物质(包括无机材料如硝酸盐,以及有机材料如硝胺和硝酸酯),采用热分解法比燃烧法可获得更高的精度和准确度(1σ<0.2‰)。此外,有学者在研究燃烧转化率和碳、氮同位素时发现,使用反应管使燃烧转化率降低且填料Cu快速消耗,氮同位素比值出现偏负的现象,这可能是由于样品不完全燃烧时,其中较轻的同位素优先转化为气体,导致结果偏负[16-17]。在优化反应条件的基础上,Han等[18]使用EA-IRMS对富含有机物的油页岩样品氮同位素组成的测试方法进行优化,在确保样品完全氧化的情况下,其δ15N测量精度为±0.2‰(1σ)。Wang等[19]应用EA Isolink-IRMS单反应管模式对不同类型样品(包括纯品标准物质和低氮含量的海洋沉积物)的燃烧和还原条件进行优化,同时洗脱气流中的CO2,δ15N的测试精度可达±0.1‰(1σ)。另外,改善信噪比有助于提高氮同位素的测试精度[20]。Cui等[21]将EA燃烧反应产物通过5A分子筛和液氮冷阱,经GasBench进入同位素质谱,实现了nmol级别微量氮的精确分析;尹希杰等[22]通过优化氧化管和还原管的管径以及色谱柱等条件,有效降低了EA-IRMS测试固体样品的检出限,显著提高了δ15N的测试精度;Zhong等[23]通过减小EA-IRMS系统反应管和除水阱的体积、调整载气流速、增加气体入口分流比等措施,实现了最低12 μg的氮同位素分析,精度可达±0.2‰。上述研究均表明,测定氮同位素时,样品的燃烧和还原条件等反应参数对氮同位素的精确测定至关重要。
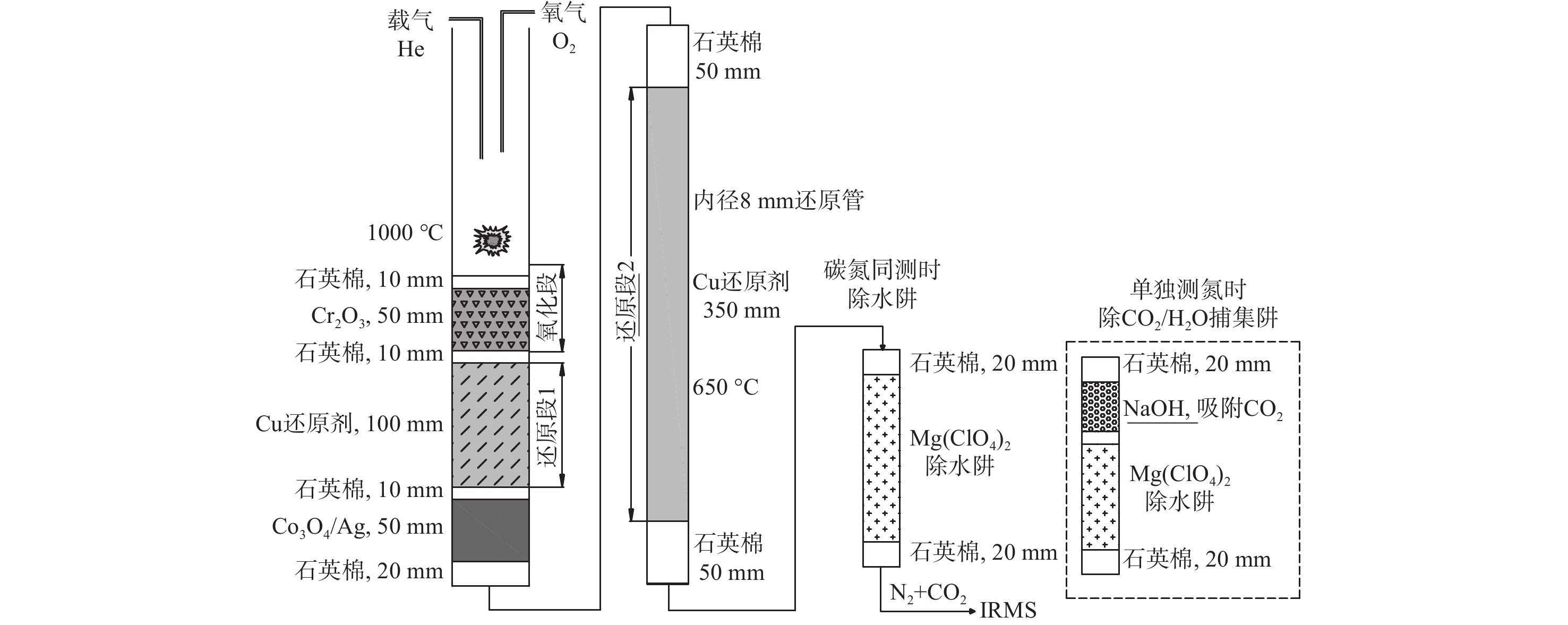
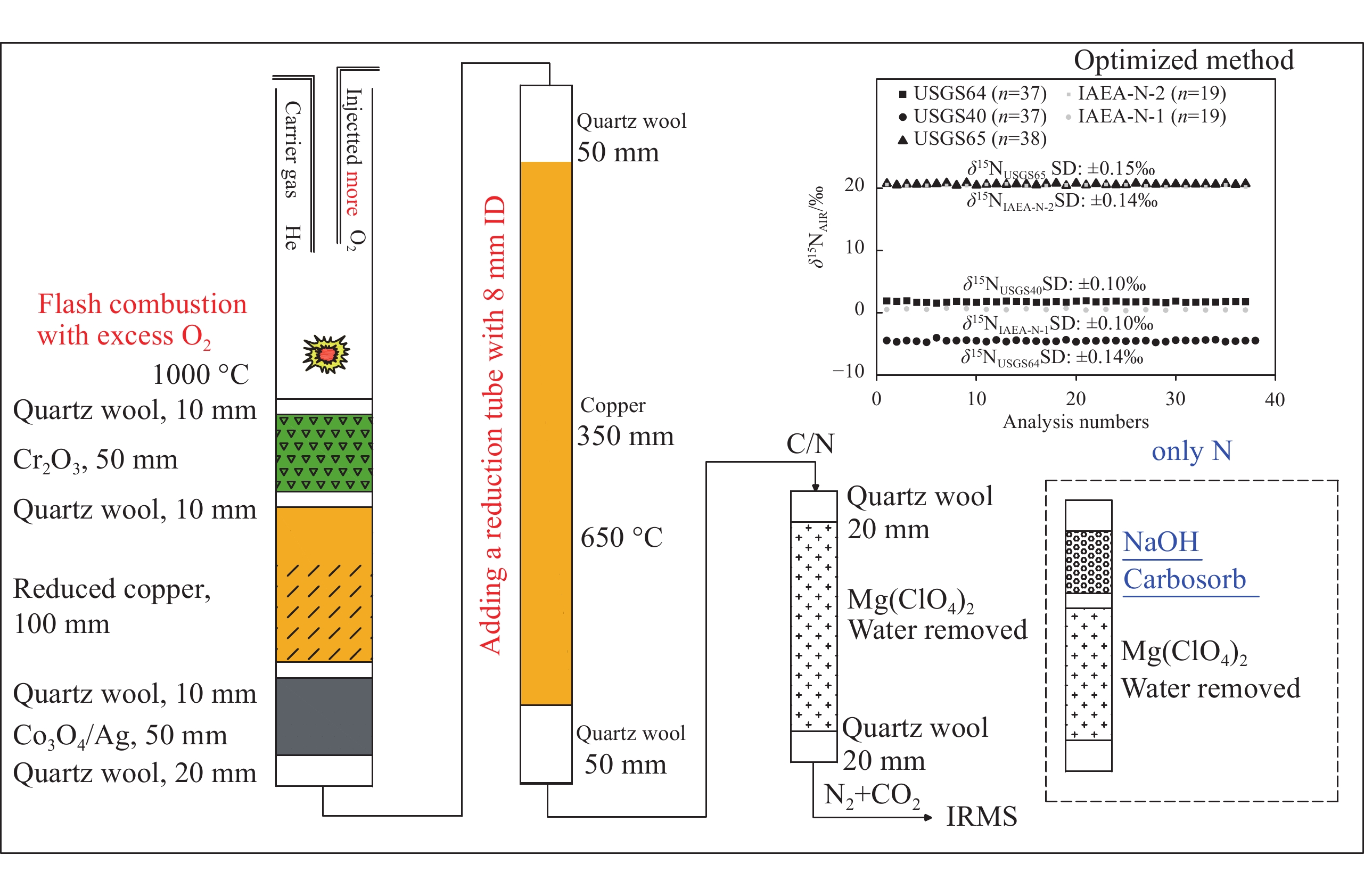
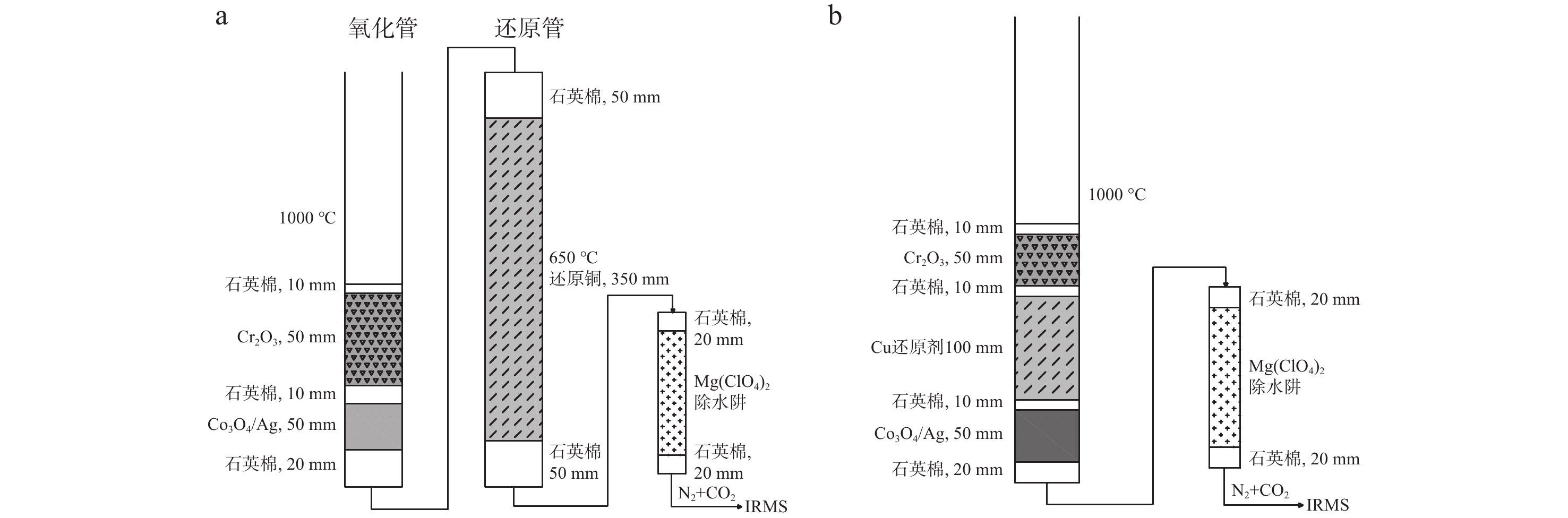
相比传统EA配备的双反应炉(左炉为氧化管,右炉为还原管,温度分别设置为1 000和650 ℃),新型EA Isolink采用了新设计[24],右炉采用1根上部填充氧化剂、下部填充还原剂的单反应管,炉温1 000 ℃下同时进行氧化和还原;左炉则用于高温裂解法测定H/O。EA Isolink和传统EA测定碳、氮时的反应管配置对比示于图1。本课题组通过前期实验发现,EA-IRMS的反应管配置方式、样品燃烧状态和填料消耗情况对氮同位素比值测定影响显著。对比碳同位素0.1‰的测定精度,氮同位素的测试精度通常仅为0.2‰~0.3‰。
本研究从燃烧条件、反应管配置、洗脱干扰气体等方面对反应条件进行优化,比较EA Isolink-IRMS系统在不同反应管模式和参数条件下氮同位素的测试精度,进一步优化测定氮同位素的方法,并通过测定一系列标准物质和真实环境样品(不同氮含量的海洋沉积物)来验证和评估方法的稳定性和精度。
-
253 plus型稳定同位素比质谱仪、EA Isolink型元素分析仪、Conflo IV型连续流万用接口:美国Thermo Fisher公司产品;WXTS3DU型百万分之一天平:瑞士Mettler公司产品。
-
高纯He、O2、N2和CO2:浓度均为99.999%,青岛德海伟业科技有限公司产品;国际标准物质USGS65、USGS64、USGS40、IAEA-N-1和IAEA-N-2:由国际原子能机构提供;尿素(δ15N标准值为(−2.90±0.2)‰):英国EMA公司产品;实验采用的国际标准物质氮同位素标准值列于表1。
-
IRMS真空度1.6×10−6 kPa,加速电压9.5 kV,发射电流1.5 mA。EA Isolink工作炉温度1 000 ℃,色谱柱温度50 ℃。采用单石英反应管进行氧化-还原,反应管上部氧化剂填料为Cr2O3,中部还原剂填料为高纯Cu丝,下部填充Co3O4/Ag用于吸附卤素杂气。除水阱填料为Mg(ClO4)2,用于去除反应气体产物中的水蒸气,示于图1。Carrier-He载气流速180 mL/min(进入色谱柱时流速50 mL/min,其余130 mL/min经分流模块EV3阀分流为吹扫气至自动进样器),吹扫气流速70 mL/min,总吹扫流速200 mL/min;氧气注入流速250 mL/min,注氧时间3 s;Conflo IV氦气压强100 kPa,参考气N2压强180 kPa,CO2压强180 kPa。
-
通过改变氧气流速(100、175、250 mL/min以及完全不注氧)和注氧持续时间(3、5、8、10、12 s),观察并测试了不同氧气注入量(5~20 mL)下实验室内部标准尿素样品的燃烧状态以及氮同位素值。同时,为确保样品可在氧气氛围中充分燃烧,设置不同的样品进入时间(8~11 s),以观察样品在富氧条件下的燃烧情况。在此基础上,对样品燃烧条件进行优化,以确定合适的注氧量。
-
在EA Isolink右炉原单管配置的基础上,为增强对气体产物中氮氧化物(NOx)的还原能力并改善峰形和灵敏度,在左炉内增设细内径还原管(定制石英反应管内径为8 mm,填料为高纯Cu丝;传统EA还原管内径为14 mm),温度设置为650 ℃。碳氮同测模式时,除水阱填料为Mg(ClO4)2,用于去除反应气体产物中的水蒸气;单独测氮模式时,在原水阱的基础上增加NaOH化学捕集阱,用于去除反应气体产物中的水蒸气,同时也可洗脱气流中的CO2。优化后EA Isolink反应管配置示于图2。
-
样品测试前,需先对IRMS的稳定性、线性等性能指标进行校验,以确保测试结果的可靠性和精度。通过对相同峰强度的标准气体进行多次重复测试,来校验稳定性。从2021年至今,本实验室IRMS在测试周期内的性能测试结果表明,当标准参考气体在相同峰强度的情况下,δ15N测试值的标准偏差约为0.01‰,稳定性较好。IRMS系统的线性校验可通过调节N2标准气进气量,测定n组(n>8)不同离子流强度(800~10 000 mV)下参考气的δ15N值来完成。结果表明,δ15N测试周期内的线性指标优于0.009‰/V,符合仪器线性指标小于0.06‰/V的要求。
-
分别在单反应管和双反应管配置,以及碳氮同测和单独测氮模式下,对比USGS40氮同位素的测试精度。基于优化方法,对USGS65、USGS64、USGS40、IAEA-N-1和IAEA-N-2等5种国际二级标准物质进行长周期测试,评估本实验室EA Isolink-IRMS系统在测试周期内δ15N测量的精度、稳定性和准确性,并利用海洋沉积物样品对优化后的方法进行实际验证。
-
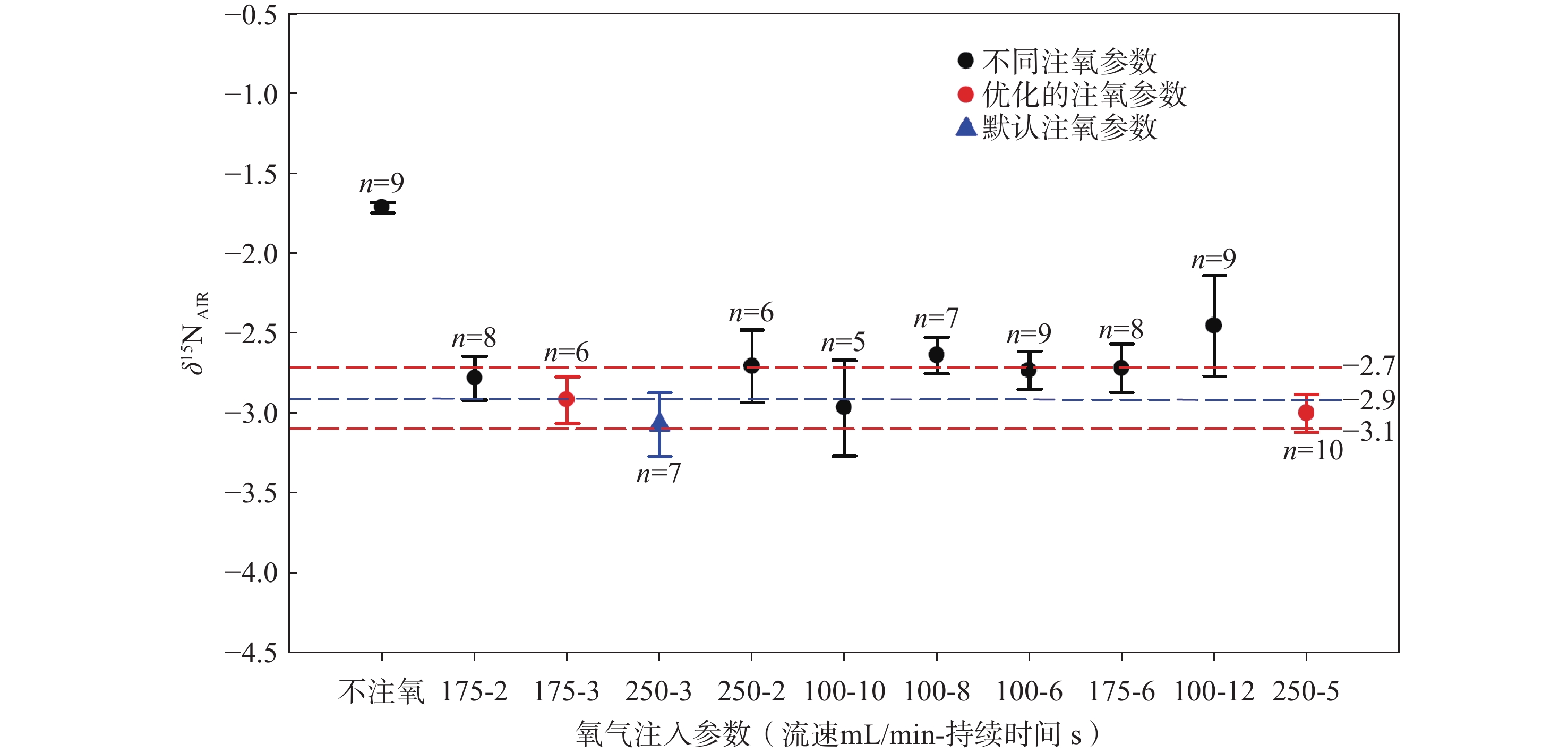
不同燃烧条件下,尿素样品δ15N值的测量结果示于图3。结果表明,当氧气注入量较低或完全不注氧时,由于样品不完全氧化,测量的δ15N值会发生一定程度的正偏移,且具有较大的标准偏差(±0.2‰)。值得注意的是,在完全不注氧的条件下,其δ15N值为(−1.70±0.03)‰,虽然有较高的精度(标准偏差±0.03‰),但同位素值发生了约+1.2‰的正偏移。当采用高流速氧气注入模式(流速250 mL/min,注氧时间5 s,以及流速175 mL/min,注氧时间3 s)时,在样品完全氧化状态下,其δ15N测量值分别为(−2.99±0.118)‰和(−2.91±0.146)‰(1σ,n=10),与预期的δ15N值((−2.90±0.2)‰)一致。当注氧流速较低且持续时间较长时(如流速100 mL/min,注氧时间10 s),其δ15N测量值为(−2.96±0.30)‰,具有较大的标准偏差。不同注氧条件下,δ15N值测量结果的t检验具有显著性(p<0.05),表明不同燃烧条件对δ15N值和不确定度具有显著影响。
-
样品的不完全燃烧会导致同位素发生显著分馏,且残留物会对后续样品产生影响,导致测试结果偏差[25]。氧气注入量以及样品进入反应管的时间,与样品能否充分燃烧密切相关[19]。过多的氧气会快速消耗还原铜,缩短反应管寿命,同时不利于氮氧化物NOx充分还原为N2;过少的氧气则会导致样品燃烧不充分,发生同位素分馏和样品记忆效应。因此,为确保O2和样品同时抵达反应器的高温区并发生完全燃烧,需要优化计算氧气注入量和样品进入反应管的时间。
EA-IRMS中的载气为He,氧气注入是由EV1电磁阀开关实现的,注入的氧气与载气He混合进入石英反应管内,形成短暂的富氧环境,使锡杯快速燃烧并促使样品氧化。氧气到达反应管所需的时间是根据反应管上部气体通过的有效体积和载气流速计算得出的:本实验中EA采用的石英管内径为14 mm(外径18 mm),其平面截面积为154 mm2,反应管上部长度为200 mm,计算出石英管内的空间体积约30.8 mL;另外,从氧气入口EV1阀到反应管顶端的不锈钢气体管道内径为1.4 mm(外径1.6 mm)、长度约为1 m,计算得到管道内的有效体积约为1.5 mL,因此,氧气到达反应管高温区需要通过的总有效空间体积为两者之和,约32.3 mL。当设置的载气流速为180~250 mL/min时,可计算得到在此载气流速下氧气需要8~11 s才能到达反应管的高温区。为保证样品在富氧环境下充分燃烧,样品进入反应管的时间应与此时间一致,即样品的延迟时间约为8~11 s。
在不同燃烧条件下测定实验室内部标准尿素,通过目视EA Isolink的观察小窗来监测样品进入反应管后的燃烧情况,结果列于表2。当氧气注入量小于8 mL时,样品燃烧情况较弱;此外,当氧气流速较低(100 mL/min)、注氧时间较长(8~10 s)时,未观察到样品闪燃的现象,燃烧过程较缓慢且持续时间较长,约12~14 s,表明燃烧反应不充分。随着氧气流速增大和注入量增加,样品的燃烧更快速、更充分。当氧气注入量超过17 mL,且氧气流速更高(250 mL/min)、注入时间更短(3~5 s)时,样品在反应管中表现出强烈而快速的闪光现象,表明燃烧充分。
上述实验表明,氧气注入的流速和持续时间与样品能否充分燃烧密切相关。当注氧量过少或氧气流速较小且持续时间较长时,会导致反应管内高温区氧气的浓度较低,不利于样品充分燃烧。因此,注入氧气时,应选择大流速、短时间快速注氧的方法,有利于在反应管内快速形成富氧氛围。当氧气到达反应管高温区时,样品恰好掉落,可确保样品充分燃烧。
作为纯品物质的尿素很容易燃烧,仅需要少量氧气即可。对于真实环境样品(如海洋沉积物),氮含量仅约为0.1%或更低,测试氮同位素时往往需要超过20 mg样品。与纯品物质不同,质量较大的沉积物样品在EA中发生燃烧反应时存在基质效应,样品粉末会吸收大量的热量,进而可能影响样品的充分燃烧,降低氮的转化效率。因此,大样品的不完全燃烧可能导致同位素分馏现象的发生。为确保沉积物样品中含氮化合物充分燃烧并转化成气态产物,所需的氧气量远超过纯品标准物质燃烧时的注氧量。
对于含氮量较高的样品,如植株、动物组织和纯化学物质,可采用氧气注入流速175 mL/min,注氧时间3 s(约8.75 mL O2)的参数;对于含氮量较低的样品,如海洋沉积物,设置氧气注入流速250 mL/min,注氧时间5 s(约20 mL O2)。经测试,对于小尺寸样品以及60 mg以内大尺寸沉积物样品,在上述建议的氧气注入参数下可以确保其充分燃烧。
-
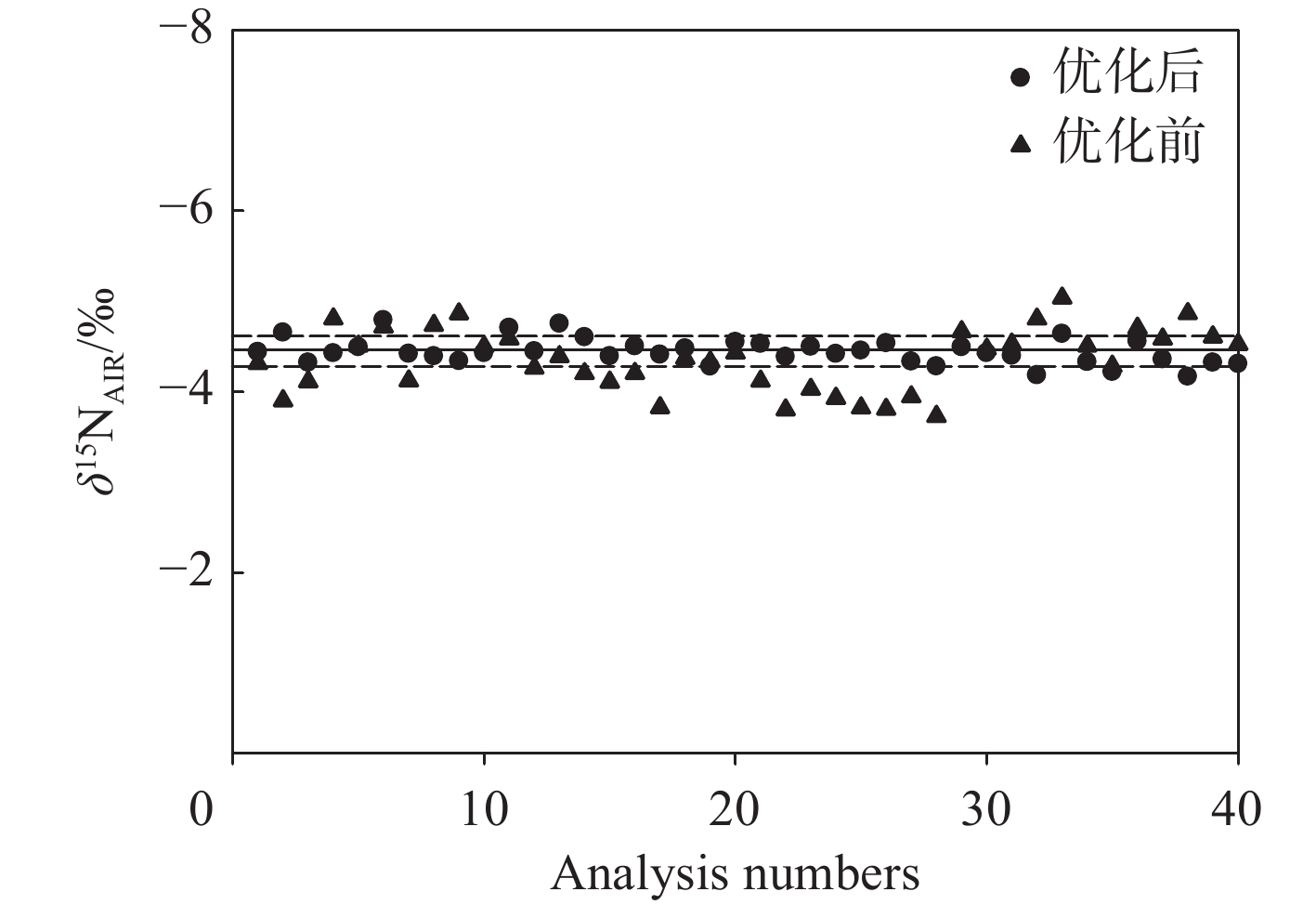
称取固定质量的国际标准物质USGS40作为待测样品,采用IAEA-N-1和IAEA-N-2作为校正标样,在不同反应管配置方案下,分别测定样品δ15N值(n=20),结果列于表3。结果表明,不同反应管配置方案、采用单独测氮(去除CO2)或碳氮同测模式时,样品δ15N的测定值存在显著差异。单反应管模式下,随着反应管中还原铜的消耗,测试得到的δ15N值发生周期性漂移,稳定性和精度较低。优化后的双反应管配置方案具有更强的还原能力,测试得到的δ15N值精度约±0.14‰,测试稳定性和精度明显优于单反应管模式,示于图4。对比单独测氮模式(去除CO2)和碳氮同测模式,前者δ15N值的测试精度显著提高。采用双反应管且单独测氮模式时,得到的δ15N值精度最高,可达±0.1‰。
通过对比国际标准物质USGS40、USGS65和USGS64氮同位素的测试结果发现,单反应管模式下,δ15N值的测试精度分别约为±0.33‰(USGS64)、±0.36‰(USGS65)和±0.15‰(USGS40);而采用优化的双反应管模式时,δ15N值的测试精度分别约为±0.14‰(USGS64)、±0.15‰(USGS65)和±0.10‰(USGS40)。氮同位素的测试精度得到显著提升,示于图5。
-
氮同位素测定时需要保证良好的灵敏度和峰形。在一定压强的氦气负载下,标准气体N2以恒定流速连续进入离子源,因此,参考气表现为平顶峰;而样品通过燃烧-还原转化的气体产生的是瞬时信号,受扩散过程以及色谱分离迁移的影响,表现为高斯峰,理想的样品峰形应该是尖锐且对称的[12]。当管路直径较大时,会降低目标气体浓度,导致出峰时间和峰形的改变,不利于高分辨率色谱峰的获取。此外,尽管高温燃烧时有机物中的大部分氮都能转化为N2,但仍有部分氮会被进一步氧化为氮氧化物(如NO),这部分氮氧化物需通过还原炉还原为N2,否则会严重影响测试精度。
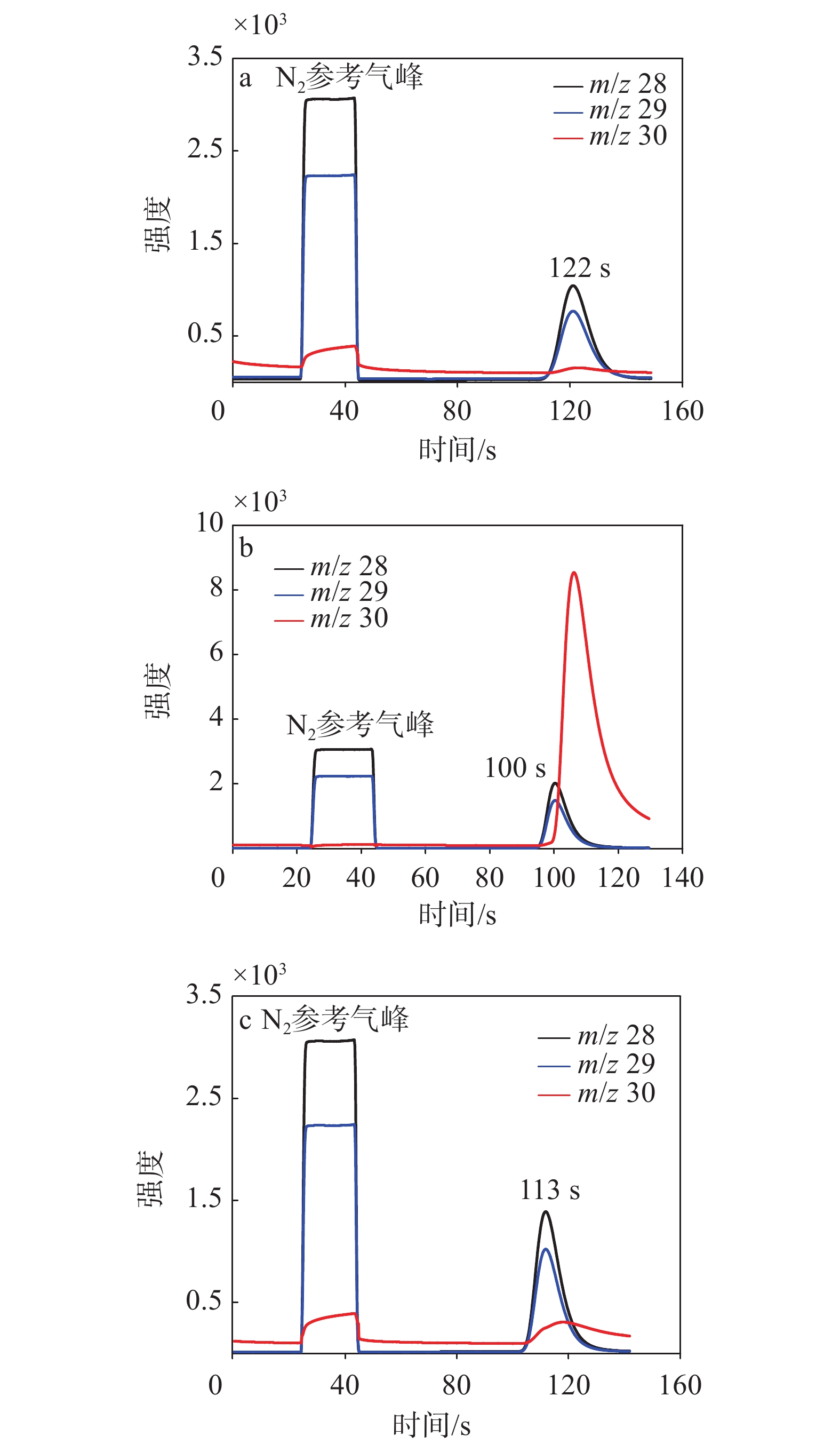
EA-IRMS系统采用不同反应管配置时,测定氮同位素的参考气峰和样品峰示于图6。当采用左炉氧化和右炉还原的双反应管(采用默认配置内径14 mm的石英管)时,虽然氮氧化物可被充分还原为N2,但大大增加了反应管路内部体积,导致出峰时间最晚(约120 s),生成的目标气体浓度较低,引起灵敏度下降(m/z 28峰强度1 000 mV)、峰展宽较大(46 s)和峰拖尾等问题,示于图6a。当采用单反应管时,由于具有高流速(180 mL/min)、更小的死体积,出峰时间最早(约100 s),待测目标峰的强度显著提高(m/z 28峰强度2 000 mV),且峰形较好(峰宽35 s)。但是,由于产物中的NO无法被充分还原,会被电离为14N16O+,从谱图上表现为m/z 30峰异常高,导致氮同位素测定时出现较大偏差,示于图6b。采用本研究优化后的方案,在单反应管基础上增加细内径还原管后,可极大增强对氮氧化物的还原能力,谱图上m/z 30峰背景很低。同时,由于新增加的还原管内径为8 mm,低于传统EA还原管内径(14 mm),较小的内部体积在保证较高峰强度(m/z 28峰强度
1500 mV)的同时,还能获得良好的峰形(出峰时间113 s,峰宽38 s),示于图6c。 -
测定氮同位素所需的最小样品质量由系统的信噪比决定。对于氮元素来说,包裹样品的锡杯中几乎不含氮,因此,测试时的氮空白主要来源于空气背景。背景空白信号的产生与自动进样器进样时活塞杆移动导致的载气压强波动和氦气吹扫有关。长期监测表明,当氦气总吹扫流速>200 mL/min时,在系统稳定运行的情况下,空气氮背景的空白信号强度通常低于20 mV。
称量不同质量的标准物质USGS40,测定氮同位素值并确定其质量响应范围。结果表明,对于本实验室EA Isolink-IRMS系统而言,每1 μg纯氮可产生约50 mV的信号强度,当离子流强度处于500~10 000 mV范围内时,δ15N值测定精度约为±0.15‰。因此,当样品含氮量在10~200 μg范围内时,可满足实验分析要求并获得良好的精度。当样品中氮含量约为5 μg时,测定氮同位素值的标准偏差为±0.4‰。不同反应管配置模式下氮同位素测量的灵敏度和检出限列于表4。
-
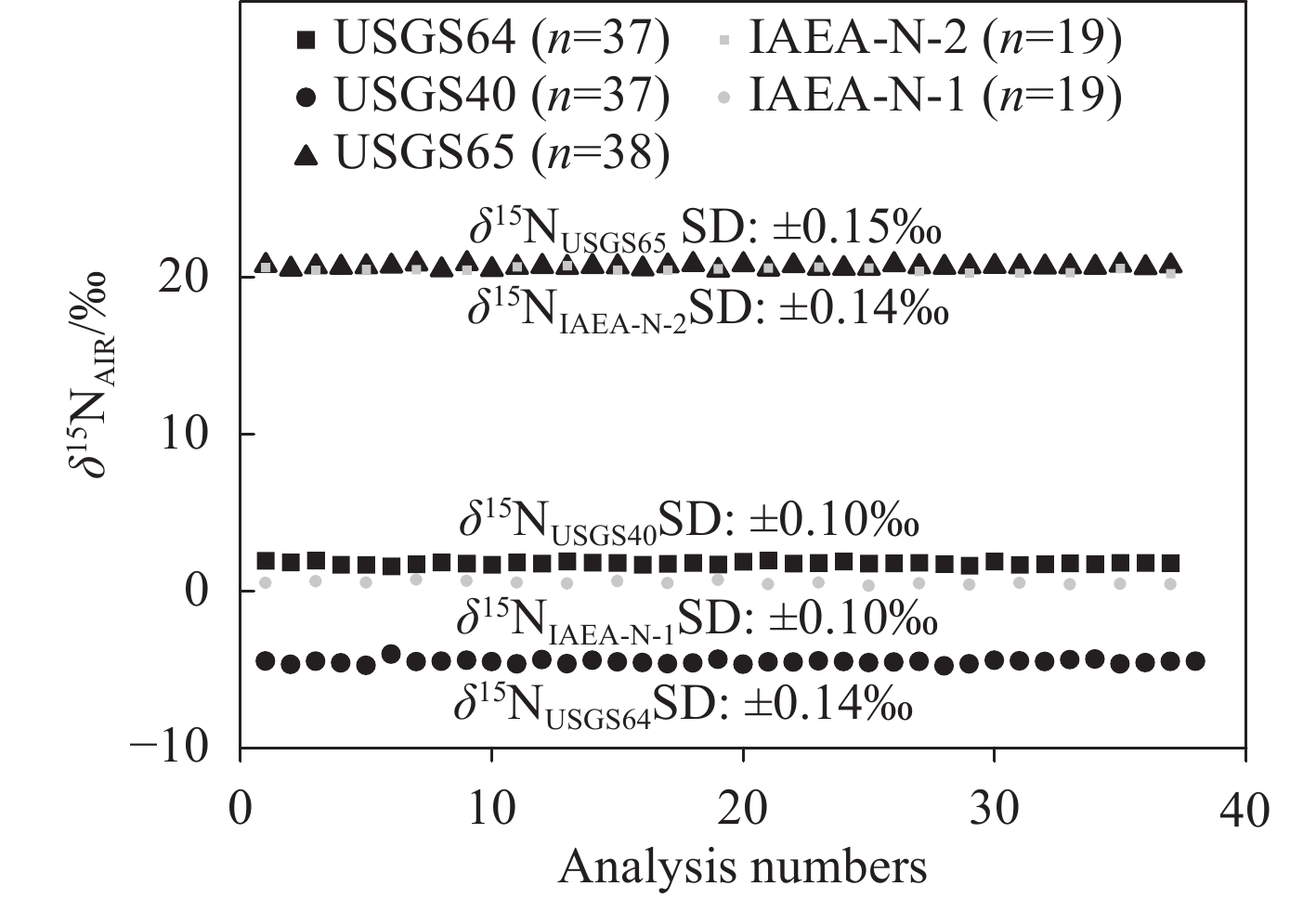
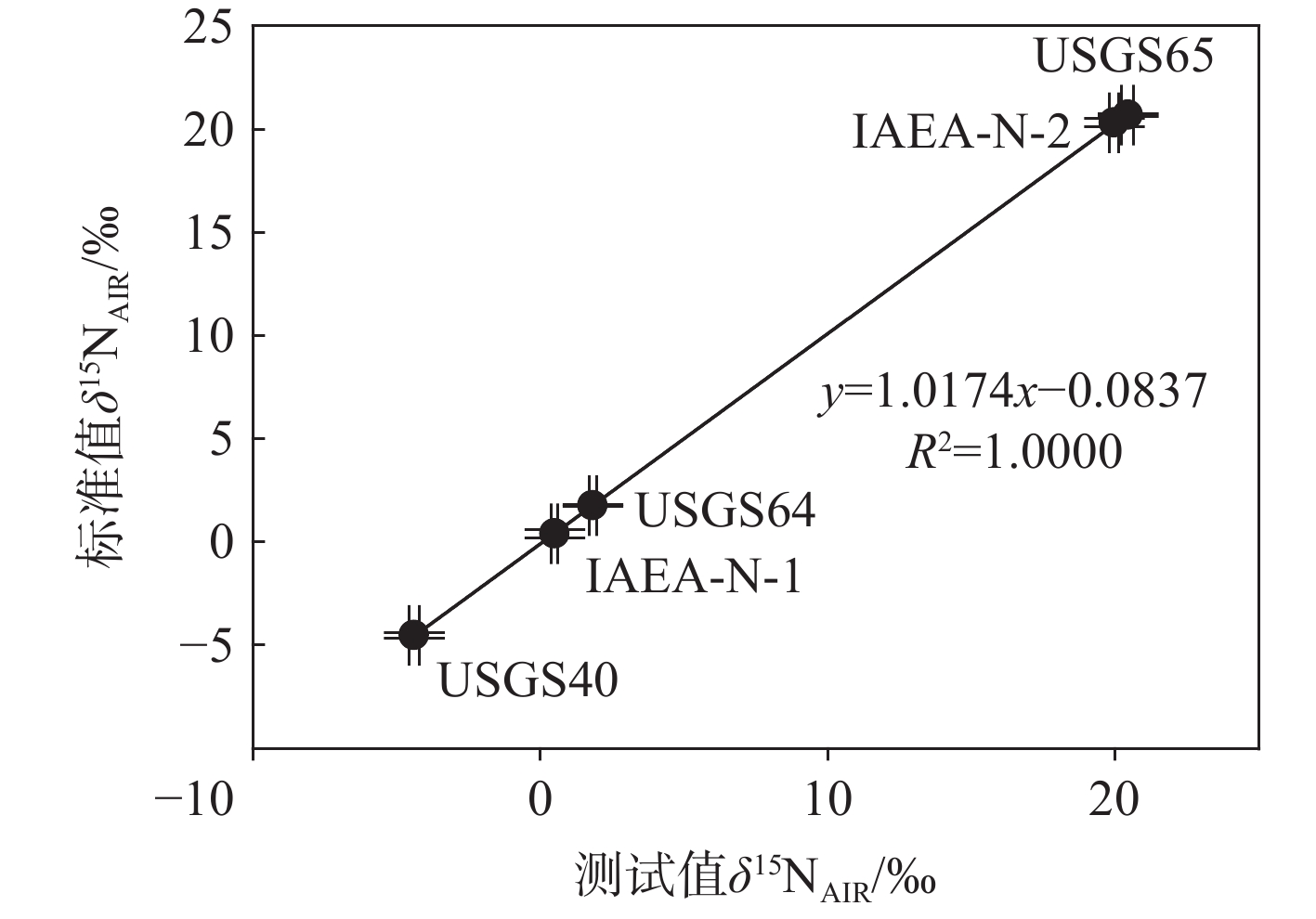
采用一系列标准物质在较长周期、不同批次测定时的外精度评估EA Isolink-IRMS系统的重现性。基于优化后的反应管配置和参数条件,自2024年1~9月的日常测定样品实验中(共计50个不同批次),采用USGS65、USGS40、USGS64、IAEA-N-1和IAEA-N-2等5种标准物质进行监控测试。在9个月的测试周期内,多批次间各标样的δ15N测试值标准偏差分别为0.15‰、0.14‰、0.12‰、0.10‰和0.15‰,长时间、不同批次内平行标样的重现性良好,外精度优于0.15‰。各标准物质测试值和标准值的线性拟合回归方程为y=
1.0174 x−0.0837 ,相关系数R2=1.0000 ,示于图7。结果表明,EA Isolink-IRMS系统测定氮同位素时重现性良好,长期稳定性和精度均满足测试要求。 -
地质样品测试采用不同氮含量的海洋沉积物样品。样品经冷冻干燥并研磨后,用天平精确称量约20 mg,用锡杯包裹,采用优化后的方法对样品中δ15N进行测定。每个样品至少2次重复测定,利用国际标准物质采用多点校正法,对测试结果进行数据标准化处理,换算为相对于国际同位素标准的δ值。测试结果表明,样品TN含量范围为0.06%~0.17%,除个别样品可能因本身非均质外,其余样品δ15N值的标准偏差均优于±0.10‰,测定精度良好,列于表5。
-
应用EA-IRMS高温燃烧法时,样品的燃烧和还原条件对精确测定氮同位素至关重要。传统的EA-IRMS采用左炉氧化-右炉还原的双反应管,虽然有利于燃烧气体产物中氮氧化物的还原,但由于反应管路内部体积较大导致气体浓度较低,存在灵敏度低、氮峰展宽较大和峰拖尾等问题。目前,最新的EA Isolink-IRMS系统采用单反应管配置,虽具有更大的流速(180 mL/min)、更小的死体积,能显著提高待测目标峰强度,但由于缺乏独立的还原管,随着Cu还原剂的逐渐消耗,还原效率显著下降,氮氧化物无法被充分还原为N2,其中NO气体在离子源中被电离为14N16O+,会引起m/z 30表现为异常高的峰值,导致同位素测试时出现周期性漂移。此外,当温度设置为1 000 ℃,采用单反应管模式时,还原段的顶端温度偏高,远高于还原铜所需的反应温度650 ℃。在此高温情况下,部分氧化铜会与石英形成共晶相,进而影响氮氧化物的还原效率[26]。同时,825 ℃以上氧化铜将会发生热分解释放氧气。随着反应管的使用、还原效率逐渐下降,这些过量氧无法被完全吸收而进入质谱仪。离子源中的高含量氧会增强空间的带电效应,导致离子源调谐问题和背景波动,降低测定精密度、准确度,同时可能导致灯丝寿命下降甚至断裂。尽管有研究表明[27],当EA采用单反应管测定氮同位素时,可将反应温度设置为800 ℃。这样虽可保证下部还原Cu的还原效率,但低温氛围不利于样品的充分燃烧,尤其对于大样品量、低氮含量的沉积物样品,更难保证其充分燃烧,可能导致同位素发生较大分馏。
对于EA Isolink-IRMS系统,在目前单反应管配置的基础上增加小容积还原管,将还原段总长度从原配置的11 cm大幅延长至优化后的46 cm,示于图2。因此,在还原段1未充分反应的氮氧化物可在还原段2进一步还原,有效提高了对残余氮氧化物的还原能力和效率,使离子源中产生m/z 30的14N16O+离子在谱图中的峰强度较低(峰高低于300 mV);对比采用单反应管时m/z 30常出现高达数千毫伏的信号,新增的还原段可确保产物中氮氧化物的充分还原和过量氧气的吸收,显著减弱了因还原效率下降而导致的δ15N测试值发生周期性漂移的现象。此外,优化后的方法虽然增加了部分反应管路的内部体积,使测氮灵敏度比单反应管时70 mV/μg有所下降,但由于采用小内径还原管,样品中每1 μg纯氮仍可产生约50 mV的信号强度,显著优于传统双反应管的灵敏度(30 mV/μg)。该方法可有效提高氮同位素长期测试的稳定性和精度,不同批次间标准物质的δ15N测试值标准偏差优于±0.15‰。对标准物质和海洋沉积物样品的测试结果表明,当纯氮量在10 μg以上时,同一批次内样品的δ15N测试精度约为±0.10‰。由于单反应管具备一定的还原能力,新增还原管的还原铜消耗速度非常缓慢,使用寿命较长,检测约3 000~4 000个样品后才需要检查更换还原管(更换频次与分析的样品类型和进样量有关)。此外,新增还原管还能进一步去除样品气流中的卤素杂质,避免污染色谱柱和离子源。同时,该方法改装EA Isolink快捷简单,无需对仪器硬件进行大幅调整,仅需在现有反应管配置的基础上将新增细内径还原管安装在左炉即可。
-
为提高氮同位素比值分析的精度,本研究对比了EA Isolink-IRMS系统在不同反应管配置模式和参数条件下氮同位素的测试精度,从燃烧条件、不同反应管配置、洗脱干扰气体等方面对反应条件和参数进行优化,并通过测定一系列标准物质和不同氮含量的海洋沉积物进一步优化该方法。研究表明,不同反应管配置方式、样品燃烧状态和填料消耗情况对氮同位素比值测定具有显著影响。精确的氮同位素分析需确保样品充分燃烧、氮氧化物充分还原、洗脱气流中的CO2和可能存在的杂质气体。本研究结果表明:1)应根据样品类型的不同,采用快速注氧方式,选择合适的注氧量,以确保样品充分燃烧。对于含氮量较高的小尺寸样品(如植株、动物组织和纯化学物质),采用氧气流速175 mL/min,注氧时间3 s;对于大尺寸样品(如含氮量很低的海洋沉积物),氧气流速250 mL/min,注氧时间5 s。2)在现有单反应管配置的基础上,增加小容积还原管可有效确保氮氧化物的充分还原和过量氧气的吸收。采用优化的参数配置,测试的稳定性、重现性和精度显著提高,单独测氮模式下氮同位素的测定精度可优于0.10‰。本方法具有良好的精密度和准确性,可为精确测定样品中氮同位素组成提供参考,对提高相关测试精度具有重要意义。
致谢:感谢赛默飞世尔科技(中国)有限公司杜岩工程师在仪器使用中给予的技术支持。
EA Isolink-IRMS测定氮同位素方法:单/双炉模式对比及测试精度评价
Nitrogen Isotope Determination Method Using EA Isolink-IRMS: Comparison of Single/Double Furnace Modes and Evaluation of Measurement Accuracy
-
摘要: 利用元素分析-同位素质谱(EA-IRMS)结合高温燃烧法(CM)测定固体样品中的氮同位素,对于科学探究全球氮循环具有重要作用。然而,相对于碳同位素的测定,氮同位素比值的测定精度通常较低。本研究对比了EA Isolink-IRMS系统在不同反应管模式和参数条件下氮同位素的测试精度,从燃烧条件、不同反应管配置、洗脱干扰气体等方面对反应条件和参数进行优化,并通过测定一系列标准物质和不同氮含量的海洋沉积物,进一步优化测定氮同位素的方法。不同的反应管配置方式、样品燃烧状态和填料消耗情况对氮同位素比值测定具有显著影响。精确的氮同位素分析需确保样品充分燃烧、氮氧化物充分还原,并去除洗脱气流中的CO2和可能存在的杂质气体。研究结果表明:1)根据样品类型不同,采用快速的注氧方式和合适的注氧量,可以确保样品的充分燃烧。2)在目前单反应管配置的基础上增加小容积还原管,可有效确保氮氧化物的充分还原和过量氧气的吸收。采用优化的参数条件,单独测氮模式下氮同位素的测试精度优于0.10‰。本方法具有良好的精密度和准确性,可为精确测定样品中氮同位素组成提供参考,对提高相关测试精度具有重要意义。
-
关键词:
- 元素分析-同位素比质谱(EA-IRMS) /
- 氮同位素 /
- 单/双炉模式 /
- 燃烧-还原 /
- 测试精度
Abstract: Determination of nitrogen isotopes in natural samples plays an important role in scientific exploration of the global nitrogen cycle. However, compared with carbon isotope measurement, the accuracy of nitrogen isotope ratio determination is generally lower when using the high-temperature combustion method (CM) based on an elemental analyzer coupled with an isotope ratio mass spectrometer (EA-IRMS). This study optimized the reaction conditions and parameters in terms of combustion conditions, different reaction tube configurations, and interfering gases in the elution gas flow. The accuracy of nitrogen isotope testing in the EA Isolink-IRMS system was compared under different reaction tube configuration (single and double modes) and oxygen injection parameter conditions. By measuring a series of standard substances and marine sediments with varying nitrogen contents, the method for nitrogen isotope measurement was further optimized. The results showed that different reaction tube configurations, sample combustion states, and filler consumption in EA-IRMS have significant impacts on the determination of nitrogen isotope ratios. Accurate nitrogen isotope analysis requires ensuring sufficient sample combustion in EA, sufficient reduction of nitrogen oxides, and removal of CO2 and potential impurity gases from the gas stream. For the determination of nitrogen isotopes using the EA Isolink-IRMS system, this study showed that: 1) Depending on the sample type, the appropriate oxygen injection amount should be selected by rapid oxygen injection to ensure sufficient sample combustion. For small-sized samples with high nitrogen content (e.g., plants, animal tissues, and pure chemical substances), an oxygen flow rate of 175 mL/min and injection duration time of 3 s should be used. For large-sized samples (e.g., marine sediments with low nitrogen content), the oxygen flow rate of 250 mL/min and the injection duration time of 5 s were recommended. 2) Based on the current single tube configuration, adding a reduction tube with smaller volume can effectively ensure the full reduction of nitrogen oxides and absorption of excess oxygen. When using the optimized method for nitrogen isotope measurement, a signal intensity of approximately 50 mV can be generated for every 1 μg of N in the sample. The standard deviations of the measured δ15N values of reference materials (USGS40, USGS65 and USGS64) across different batches are better than ±0.15‰. For marine sediment samples, the measurement accuracy of nitrogen isotopes can be better than 0.10‰ in a batch. The stability, reproducibility, and accuracy of the measurements can be greatly improved. This method provides crucial technical support for the determination of nitrogen isotope ratios. -

-
表 1 实验采用的国际标准物质氮同位素标准值
Table 1. Certified δ15N values of the international reference material used in the experiment
标准物质
Reference material来源
Sourceδ15NAIR标准值
Certified value of δ15NAIR/‰USGS64 甘氨酸 NIST 1.76±0.06 USGS40 谷氨酸 NIST −4.52±0.12 USGS65 甘氨酸 NIST 20.68±0.06 IAEA-N-1 硫酸铵 IAEA 0.40±0.20 IAEA-N-2 硫酸铵 IAEA 20.30±0.20 尿素 实验室内部
工作标准−2.90±0.20 表 2 不同注氧条件下样品的燃烧情况
Table 2. Combustion behavior of samples under different oxygen injection conditions
O2注入量
O2 injection volumn/mL氧气流速
Oxygen flow rate/(mL/min)注氧时长
Duration time/s燃烧持续时间
Combustion time/s反应现象
Scene燃烧状态
Combustion condition不注氧 0 0 0 无闪燃 5.83 175 2 5 燃烧弱 8.75 175 3 8 燃烧强烈 8.33 250 2 8 燃烧弱 12.5 250 3 9 燃烧强烈 10.0 100 6 12 燃烧中等 13.3 100 8 12 燃烧中等 16.7 100 10 12 燃烧中等 17.5 175 6 7 燃烧强烈 20.0 100 12 14 燃烧强烈 20.8 250 5 8 燃烧强烈 表 3 不同反应管配置对USGS40氮同位素值测定的影响
Table 3. Effect of different reaction tube configurations on the determination of nitrogen isotope values in USGS40
反应管配置
Reaction tube configuration是否除CO2
CO2 removed
or not氮同位素测试值
Measured δ15N/‰(1σ)氮同位素校正值
Corrected δ15N/‰(1σ)误差值
Error/‰δ15N标准值
Certified value of
δ15N/‰(1σ)单反应管 否 −3.04±0.99 −4.28±0.33 +0.24 −4.52±0.12 是 −5.93±0.23 −4.67±0.14 −0.15 优化后双反应管 否 −3.39±0.16 −4.54±0.14 −0.02 是 −4.39±0.13 −4.52±0.10 — 表 4 不同反应管配置模式下氮同位素测量的灵敏度和检出限对比
Table 4. Comparison of sensitivity and detection limits for nitrogen isotope measurement under different reaction tube configuration modes
反应管配置
Reaction tube configuration灵敏度
Sensitivity/(mV/μg)检出限
Detection limit/μg所需纯氮质量范围
Mass range of N/μg测试精度
Precision/‰(1σ)单反应管 70 1 20~200 ±0.35 双反应管 30 2 30~200 ±0.20 优化后双反应管 50 1 10~200 ±0.15 表 5 优化参数下海洋沉积物样品氮同位素测定
Table 5. Determination of nitrogen isotopes in marine sediment samples under optimized parameters
样品编号
Sample number测试次数
Number of measurement测试值
Measured value平均值及标准偏差
Mean and standard deviationTN/% δ15N/‰ TN/%(1σ) δ15N/‰(1σ) S1 2 0.115 6.942 0.115±0.0007 6.883±0.080 0.116 6.824 S2 2 0.113 6.601 0.113±0.0001 6.596±0.007 0.113 6.591 S3 2 0.110 6.231 0.111±0.0007 6.279±0.068 0.111 6.328 S4 2 0.115 5.420 0.117±0.003 5.410±0.013 0.119 5.401 S5 2 0.127 5.381 0.125±0.002 5.287±0.132 0.124 5.194 S6 3 0.061 5.828 0.061±0.0005 5.790±0.080 0.061 5.698 0.062 5.845 S7 3 0.173 2.500 0.173±0.001 2.545±0.040 0.172 2.576 0.174 2.561 S8 3 0.161 2.233 0.159±0.002 2.194±0.149 0.158 2.321 0.158 2.029 -
[1] 黄永建, 王成善, 汪云亮. 古海洋生产力指标研究进展[J]. 地学前缘, 2005, 12(2): 163 -170 . doi: 10.3321/j.issn:1005-2321.2005.02.018 HUANG Yongjian, WANG Chengshan, WANG Yunliang. Progress in the study of proxies of paleocean productivity[J]. Earth Science Frontiers, 2005, 12(2):163 -170 (in Chinese). doi: 10.3321/j.issn:1005-2321.2005.02.018[2] 蔡德陵, 李红燕, 唐启升, 孙耀. 黄东海生态系统食物网连续营养谱的建立: 来自碳氮稳定同位素方法的结果[J]. 中国科学C辑: 生命科学, 2005, 35(2): 123 -130 . CAI Deling, LI Hongyan, TANG Qisheng, SUN Yao. Establishment of continuous nutrient spectrum of food web in Yellow Sea and East China Sea ecosystem: results from stable isotope method of carbon and nitrogen[J]. Science in China, Ser C, 2005, 35(2):123 -130 (in Chinese).[3] 蔡德陵, 李红燕. 稳定碳、氮同位素在河流系统研究中的应用[J]. 海洋科学进展, 2004, 22(2): 225 -232 . doi: 10.3969/j.issn.1671-6647.2004.02.016 CAI Deling, LI Hongyan. Application of stable carbon and nitrogen isotopes to the study of riverine system[J]. Advances in Marine Science, 2004, 22(2):225 -232 (in Chinese). doi: 10.3969/j.issn.1671-6647.2004.02.016[4] GUO Z, YE H, XIAO J, HOGSTRAND C, ZHANG L. Biokinetic modeling of Cd bioaccumulation from water, diet and sediment in a marine benthic goby: a triple stable isotope tracing technique[J]. Environmental Science & Technology, 2018, 52(15): 8 429-8 437. [5] BEBOUT G E, FOGEL M L. Nitrogen-isotope compositions of metasedimentary rocks in the Catalina Schist, California: implications for metamorphic devolatilization history[J]. Geochimica et Cosmochimica Acta, 1992, 56(7): 2 839-2 849. [6] STÜEKEN E E, BUICK R, GUY B M, KOEHLER M C. Isotopic evidence for biological nitrogen fixation by molybdenum-nitrogenase from 3.2 Gyr[J]. Nature, 2015, 520(7 549): 666-669. [7] 范丽俊, 赵峰华, 程晨. 水体中氮稳定同位素的研究进展[J]. 应用生态学报, 2016, 27(8): 2 699-2 707. FAN Lijun, ZHAO Fenghua, CHENG Chen. Research advances in stable nitrogen isotope in water bodies[J]. Chinese Journal of Applied Ecology, 2016, 27(8): 2 699-2 707(in Chinese). [8] BEAUMONT V, ROBERT F. Nitrogen isotope ratios of kerogens in Precambrian cherts: a record of the evolution of atmosphere chemistry?[J]. Precambrian Research, 1999, 96(1/2): 63 -82 .[9] 王政, 刘卫国, 文启彬. 土壤样品中氮同位素组成的元素分析仪-同位素质谱分析方法[J]. 质谱学报, 2005, 26(2): 71 -75 . doi: 10.3969/j.issn.1004-2997.2005.02.002 WANG Zheng, LIU Weiguo, WEN Qibin. Measurement of nitrogen isotopic composition of soil samples by element analysis isotope mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2005, 26(2):71 -75 (in Chinese). doi: 10.3969/j.issn.1004-2997.2005.02.002[10] 储雪蕾. 一种新的、快速的碳、氮、硫同位素测定手段——EA-IRMS连线分析技术[J]. 矿物岩石地球化学通报, 1996, 15(4): 259 -262 . CHU Xuelei. A new method of rapid measurements for C, N and S isotope ratios: on-line analytical method of EA-IRMS[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 1996, 15(4):259 -262 (in Chinese).[11] 曹建平, 黄奕普, 刘广山, 陈敏, 李鸿宾. 海洋悬浮颗粒物中氮同位素的EA-IRMS法测定[J]. 台湾海峡, 2003, 22(1): 1 -8 . CAO Jianping, HUANG Yipu, LIU Guangshan, CHEN Min, LI Hongbin. Determination of 15N in marine suspended particulate matter using EA-IRMS technique[J]. Journal of Oceanography in Taiwan Strait, 2003, 22(1):1 -8 (in Chinese).[12] PELLA E, COLOMBO B. Study of carbon, hydrogen and nitrogen determination by combustion-gas chromatography[J]. Microchimica Acta, 1973, 61(5): 697 -719 . doi: 10.1007/BF01218130[13] WERNER R A, BRAND W A. Referencing strategies and techniques in stable isotope ratio analysis[J]. Rapid Communications in Mass Spectrometry, 2001, 15(7): 501 -519 . doi: 10.1002/rcm.258[14] BAHLMANN E, BERNASCONI S M, BOUILLON S, HOUTEKAMER M, KORNTHEUER M, LANGENBERG F, MAYR C, METZKE M, MIDDELBURG J J, NAGEL B, STRUCK U, VOSS M, EMEIS K C. Performance evaluation of nitrogen isotope ratio determination in marine and lacustrine sediments: an inter-laboratory comparison[J]. Organic Geochemistry, 2010, 41(1): 3 -12 . doi: 10.1016/j.orggeochem.2009.05.008[15] LOTT M J, HOWA J D, CHESSON L A, EHLERINGER J R. Improved accuracy and precision in δ15NAIR measurements of explosives, urea, and inorganic nitrates by elemental analyzer/isotope ratio mass spectrometry using thermal decomposition[J]. Rapid Communications in Mass Spectrometry, 2015, 29(15): 1 381-1 388. [16] 王旭, 张福松, 丁仲礼. EA-Conflo-IRMS联机系统的燃烧转化率漂移及其对氮、碳同位素比值测定的影响[J]. 质谱学报, 2006, 27(2): 104 -109 . doi: 10.3969/j.issn.1004-2997.2006.02.009 WANG Xu, ZHANG Fusong, DING Zhongli. Changes in the combustion transformation capability of EA-conflo-IRMS and their impacts on nitrogen and carbon isotope ratio measurement[J]. Journal of Chinese Mass Spectrometry Society, 2006, 27(2):104 -109 (in Chinese). doi: 10.3969/j.issn.1004-2997.2006.02.009[17] 曹珺. EA-Conflo-IRMS系统反应管填料消耗对海洋沉积物氮同位素比值测定的影响[J]. 地质论评, 2015, 61(增刊1): 1 -2 . CAO Jun. Effect of reactor packing consumption in EA-Conflo-IRMS system on determination of nitrogen isotope ratio in marine sediments[J]. Geological Review, 2015, 61(Suppl 1):1 -2 (in Chinese).[18] HAN W, FENG L, LI H, LIU W. Bulk δ15N measurements of organic-rich rock samples by elemental analyzer/isotope ratio mass spectrometry with enhanced oxidation ability[J]. Rapid Communications in Mass Spectrometry, 2017, 31(1): 16 -20 . doi: 10.1002/rcm.7754[19] WANG N, LIU J, ZHANG Y, XIA C, LIN D, CHE Y, WU J, BAO R. Influences of oxidation ability on precision in nitrogen isotope measurements of organic reference materials using elemental analysis-isotope ratio mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2021, 35(14): e9122. doi: 10.1002/rcm.9122 [20] HANSEN T, SOMMER U. Increasing the sensitivity of δ13C and δ15N abundance measurements by a high sensitivity elemental analyzer connected to an isotope ratio mass spectrometer[J]. Rapid Communications in Mass Spectrometry, 2007, 21(3): 314 -318 . doi: 10.1002/rcm.2847[21] CUI L, WANG X, FENG L. Determination of nitrogen isotopes on samples with tens of nmol of N using the combination of an elemental analyzer, a GasBench interface and an isotope ratio mass spectrometer: an evaluation of blank N contributions and blank-correction[J]. Rapid Communications in Mass Spectrometry, 2019, 33(1): 74 -80 . doi: 10.1002/rcm.8309[22] 尹希杰, 刘维维, 王永涛, 苏静, 李廷伟. 元素分析-同位素质谱联用测定微量氮元素同位素方法研究[J]. 质谱学报, 2021, 42(3): 346 -352 . doi: 10.7538/zpxb.2020.0051 YIN Xijie, LIU Weiwei, WANG Yongtao, SU Jing, LI Tingwei. Determination of δ15N on microgram amounts by modified element analysis-isotope ratio mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2021, 42(3):346 -352 (in Chinese). doi: 10.7538/zpxb.2020.0051[23] ZHONG L, PENG J, HE J, DU Y, XING T, LI J, GUO W, NI Q, HU J, SONG H. Optimizations of the EA-IRMS system for δ15N analysis of trace nitrogen[J]. Applied Geochemistry, 2023, 159: 105 832. [24] STÜEKEN E E, de CASTRO M, KROTZ L, BRODIE C, IAMMARINO M, GIAZZI G. Optimized switch-over between CHNS abundance and CNS isotope ratio analyses by elemental analyzer-isotope ratio mass spectrometry: application to six geological reference materials[J]. Rapid Communications in Mass Spectrometry, 2020, 34(18): e8821. doi: 10.1002/rcm.8821 [25] 胡志中, 晏雄, 金鹭, 赵安坤, 徐国栋, 杜谷. 富有机质页岩氮同位素分析方法研究[J]. 岩矿测试, 2023, 42(4): 677 -690 . HU Zhizhong, YAN Xiong, JIN Lu, ZHAO Ankun, XU Guodong, DU Gu. Nitrogen isotope analysis method of organic-enriched shale[J]. Rock and Mineral Analysis, 2023, 42(4):677 -690 (in Chinese).[26] MERRITT D A, FREEMAN K H, RICCI M P, STUDLEY S A, HAYES J M. Performance and optimization of a combustion interface for isotope ratio monitoring gas chromatography/mass spectrometry[J]. Analytical Chemistry, 1995, 67(14): 2 461-2 473. [27] CARMAN K R, FRY B. Small-sample methods for δ13C and δ15N analysis of the diets of marsh meiofaunal species using natural-abundance and tracer-addition isotope techniques[J]. Marine Ecology Progress Series, 2002, 240: 85-92. -


 首页
首页 登录
登录 注册
注册



 下载:
下载: