-
单离子束[1-3]是一种能够发射单个离子的束流,具有准确定位目标、精确设定剂量等技术功能,离子定位精度优于5 μm,剂量精度为1个离子的剂量。单离子束在低剂量辐射、空间辐射模拟、染色体基因水平辐射生物机理等研究领域获得了广泛的应用[4-10]。中国科学院智能机械研究所于2004年建成国内首台单离子束系统CAS-LIBB(Chinese Academy of Sciences - the Lab of Ion Beam Biology)[1-2],离子最高能量4 MeV,最优束径3 μm,应用于细胞、线虫、拟南芥等微小样品的辐照研究[11-13]。常规单离子束辐照过程中,需用较多的手工操作,单位时间里辐照的细胞数量(即辐照通量)较低,约
1000 细胞/h,不能满足基于高通量细胞的生物学研究要求[14-16]。高通量细胞数据具有统计意义,消除了偶然性因素,另外,细胞实验研究中,常常对细胞进行多项检测,需要大量的细胞才能完成研究内容。因此,提高辐照通量是单离子束系统需要解决的重要问题。将微流控技术应用于单离子束辐照装置,是实现高通量辐照技术的主要方法。CAS-LIBB装置上建立微流控技术后,其辐照通量比之前提高一个数量级。目前,单离子束-微流控细胞辐照技术的文献较为鲜见,国际上对单离子束的研究聚焦于精细束径的发展方向,如研制1 μm至亚微米束,甚至纳米束流。Buonanno等人[17]在单离子束装置上采用了微流控,但该系统仅用于辐照线虫而非微流细胞,并且其微通道入口大、出口小,线虫送入微通道后被限定不动,便于离子定位辐照。辐照结束后,线虫被驱动从入口返回出来。本文辐照系统则采用细胞悬液微流体,实行单列细胞微流体连续化辐照技术,提高了辐照通量和效率,实验条件趋于一致和稳定,更能满足生物学研究的要求。单离子束微流控系统中,离子如何瞄准细胞、如何设定细胞运动参数和系统参数,如何获得最大辐照通量,都是重要的基础问题。本文基于CAS-LIBB单离子束微流控系统,对所述问题进行全面的研究和探讨,以期为单离子束微流控辐照技术提供理论指导。 -
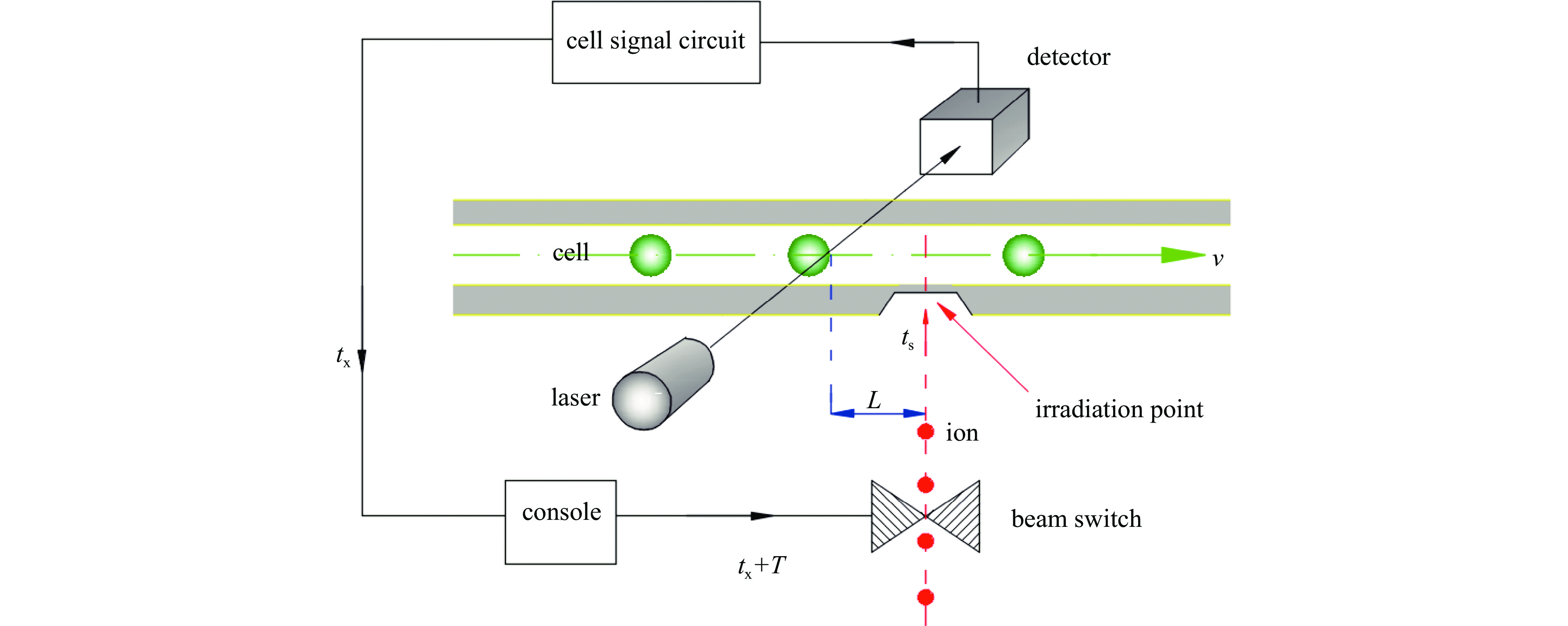
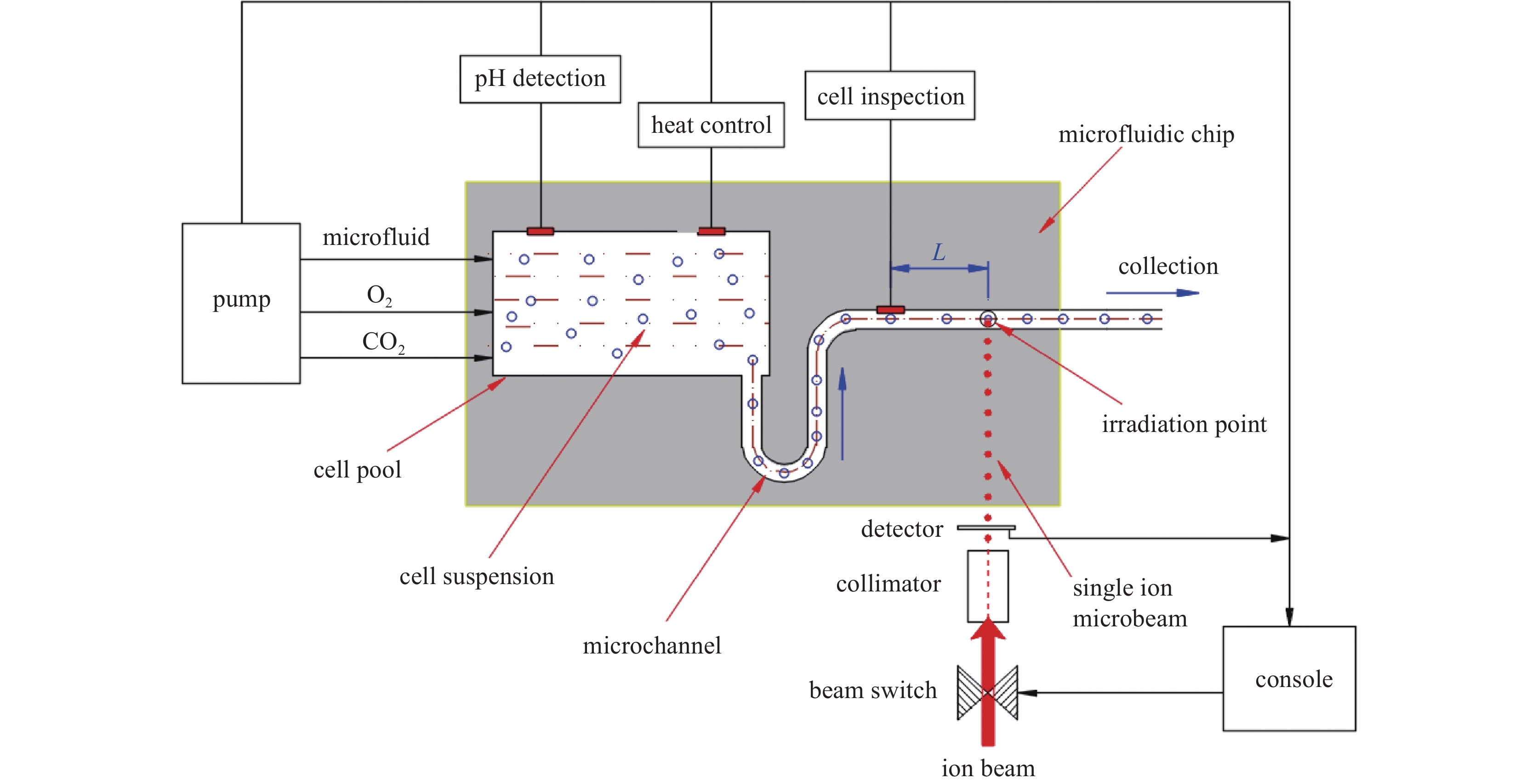
如图1所示,系统由单离子束系统和微流控系统两大部分组成。CAS-LIBB单离子束系统包含微米孔准直器、束流开关、粒子探测器、控制系统等关键结构。微流控系统[18-21]由微流控芯片、微流驱动泵及激光探测系统等构成。微流控芯片前端制作细胞储液池,具有O2和CO2注入通道、37 ℃恒温控制、pH检测等功能,以保障细胞成活。驱动泵驱动细胞微流在微通道里匀速流动,将细胞传至离子出射位置,快速完成对细胞的辐照。细胞速度与微流速度同步相等。调节驱动泵可获得不同的细胞速度。激光探测系统用于检测细胞[22-23],总控台根据细胞运动信息来控制离子束流的发射和切断,保证一定数目的离子准确击中细胞。离子束流和准直器均固定不动,微流细胞保持运动。离子从准直器出口发射出来后,经微流控芯片辐照点位置射入微流通道,完成对细胞的辐照。显然,在细胞到达辐照点之前,必须提前检测和识别细胞,系统根据细胞运动信息,计算细胞和离子二者相遇的条件,适时控制束流开关,使离子和细胞同时达到辐照点位置,实现离子精确定位细胞辐照技术过程。
采用聚二甲基硅氧烷(PDMS)材料制作微流控芯片。与常规微流控芯片不同,辐照用微流控芯片需制作一个辐照点,用于离子进入微流通道的入射点。辐照点是在芯片上制作的一块超薄小区域。经计算和实验确定,对于1~5 MeV质子束,辐照点厚度为10 μm较为合适。过厚会影响离子的穿透性,过薄则易破损,制作难度增大。单离子束垂直向上飞行,故在微通道底部制作辐照点,其水平尺度约30 μm,如图2所示。微流细胞经过辐照点时被离子击中,然后被收集用于生物学研究。
-
如果细胞静止不动,则只需将细胞移至离子束流出口,随时开通束流,即可完成对细胞的辐照。对于细胞持续运动的情形,须考虑瞄准方法,计算离子和细胞二者相互运动关系,使得细胞抵达辐照点时,离子正好击中细胞。
建立计算模型如图3所示,细胞运动方向、激光发射方向和离子发射方向三者两两垂直,离子垂直向上飞行,细胞呈水平运动。假定细胞检测点距离辐照点为L,离子从束流开关抵达辐照点的时间为ts,当细胞抵达检测点时被检测,到束流开关产生动作,这个过程系统总响应时间为tx。由于细胞运动速度v远小于离子速度(MeV级质子速度约107 m/s),且束流开关响应时间快(约μs),因此,细胞到达检测点被检测识别后继续前行时,系统则必须等待(延迟)一段时间T,再开通束流开关,才能保证离子和细胞同时到达辐照点。由此可得离子击中细胞的条件是
理论上只要满足上面的计算式,就能保证离子准确击中细胞。
细胞速度由驱动泵进行设定和驱动。根据本系统实验条件,最大细胞速度不宜超过10 mm/s,否则容易造成细胞碰撞或黏连,堵塞通道,甚至损坏芯片。故将10 mm/s设定为本系统的细胞速度上限,记为vp。现设定细胞速度v = vp = 10 mm/s,总响应时间为tx=10 μs,离子从开关到达辐照点的时间为ts=0.2 μs,按(1)式计算:
$ L=v\times ({t}_{{\mathrm{x}}}+T+ {t}_{{\mathrm{s}}})=0.102\;{\text{μ}}\mathrm{m}+{10}^{4}\;{\text{μ}}\mathrm{m}\times T $ /s。从上面的计算可以推断,如果不设置延时,即T = 0,则L = 0.102 μm,这说明,即便细胞以最大速度运动,则要求细胞检测点远离辐照点仅仅0.102 μm,这个极小距离相对于系统尺度和细胞大小完全可以忽略。而系统实际运行的细胞速度v<vp,上述L的计算值更小,这表明细胞检测点和辐照点极其靠近。因此,本模型将细胞检测点直接设置在辐照点同一位置(或极其接近),即L=0,以省去延时等待的时间T。系统一旦检测到细胞就立即开通束流,则离子就能准确击中细胞。这种忽略的实质是将高速离子的飞行时间近似为0。实际上,这种“即测即打”的方式(L=0,T=0),除了节省了时间外(等待时间T=0),也具有更高的击中可靠性。如果L过大,则细胞在运动过程中,其轨迹和速度难免产生波动,偏离计算值,加大离子瞄准误差。因此,采用“即测即打”方式(L=0,T=0),反而使离子击中细胞的可靠性更高。微流细胞运动速度越小,则细胞之间相互干扰越小,微流更趋稳定一致,所预测离子击打位置的准确性越大。
-
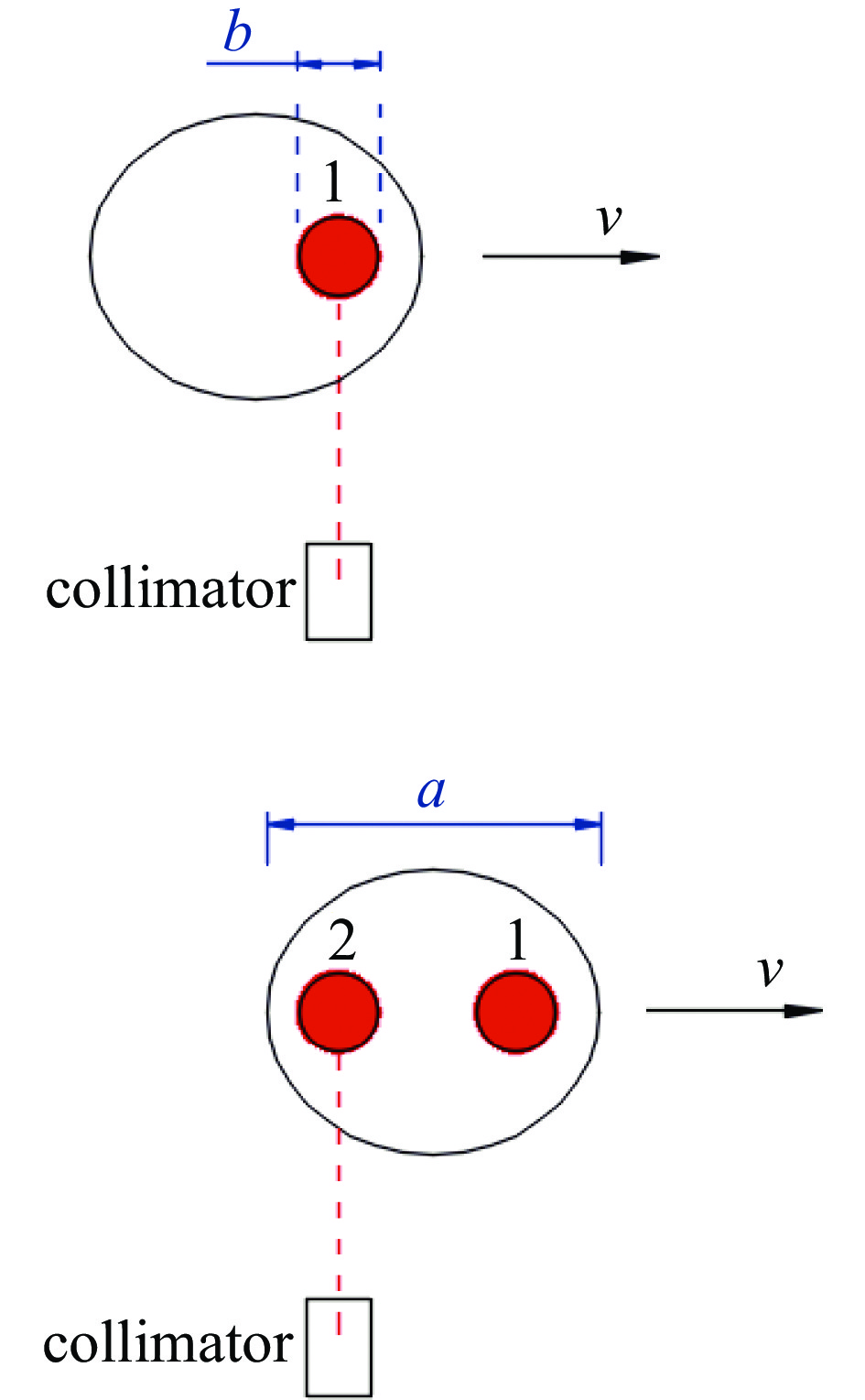
上述计算只考虑了每个细胞被辐照一个离子剂量的情况。多个离子辐照一个细胞的情况具有很大区别。因细胞保持运动,前后发射的离子击打在细胞上的位置是不同的,后发射的离子击中细胞位置较先发射的离子存在一个偏移。假定每个细胞被辐照k个离子,k>1,系统在单位时间里发射离子数为n(称之为离子发射密度),即相邻两个离子的时间间隔为1/n。当k个离子全部辐照完毕时,其总辐照时间为k/n,细胞此时前行的距离必须小于细胞尺度a,否则离子不能击中细胞,见图4。因此,离子击中细胞的必要条件是
因此细胞运动速度必须满足
极限情况下,a取细胞尺度,即得最大细胞速度
式(5)表明,对于多个离子辐照一个细胞的情况,微流细胞速度存在上限vm,其与细胞尺度a和离子发射密度n相关。设定细胞速度为vm时,系统将获得最大辐照通量。但注意vm始终不得超过vp = 10 mm/s,大于vp则不允许执行。
-
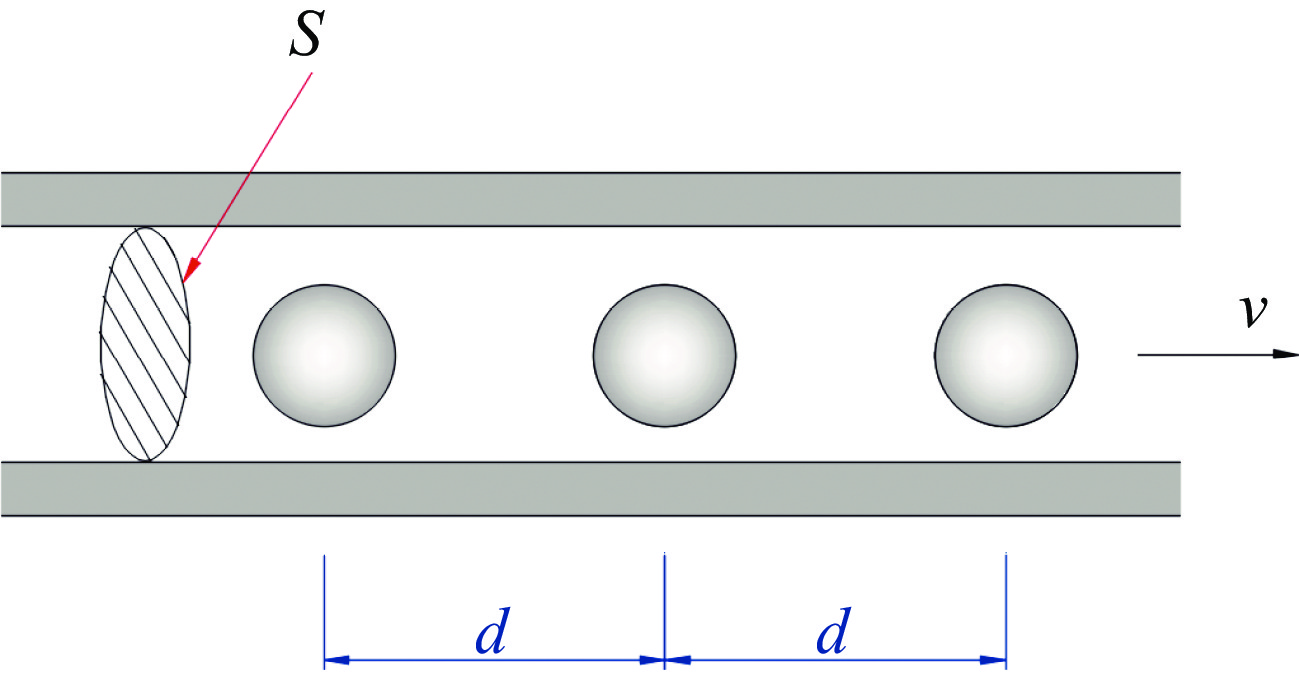
假定微流细胞之间的平均间距为d,则每辐照一个细胞的时间为
因此,细胞辐照通量为
式(7)表明,辐照通量与细胞速度成正比,与细胞间距成反比。(6)和(7)两式与k和n无关,是由速度v计算通量的通用公式。
如果每个细胞只被辐照一个离子剂量,即k=1,则理论上,不管细胞速度多大,都能使离子击中它,但实际系统要求细胞速度v ≤ vp =10 mm/s。取v=vp,由式(7)得单个离子剂量的最大辐照通量为
要实现式(8)中的最大辐照通量,还须要求离子发射密度n≥Qmax,以保证每个细胞均能被辐照一个离子。如果n<Qmax,则当细胞保持vp前行时,部分细胞未被辐照,此时的有效辐照通量Q′= n<Qmax。以d = 0.4 mm为例,辐照1个离子剂量时的最大辐照通量为Qmax=25 个细胞/s=
90000 个细胞/h,这时要求离子发射密度n≥25个离子/s,实际束流系统n$\gg $ 25个离子/s,条件总能得到充分的满足。如果每个细胞被辐照多个离子,即k>1,由式(5)和(7)可知,最大辐照通量为式(5)和(9)是重要的参量约束公式, 式(5)控制细胞速度上限,式(9)计算最大辐照通量。由式(9)可知,提高辐照通量最简捷的方法是适当提高细胞数密度(即减小d),其次是提高离子发射密度n,但n往往受到束流系统固有性能的制约,提升量有限。减小剂量k也能提高辐照通量,但剂量须满足研究者的要求。
通过配制细胞液浓度,来确定细胞间距d与细胞数密度m。假定微通道横截面积为S,细胞呈单列行进通过辐照点,如图5所示,若使微流细胞间距为d,则微流细胞数密度m应配成
式(10)即为悬浮液中细胞间距(平均值)的确定方法。理论上,细胞悬浮液被配置后,其细胞间距与细胞速度无关。据式(10),已知微流细胞数密度为m时,可求平均细胞间距为
-
每个飞行离子的位置和能量都具有随机的发散性[24-25],因此形成了束斑。束斑直径(束径b)等同于离子定位精度,束径大则定位精度低,反之则高。从图4可知,考虑到束径大小后,如要离子击中细胞,则可允许a值缩小到a−b,对照(5)、(9)两式,细胞最大速度和最大辐照通量修正为
二者数值大小均因此而降低。同样,如果计算的vm值大于vp,将视为无效而舍弃。对于单个离子剂量,k=1,最大辐照通量仍由式(8)确定,且与束径大小无关,只要束径小于细胞尺度。其原因是单个离子辐照时,最大细胞速度仍然允许达到vp=10 mm/s,但不能从式(13)外推k=1来求得数据。
-
离子发射密度n可以具体地理解为每秒发射的离子数目,是决定辐照通量大小的基本因素。如果一个细胞只被辐照一个离子,k=1,则离子发射密度等于细胞辐照通量,由式(7)或(8)确定。此时,离子发射密度不受细胞速度影响,不论细胞速度多大(不超过vp),离子都能击中细胞,只需适时发射离子。
如果一个细胞被辐照多个离子,k>1,则要求在细胞前行a−b的时间里,k个离子必须辐照完毕,即k个离子辐照完毕的时间,不能大于细胞前行(a−b)的时间,因此
由此得
式(15)显示离子发射密度n与细胞速度v、辐照剂量k密切相关,细胞尺度a和束径b也灵敏地制约离子发射密度。现举例取细胞速度v=5 mm/s,辐照剂量k=8,若a=20 μm, b=3 μm,由式(15)得n≥
2352 个离子/s。该值属单离子系统常规性能条件。通常,束径b的改变量有限,降低细胞速度可使所需的离子发射密度成比例地降低,这是优化实验的主要方法。(8)、(12)、(13)和(15)四式给出了单离子束-微流控系统的额定性能,是系统运行的参考标准。 -
设计一款微流控芯片,通道截面尺寸为S =30 μm×30 μm,根据式(10)配制细胞悬浮液,使细胞间距约1.0 mm,假定细胞尺度a=20 μm,束径b=3 μm,设定三组离子发射密度和辐照剂量,由(10)、(12)、(13)三式算得几组最大辐照通量如表1所示。
现对表1中第一行进行说明。从式(13)知,求Qmax时必须先确定细胞间距。要使细胞间距d=1 mm,则由式(10),应将悬浮液细胞数密度配制为
2500 /μL;由式(12)得最大细胞速度应设为8.5 mm/s;由式(13)得最大辐照通量等于30600 细胞/h。上述计算数据表示,在辐照剂量为2个离子、细胞间距为1 mm的条件下,具有以下三种理解:
(i)当设定细胞速度等于8.5 mm/s,则2个离子均击中细胞,其辐照通量为最大辐照通量;
(ii)当设定细胞速度小于8.5 mm/s,则2个离子均击中细胞,但辐照通量不是最大值;
(iii)当设定细胞速度大于8.5 mm/s,则2个离子中至少有1个离子不能击中细胞。
可见第(i)情形是最优解,故相应的细胞速度称为最大细胞速度。系统运行时,实际的细胞速度不是必须设为最大细胞速度vm,小于vm的速度是安全可行的。
表1中第二行数据里,计算的细胞速度为17 mm/s,超过了系统允许范围(10 mm/s),因此该组数据不可行而舍弃。由表1可知,多组不同的条件下,辐照通量大都超过
10000 细胞/h,最高的辐照通量超过30000 细胞/h。总体上,高于之前无微流控单离子束辐照通量10倍之多。今选取四组辐照通量的实验数据,见表1中实验值,与计算值的相对误差均在5%之内,负值表示实验值低于计算值。误差原因主要是少数细胞的速度小于设置值,一些细胞的运动状态也存在不流畅情形,导致经过检测点的细胞数量小于理论值,因此降低了辐照通量。
-
将微流控芯片技术应用于离子辐照系统,提升了辐照自动化程度,提高了辐照通量。芯片辐照点的制作是一项新的微流控工艺。将辐照点和细胞检测点置于同一位置,实行“即测即打”的工作模式,压缩了辐照时间,提高了离子定位的准确性。建立了理论模型,获得细胞速度、最大辐照通量与多个系统参量的约束关系。计算表明,对于不同的离子剂量、细胞间距和离子发射密度,存在相应的最大细胞速度vm(vm<vp);细胞速度等于vm时,可以获得最大辐照通量;提高辐照通量的首选方法是适当提高细胞数密度。计算数据和实验结果基本吻合,二者误差小于5%。
本系统尚有待发展完善,如辐照点薄层结构的抗压能力较弱,细胞速度受限,影响辐照通量的进一步提高,可以寻求高韧性薄膜嵌入微流控芯片来解决问题;激光光路和显微镜光路各自分立,影响检测灵敏度和工作效率,需研制一体化集成结构;发展1 μm聚焦单离子束,实现基因水平的定位辐照,为研究基因断裂和修复、细胞凋亡等重要课题提供先进的技术平台。本文所建立的模型和计算结果对于单离子束-微流控系统的运行具有普适性的理论指导作用,是离子精准定位微流细胞的基本方法。单离子束-微流控系统提高了自动化程度,在智能化细胞检测技术、在线检测技术、细胞跟踪分析等领域都具有潜在可行的拓展应用。
单离子束-微流控细胞高通量辐照技术
High throughput of cell irradiation with microfluidics in single ion microbeam system
-
摘要: 辐照通量是指单位时间里离子辐照的细胞数量,是单离子束细胞辐照系统的重要性能指标。为提高单离子定位辐照通量,将微流控技术应用于单离子束细胞辐照系统,实现了单离子-单细胞精确定位自动辐照技术。微流控芯片上建立细胞储液池、O2和CO2注入通道、恒温加热、pH检测、细胞检测等功能机构。细胞微流受驱动在通道中保持运动,离子经微流控芯片辐照点射入微通道,对动态细胞进行辐照。基于CAS-LIBB装置,建立离子定位微流细胞的计算模型,研究离子精确瞄准微流细胞的基本方法和规律,获得微流细胞速度、最大辐照通量、辐照剂量、细胞间距等多个参量之间的相互约束关系,成为系统运行的理论指导。提出“即测即打”运行模式,以加快辐照速度,提高离子定位准确性。结果表明,细胞速度和辐照通量均存在上限值,提高微流细胞数密度和离子发射密度,是提高辐照通量的可选方法。采用微流控技术后,辐照通量达到
10000 细胞/h,相比之前提高10倍以上。计算数据和实验结果基本吻合。Abstract: The irradiation throughout means the amount of the cells irradiated per unit time, which is the important performance indicator of a single ion microbeam system. To improve the single ion localization irradiation throughout, microfluidic chip technology is applied to the single ion beam cell irradiation system with single ion to single cell auto-irradiation. A cell storage pool, O2 and CO2 injection channels, constant temperature control, pH detection and cell inspection are built on the chip. Ions irradiate the moving cells through the irradiation point on the microfluidic chip. Based CAS-LIBB system, this article establishes a computational model for ion targeting microfluidic cells. The basic methods and laws of ion targeting microfluidic cells are studied, therefore it has obtained the multi-relationships among cell velocity, irradiation throughout, irradiation dose, and cell separation, which are the theoretical guidance for system operation. A mode of “Promptly Irradiate with Inspected” is proposed to improve the irradiating effectivity and accuracy. The results show that there is an upper limit for cell speed as well as for irradiation throughout, and increasing cell number density and ion emission density are the most feasible ways to raise the irradiation throughout. With the microfluidic technology, the irradiation throughout now reaches10000 cells/h, more than 10 times higher than before. The calculated data is basically consistent with the experimental results.-
Key words:
- single ion microbeam /
- microfluidics /
- irradiation throughout /
- localized irradiation /
- microflow of cells .
-

-
表 1 设计实例数据
Table 1. Data of a design example
k d/mm n/s−1 m/μL−1 vm/(mm·s−1) Qmax /h−1 Q/h−1 relative error/% 2 1.0 1000 2500 8.5 30600 − − 2 1.0 2000 2500 17.0 61200 invalid − 5 1.0 1000 2500 3.4 12240 11861 −3.1 5 1.0 2000 2500 6.8 24480 23427 −4.3 10 1.0 1000 2500 1.7 6120 5954 −2.7 10 1.0 2000 2500 3.4 12240 11775 −3.8 -
[1] Hu Zhiwen, Chen Lianyun, Li Jun, et al. High-localized cell irradiation at the CAS-LIBB single-particle microbeam[J]. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms, 2006, 244(2): 462-466. [2] 詹福如, 许明亮, 许永建, 等. 单离子束技术概述[J]. 强激光与粒子束, 2007, 19(11):1913-1917 Zhan Furu, Xu Mingliang, Xu Yongjian, et al. Review of single ion microbeam technology[J]. High Power Laser and Particle Beams, 2007, 19(11): 1913-1917 [3] Randers-Pehrson G, Geard C R, Johnson G, et al. The Columbia University single-ion microbeam[J]. Radiation Research, 2001, 156(2): 210-214. doi: 10.1667/0033-7587(2001)156[0210:TCUSIM]2.0.CO;2 [4] Shafirkin A V, Grigoriev Y G, Ushakov I B. More precise determination of the relative biological effectiveness of fast neutrons and accelerated multi-charged ions at low doses for estimation of the risk of injury of brain and lens neurons[J]. Human Physiology, 2020, 46(7): 722-730. doi: 10.1134/S0362119720070130 [5] Almahwasi A. Low dose hyper-radiosensitivity in normal human cells[J]. Radiation Physics and Chemistry, 2023, 202: 110523. doi: 10.1016/j.radphyschem.2022.110523 [6] Joshi G S, Joiner M C, Tucker J D. Cytogenetic characterization of low-dose hyper-radiosensitivity in Cobalt-60 irradiated human lymphoblastoid cells[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2014, 770: 69-78. doi: 10.1016/j.mrfmmm.2014.09.006 [7] Brenner D J, Elliston C D. The potential impact of bystander effects on radiation risks in a mars mission[J]. Radiation Research, 2001, 156(5): 612-617. doi: 10.1667/0033-7587(2001)156[0612:TPIOBE]2.0.CO;2 [8] Abdelhakm L O, Kandil E I, Mansour S Z, et al. Chrysin encapsulated copper nanoparticles with low dose of gamma radiation elicit tumor cell death through p38 MAPK/NF-κB pathways[J]. Biological Trace Element Research, 2023, 201(11): 5278-5297. doi: 10.1007/s12011-023-03596-1 [9] Okada M, Okabe A, Uchihori Y, et al. Single extreme low dose/low dose rate irradiation causes alteration in lifespan and genome instability in primary human cells[J]. British Journal of Cancer, 2007, 96(11): 1707-1710. doi: 10.1038/sj.bjc.6603775 [10] Zhou Hongning, Randers-Pehrson G, Geard C R, et al. Interaction between radiation-induced adaptive response and bystander mutagenesis in mammalian cells[J]. Radiation Research, 2003, 160(5): 512-516. doi: 10.1667/RR3083 [11] Guo Xiaoying, Sun Jie, Bian Po, et al. Radiation-induced bystander signaling from somatic cells to germ cells in Caenorhabditis elegans[J]. Radiation Research, 2013, 180(3): 268-275. doi: 10.1667/RR3218.1 [12] Yang Gen, Wu Lijun, Chen Lianyun, et al. Targeted irradiation of shoot apical meristem of Arabidopsis embryos induces long-distance bystander/abscopal effects[J]. Radiation Research, 2007, 167(3): 298-305. doi: 10.1667/RR0710.1 [13] Li Lu, Wang Lu, Prise K M, et al. Akt/mTOR mediated induction of bystander effect signaling in a nucleus independent manner in irradiated human lung adenocarcinoma epithelial cells[J]. Oncotarget, 2017, 8(11): 18010-18020. doi: 10.18632/oncotarget.14931 [14] Hu Beiyu, Xu Bingxue, Yun Juanli, et al. High-throughput single-cell cultivation reveals the underexplored rare biosphere in deep-sea sediments along the Southwest Indian Ridge[J]. Lab on a Chip, 2020, 20(2): 363-372. doi: 10.1039/C9LC00761J [15] 姚波, 何巧红, 杜文斌, 等. 微流控高通量试样引入技术的研究进展[J]. 色谱, 2009, 27(5):662-666 doi: 10.3321/j.issn:1000-8713.2009.05.018 Yao Bo, He Qiaohong, Du Wenbin, et al. Developments of high-throughput microfluidic sample introduction techniques[J]. Chinese Journal of Chromatography, 2009, 27(5): 662-666 doi: 10.3321/j.issn:1000-8713.2009.05.018 [16] Simchi M, Riordon J, Wang Yihe, et al. High-throughput sperm DNA analysis at the single-cell and population levels[J]. Analyst, 2023, 148(16): 3748-3757. doi: 10.1039/D3AN00564J [17] Buonanno M, Garty G, Grad M, et al. Microbeam irradiation of C. elegans nematode in microfluidic channels[J]. Radiation and Environmental Biophysics, 2013, 52(4): 531-537. doi: 10.1007/s00411-013-0485-6 [18] Chen Dongwei, Nie Mengyue, Tang Wei, et al. Whole lifecycle observation of single-spore germinated Streptomyces using a nanogap-stabilized microfluidic chip[J]. mLife, 2022, 1(3): 341-349. doi: 10.1002/mlf2.12039 [19] Zhou Yang, Yu Zhibin, Wu Man, et al. Single-cell sorting using integrated pneumatic valve droplet microfluidic chip[J]. Talanta, 2023, 253: 124044. doi: 10.1016/j.talanta.2022.124044 [20] Gebreyesus S T, Muneer G, Huang C C, et al. Recent advances in microfluidics for single-cell functional proteomics[J]. Lab on a Chip, 2023, 23(7): 1726-1751. doi: 10.1039/D2LC01096H [21] Roper M G. Cellular analysis using microfluidics[J]. Analytical Chemistry, 2016, 88(1): 381-394. doi: 10.1021/acs.analchem.5b04532 [22] Tkaczyk A H, Tkaczyk E R, Norris T B, et al. Microfluidic droplet consistency monitoring and encapsulated cell detection via laser excitation[J]. Journal of Mechanics in Medicine and Biology, 2011, 11(1): 1-14. doi: 10.1142/S0219519410003617 [23] Larson A P, Ahlberg H, Folestad S. Semiconductor laser-induced fluorescence detection in picoliter volume flow cells[J]. Applied Optics, 1993, 32(6): 794-805. doi: 10.1364/AO.32.000794 [24] Zhan Furu, Qi Xuehong, Xu Mingliang, et al. Improvement of the energy stability of the single ion microbeam[J]. Plasma Science and Technology, 2008, 10(2): 250-253. doi: 10.1088/1009-0630/10/2/23 [25] Xu Mingliang, Xu Yongjian, Zhan Furu, et al. Analysis and optimization of stability of CAS-LIBB single ion microbeam[J]. Plasma Science and Technology, 2008, 10(5): 651-654. doi: 10.1088/1009-0630/10/5/24 -


 首页
首页 登录
登录 注册
注册



 下载:
下载: